人教版化学必修二第一章第三节-化学键(2)(共58张PPT)
文档属性
| 名称 | 人教版化学必修二第一章第三节-化学键(2)(共58张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 1.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-02-14 00:00:00 | ||
图片预览






文档简介
(共60张PPT)
第一课时 离子键
第三节 化学键
[思考与交流]
1.为什么一百多种元素可形成千千万万种物质?
2. 为什么两个氢原子可以形成氢分子,而两个氦原子却不能形成氦分子?
3.化合物中原子为什么总是按一定数目相结合?
通过本节课的学习,我们就能解决这个问题。
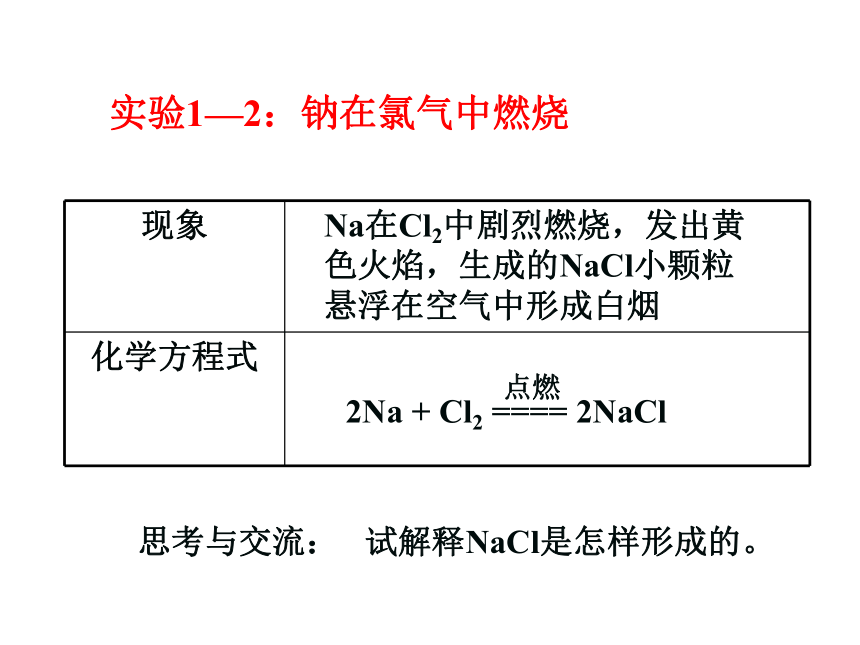
实验1—2:钠在氯气中燃烧
Na在Cl2中剧烈燃烧,发出黄色火焰,生成的NaCl小颗粒悬浮在空气中形成白烟
思考与交流: 试解释NaCl是怎样形成的。
现象
化学方程式
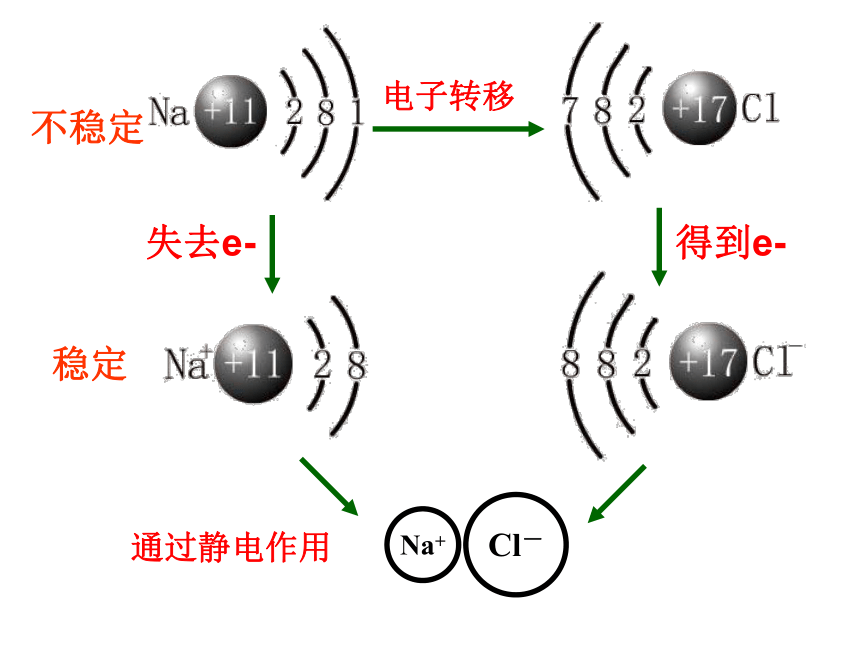
不稳定
稳定
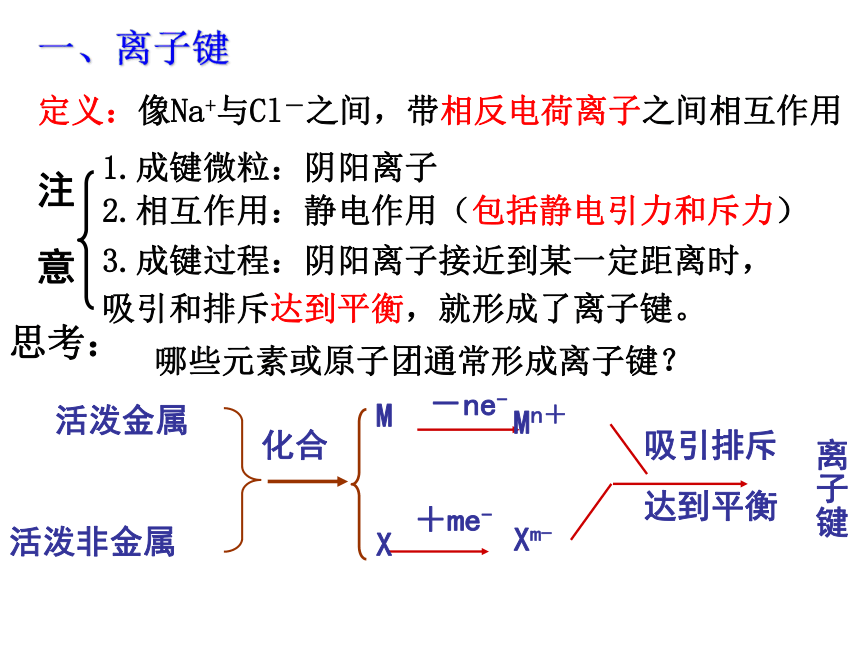
像Na+与Cl-之间,带相反电荷离子之间相互作用
1.成键微粒:阴阳离子
2.相互作用:静电作用(包括静电引力和斥力)
3.成键过程:阴阳离子接近到某一定距离时,吸引和排斥达到平衡,就形成了离子键。
哪些元素或原子团通常形成离子键?
一、离子键
定义:
注 意
思考:
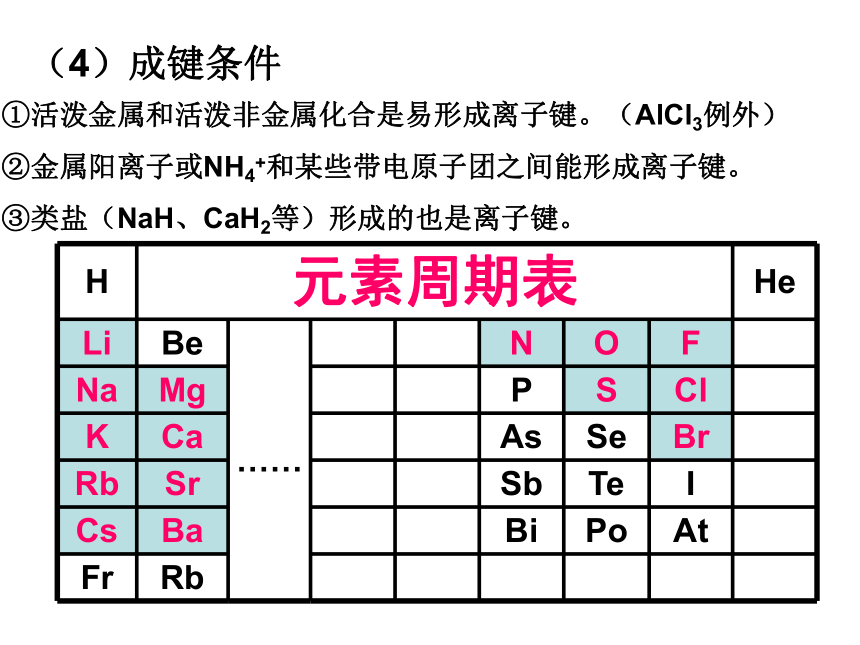
(4)成键条件
①活泼金属和活泼非金属化合是易形成离子键。(AlCl3例外)
②金属阳离子或NH4+和某些带电原子团之间能形成离子键。
③类盐(NaH、CaH2等)形成的也是离子键。
H 元素周期表 He
Li Be …… N O F
Na Mg P S Cl
K Ca As Se Br
Rb Sr Sb Te I
Cs Ba Bi Po At
Fr Rb
5.存在:离子化合物
大多数含活泼金属的化合物与铵盐.
如KCl、CaCO3、NaCl、NH4Cl、Na2O等
离子化合物:由离子键构成的化合物。
判断一种化合物是否是离子化合物的方法:在熔融状态能导电的化合物即为离子化合物;否则不是。
[特别提醒] AlCl3、BeCl2等虽含金属元素,但它们不是离子化合物。
2.含有金属元素的化合物不一定是离子化合物。如AlCl3
离子化合物中离子键一般比较牢固破坏它需要很高的能量,所以离子化合物的熔点一般比较高,常温下为固体。离子化合物在溶于水或者受热融化时,离子键破坏,形成自由移动的阴阳离子,能够导电。
注意:
6.离子化合物的性质:
1.含有离子键的化合物一定是离子化合物。
3.不含金属元素的化合物不一定不是离子化合物。如铵盐
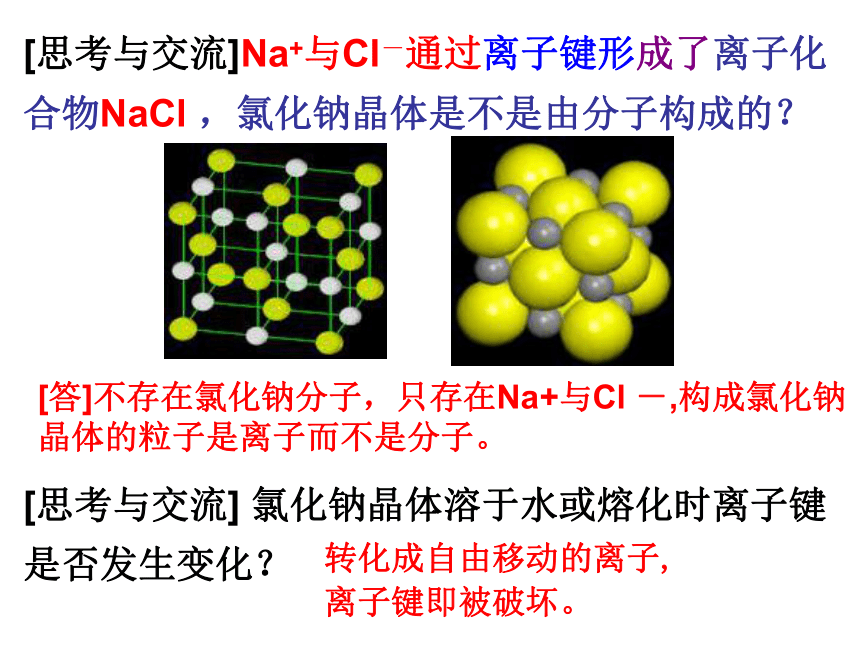
[思考与交流]Na+与Cl-通过离子键形成了离子化合物NaCl ,氯化钠晶体是不是由分子构成的?
[答]不存在氯化钠分子,只存在Na+与Cl -,构成氯化钠晶体的粒子是离子而不是分子。
[思考与交流] 氯化钠晶体溶于水或熔化时离子键是否发生变化?
转化成自由移动的离子,离子键即被破坏。
H ·
Na×
·Mg ·
×Ca×
a.原子的电子式
3、用电子式表示化合物的形成
电子式:在元素符号周围用小黑点(·)或小叉(×)表示原子的最外层电子的式子
b.离子的电子式
金属阳离子的电子式就是其离子符号
阴离子的电子式要标 [ ] 及“ 电荷数 ”
如何用电子式表示离子化合物的形成过程?
例:用电子式表示氯化钠、溴化钙的形成过程
Na ·
+
→
Na+
·Ca·
+
+
→
Ca2+
1.原子A的电子式 + 原子B的电子式→化合物的电子式
2.不能把“→”写成“=”。
3.在箭头右边,不能把相同离子合并在一起,应逐个写。箭头左方相同的微粒可以合并.
+
·Ca·
→
Ca2+
2
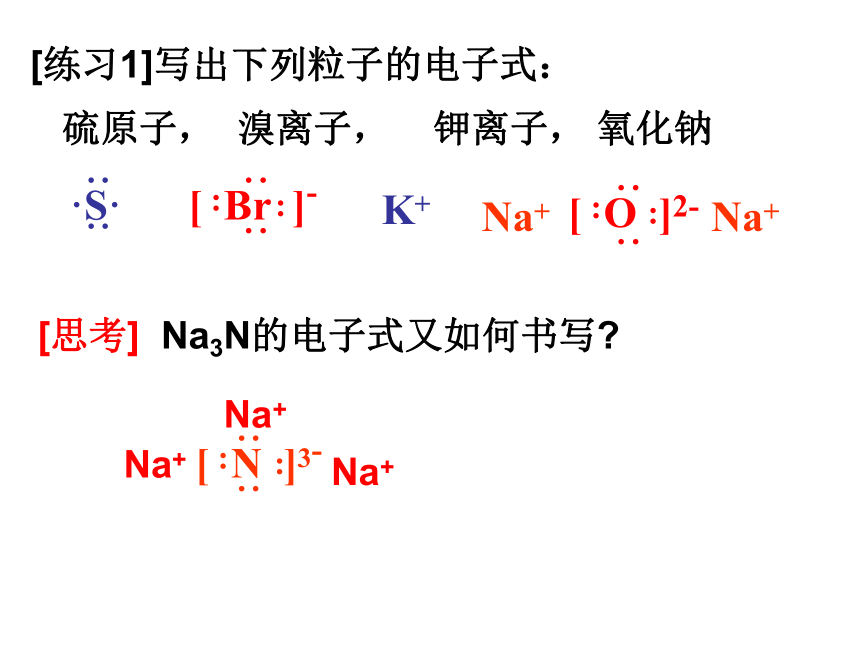
[练习1]写出下列粒子的电子式:
硫原子, 溴离子, 钾离子, 氧化钠
K+
[思考] Na3N的电子式又如何书写?
[练习2] 用电子式表示下列离子化合物的形成过程
氧化镁:
硫化钾:
[练习3]下列说法正确的是( )
A.离子键就是使阴、阳离子结合成化合物的静电作用
B.所有金属与所有非金属原子之间都能形成离子键
C.在化合物CaCl2中,两个氯离子之间也存在离子键
D.钠原子与氯原子结合成氯化钠分子
A
[练习4]下列各数值表示有关元素的原子序数,其所表示的各原子组中能以离子键相互结合成稳定化合物的是( )
A. 10与12 B. 8与17
C. 11与17 D. 6与14
C
[练习5]某化合物XY2中,各离子的电子层结构相同,且电子总数为54,则XY2的化学式为________,电子式为________________。
CaCl2
[练习6] X元素位于ⅡA族,原子核内有12个中子,它在最高价氧化物中的质量分数是60%,Y元素原子的原子核外有9个电子,X与Y能形成稳定化合物,该化合物的化学式是______,它是通过______键结合的,它形成过程的电子式
为 _________________________________。
MgF2
离子
本节小结
离子键:使阴、阳离子结合成化合物的静电作用.
(成键粒子、成键条件)
活泼金属原子M
活泼非金属原子N
失去电子
得到电子
阳离子Mm+
阴离子Nn-
静电作用 静电吸引=静电排斥
离 子 键
离子化合物
用电子式表示
例
我们知道钠在氯气中燃烧生成氯化钠,氯化钠是由钠离子和氯离子间的静电作用形成的。那我们在初中学习过的共价化合物HCl的形成和NaCl一样吗?H2和Cl2在点燃或光照的情况下,H2和Cl2分子被破坏成原子,当氢原子和氯原子相遇时是通过什么样的方式结合在一起的?是通过阴阳离子间静电作用结合在一起的吗?
[思考与交流]
它们之间通过共用电子对的方法使双方最外电子层均达到稳定结构。
☆★氯原子和氢原子之间通过共用电子对的方法使双方最外电子层均达到稳定结构。
氯化氢分子的形成:
+
→
H ·
(1)定义:原子之间通过共用电子对所形成的相互作用,叫做共价键。
二、共价键
[思考] 成键时,共用电子对在两个原子的中间还是偏向其中一方,为什么?
[成键特点] 共用电子对偏向氯原子,使氯原子带部分负电荷,氢原子带部分正电荷。
[思考与交流]为什么H2 、Cl2 是双原子分子,而稀有气体为单原子分子?
氢分子的形成:
+
H ·
· H
→
[思考] 成键时,共用电子对在两个原子的中间还是偏向其中一方,为什么?
[成键特点]共用电子对不偏移,成键原子不显电性。
☆★稀有气体元素的原子最外层电子数已达到2个或8个电子的稳定结构,不能再通过共用电子对相结合。
(1)定义:原子之间通过共用电子对所形成的相互作用,叫做共价键。
二、共价键
(2)成键微粒:
(3)相互作用:
原子
共用电子对
(4)成键条件:
同种或不同种非金属元素
共价化合物:象HCl这样以共用电子对
形成分子的化合物。
2.共价键的形成过程——电子式表示
[思考] 用电子式表示HCl、H2、Cl2、H2O分子的形成过程。
结构式 :用一根短线表示一对共用电子对的式子,而其他不共用的电子省略
H-Cl H-H Cl-Cl H-O-H
[练习] 写出下列物质的电子式和结构式。
电子式 结构式
HCl
H2O
NH3
N2
HClO
CO2
H2O2
H—Cl
H—O—H
N≡N
H—O—Cl
O=C=O
H—O—O—H
3.共价键的分类
(1)非极性共价键(简称非极性键)
概念:成键的共用电子对不发生偏向的共价键。
形成条件:同种元素的原子间。
例如,H—H键、N≡N键等。
(2)极性共价键(简称极性键)
概念:成键的共用电子对发生偏移的共价键。
形成条件:不同种元素的原子间。
例如,H—X键、H—O—Cl 键等。
离子键和共价键的比较
[ ]
+
-
离子键 共价键
成键微粒 阴、阳离子 原子
成键本质 静电作用 共用电子对
表示法 以NaCl为例
以为HCl例
成键元素 典型的金属元素、典型的非金属元素之间 同种元素或同类非金属元素之间
[思考与交流] 离子化合物与共价化合物有什么区别?
离子化合物:由离子键构成的化合物。
(1)强碱:如NaOH、Ca(OH)2等
(2)绝大多数盐:如Na2S、NH4Cl等
(3)活泼金属的氧化物:如Na2O、CaO等
(4)活泼金属与活泼非金属形成的化合物:如NaF、MgS
共价化合物:不同原子间以共用电子对形成分子的化合物。
非金属氢化物、非金属氧化物、酸,还有如AlCl3、BeCl2等。
判断的实验方法:抓化合物熔融状态是否导电。
有离子键,但可能有共价键
全部为共价键,不能有离子键
另:非金属单质(N2、卤素等)也含有共价键。但稀有气体原子不含化学键(达到了8电子(或2电子)稳定)
练习:下列物质中
1.含离子键的物质是
2.含非极性共价键的物质是
3.含极性共价键的物质是
A. KF B. H2O C. N2 D. F2
E. CS2 F. CaCl2、 G. CH4
H. CCl4 I. Br2 J. PH3
A、F、
B、E、G、H、J
C、D、I、
请分析:
Na2O2 NaOH NH4Cl中所含的化学键
[思考] 下列说法正确的是___________。
a.构成单质分子的粒子一定含有共价键
b.离子化合物中一定有离子键,也可能含有共价键;共价化合物中只含共价键,一定不含离子键
c.全部由非金属元素组成的化合物既可能是共价化合物,又可能是离子化合物
d.不同种元素组成的多原子分子里的化学键一定只含极性键
e.硫酸分子中只含共价键,MgCl2中既有离子键又有共价键,NaOH为离子化合物,其中含有共价键和离子键,Na2O2中既有离子键,又有非极性共价键
b、c
三、化学键的概念
使离子相结合或原子相结合的作用力叫做化学键。
四、化学反应的本质
结论:化学反应的过程,本质上就是旧化学键的断裂和新化学键形成的过程。
[讨论]用化学键的观点分析化学反应过程:
2.H和Cl结合生成HCl,形成了H和Cl之间的化学键H-Cl(新化学键)
用化学键的观点来分析H2与Cl2反应的过程,可以把它想象为2个步骤:
两者缺一不可
1.H2和Cl2中的化学键断裂(旧化学键),生成H和Cl
[思考1]:物质溶于水,在水的作用下电离出阴阳离子,是否发生化学变化?
离子化合物受热变为熔融状态,是否发生化学变 化?
不是化学变化。因为只有化学键断裂,无新键生成
[思考2]:NH4Cl受热分解需要断裂那些化学键,生成哪些化学键?
断裂N-H共价键、NH4+(阳离子)和Cl-(阴离子)之间的离子键
生成H-Cl共价键键
[科学视野] 分子间作用力和氢键
(思考)
1.在100℃、101 kPa时,将1 mol H2O(l)变成1 mol H2O(g)需吸收能量47.3 kJ。
想一想:以上两种变化所消耗的能量差距为什么有这么大呢?
2.将水分子分解为氢气和氧气需1000℃以上的高温,已知将1 mol H2O拆分为2 mol H和1 mol O需吸收能量436 kJ。
五、分子间作用力和氢键
分子与分子之间也是有相互作用的。
1.分子间作用力(又称范德华力):分子之间存在的那种把分子聚集在一起的作用力。
分子间作用力是一种微弱的相互作用,比化学键弱得多,它对物质的熔点、沸点、溶解性等物理性质有影响。
一般来说,对于组成和结构相似的物质,相对分子质量越大,分子间作用力越大,物质的熔点、沸点也越高。
2.氢键
一些氢化物的沸点
氢键比化学键弱,但比分子间作用力(范德华力)稍强。可以把氢键看作是一种较强的分子间作用力。
它只在非金属性较强且原子半径较小的F、O、N原子与H原子之间形成。如存在于H2O、HF、NH3、CH3CH2OH等部分物质中的一种特殊的分子间作用力。
氢键不是化学键
(1)氢键形成的条件
①分子中必须有H原子与其他原子形成的强极性键。如H―F。
②分子中必须有吸引电子能力很强、原子半径很小的非金属原子。如F、O、N。
*(2)氢键的表示方法:用“X―H…Y”表示,三原子要在一条直线上,其中X、Y可同可不同。如F―H…F、O―H…O、N―H…O。
(3)氢键的相对强弱:比化学键弱得多,但比分子间作用力(范德华力)强。
氢键的形成会使含有氢键的物质的熔、沸点大大升高。如:水的沸点高、氨易液化等。这是因为固体熔化或液体汽化时,必须破坏分子间作用力和氢键
氢键的形成对物质的溶解性也有影响,如:NH3极易溶于水。
(4)氢键作用:使物质有较高的熔沸点(H2O、 HF 、NH3) 使物质易溶于水(C2H5OH,CH3COOH) 解释一些反常现象
知识拓展
共价型分子中8电子稳定结构的判断
1.若分子中含有氢元素
氢原子不能满足最外层8电子稳定结构,只能形成最外层2电子稳定结构。
2.若分子中没有氢元素
对于非金属其他元素而言,如果该元素的原子在由共价键形成的分子中所形成的共用电子对个数为 8,那么该化合物中该元素的原子一定满足最外层8电子稳定结构,否则不满足。
I化合价I+族序数=2
I化合价I+族序数=8
[例题1]下列分子中所有原子都满足最外层8电子结构的是( )
A.光气(COCl2) B.六氟化硫
C.次氯酸 D.五氯化磷
E.BF3 F.H2O
A
[例题2] 下列说法中正确的是( )
A.离子化合物中可能含有共价键,共价化合物中不含离子键
B.冰融化时只需要克服范德华力
C.氨分解时主要克服分子间作用力和氢键的作用
D.水在结冰时体积膨胀,是由于水分子之间存在氢键
AD
[例题3]下列各组物质中均存在着范德华力和氢键的是( )
A.液氨和水 B.氢气和氟气
C.氨气和酒精 D.盐酸和二氧化硫
A
[例1] 用电子式表示下列共价分子的形成过程
碘
水
二氧化碳
氨
+
→
2 H ·
+
→
3 H ·
+
→
+
2
→
(5)共价键的类型
非极性键:
共用电子对不偏移,成键原子不显电性的共价键
H﹣H
(结构式)
I - I
特点:同种元素的原子之间形成的共价键。
极性键:
共用电子对偏移的共价键。
H﹣Cl
(结构式)
特点:不同种元素的原子之间形成的共价键。
两个原子对电子的吸引能力相差越大,键的极性越大.如:极性: H-F > H-Cl
☆★特殊的共价键:----- 配位键
共用电子对由某一原子单方面提供,而为两个原子所共用所形成的共价键。
如:NH4+的形成:
+ H +
配位键
配位键,箭头由提供电子的一方指向接受电子的一方。
☆在NH4+中,4个N-H完全相同。
[思考]氢氧化钠晶体中,钠离子与氢氧根离子以离子键结合;在氢氧根离子中,氢与氧以共价键结合。请用电子式表示氢氧化钠。
[思考]过氧化钠晶体中,过氧根离子 (O2 ) 2-与钠
离子以离子键结合;在过氧根离子中,两个氧
原子以共价键结合。请用电子式表示过氧化钠。
注意:含有共价键的化合物不一定是共价化合物,但含有离子键的化合物一定是离子化合物。
[思考与交流] 非金属元素原子之间能否形成离子键?
能(多原子之间) ,例如:NH4Cl、NH4HCO3等。
[思考与交流] 下列说法正确的是( )
A.含有金属元素的化合物一定是离子化合物
B.ⅠA族和ⅦA族原子化合时,一定生成离子键
C.由非金属元素形成的化合物一定不是离子化合物
D.活泼金属与活泼非金属化合时,能形成离子键
D
[过渡]从有关离子键和共价键的讨论中,我们可以看到,离子键使离子结合成离子化合物;共价键使原子结合成共价化合物分子这种使离子相结合或原子相结合的作用力统称为化学键。
三 、化学键(使离子相结合或原子相结合的作用力统称为化学键)
[思考与交流] 用化学键的观点来分析化学反应的本质是什么?
四 、化学反应的本质(动画演示)
一个化学反应的的过程,本质上就是旧化学键断裂和新化学键形成的过程。
[简介]分子间作用力和氢键
☆分子间作用力(范德华力)
1)概念:存在于分子之间的微弱作用力。
2)意义:决定分子晶体的物理性质。如力越大熔沸点越高
组成和结构相似:分子量越大,力越大。
如熔沸点 CF44)与化学键的比较
化学键 分子间作用力
概念 原子或离子间强烈相互作用 分子间微弱的相互作用
能量 一般较高 较低
性质影响 主要影响物质的化学性质 主要影响物质的物理性质
[简介]分子间作用力和氢键
☆氢键
[阅读思考]阅读P24 图1-12和1-13,回答:为什么NH3、H2O、HF的沸点出现反常?
它们的分子之间除了分子间作用力外,还存在氢键。氢键可以看成是较强的分子间作用力。其能量比分子间作用力强。
氢键存在与固体和液体中。
含有氢键的固体熔化或液体气化时还需破坏分子间的氢键,需要更多的能量。
(1)形成
(2)存在
(3)影响
一般:吸引电子能力强的原子(N、O、F)
和H原子间可形成氢键
分子间氢键影响分子晶体的熔点和沸点。
使其熔点和沸点升高。
[思考与交流] 共价化合物在熔化或气化时,共价键是否被破坏?
只破坏分子间作用力,共价键未被破坏。这与离子化合物不同。
D
[练习1]下列电子式中,正确的是 ( )
[练习2] 判断下列微粒:Cl2 、N2 、HCl、NH3 、Na2SO4、H2O2 所含有化学键的类型。
Cl2、N2非极性键;
HC、NH3极性键;
H2O2既有极性键又有非极性键;
Na2SO4既有极性键又有离子键。
[练习3] 下列叙述正确的是( )
A.N2分子间存在着非极性共价键
B.CO2分子内存在着极性共价键
C.SO2与H2O反应的产物是离子化合物
D.盐酸中含有H+和Cl-,故HCl为离子化合物
A B
[练习4]下列物质中,属于共价化合物的是
A. NH4Cl B. H2SO4
C. NaCl D. I2
B
[练习5] 下列各分子中所有原子都满足最外层为8电子结构的是( )
A、 BeCl2 B、 PCl3
C、 PCl5 D、 N2
BD
第一课时 离子键
第三节 化学键
[思考与交流]
1.为什么一百多种元素可形成千千万万种物质?
2. 为什么两个氢原子可以形成氢分子,而两个氦原子却不能形成氦分子?
3.化合物中原子为什么总是按一定数目相结合?
通过本节课的学习,我们就能解决这个问题。
实验1—2:钠在氯气中燃烧
Na在Cl2中剧烈燃烧,发出黄色火焰,生成的NaCl小颗粒悬浮在空气中形成白烟
思考与交流: 试解释NaCl是怎样形成的。
现象
化学方程式
不稳定
稳定
像Na+与Cl-之间,带相反电荷离子之间相互作用
1.成键微粒:阴阳离子
2.相互作用:静电作用(包括静电引力和斥力)
3.成键过程:阴阳离子接近到某一定距离时,吸引和排斥达到平衡,就形成了离子键。
哪些元素或原子团通常形成离子键?
一、离子键
定义:
注 意
思考:
(4)成键条件
①活泼金属和活泼非金属化合是易形成离子键。(AlCl3例外)
②金属阳离子或NH4+和某些带电原子团之间能形成离子键。
③类盐(NaH、CaH2等)形成的也是离子键。
H 元素周期表 He
Li Be …… N O F
Na Mg P S Cl
K Ca As Se Br
Rb Sr Sb Te I
Cs Ba Bi Po At
Fr Rb
5.存在:离子化合物
大多数含活泼金属的化合物与铵盐.
如KCl、CaCO3、NaCl、NH4Cl、Na2O等
离子化合物:由离子键构成的化合物。
判断一种化合物是否是离子化合物的方法:在熔融状态能导电的化合物即为离子化合物;否则不是。
[特别提醒] AlCl3、BeCl2等虽含金属元素,但它们不是离子化合物。
2.含有金属元素的化合物不一定是离子化合物。如AlCl3
离子化合物中离子键一般比较牢固破坏它需要很高的能量,所以离子化合物的熔点一般比较高,常温下为固体。离子化合物在溶于水或者受热融化时,离子键破坏,形成自由移动的阴阳离子,能够导电。
注意:
6.离子化合物的性质:
1.含有离子键的化合物一定是离子化合物。
3.不含金属元素的化合物不一定不是离子化合物。如铵盐
[思考与交流]Na+与Cl-通过离子键形成了离子化合物NaCl ,氯化钠晶体是不是由分子构成的?
[答]不存在氯化钠分子,只存在Na+与Cl -,构成氯化钠晶体的粒子是离子而不是分子。
[思考与交流] 氯化钠晶体溶于水或熔化时离子键是否发生变化?
转化成自由移动的离子,离子键即被破坏。
H ·
Na×
·Mg ·
×Ca×
a.原子的电子式
3、用电子式表示化合物的形成
电子式:在元素符号周围用小黑点(·)或小叉(×)表示原子的最外层电子的式子
b.离子的电子式
金属阳离子的电子式就是其离子符号
阴离子的电子式要标 [ ] 及“ 电荷数 ”
如何用电子式表示离子化合物的形成过程?
例:用电子式表示氯化钠、溴化钙的形成过程
Na ·
+
→
Na+
·Ca·
+
+
→
Ca2+
1.原子A的电子式 + 原子B的电子式→化合物的电子式
2.不能把“→”写成“=”。
3.在箭头右边,不能把相同离子合并在一起,应逐个写。箭头左方相同的微粒可以合并.
+
·Ca·
→
Ca2+
2
[练习1]写出下列粒子的电子式:
硫原子, 溴离子, 钾离子, 氧化钠
K+
[思考] Na3N的电子式又如何书写?
[练习2] 用电子式表示下列离子化合物的形成过程
氧化镁:
硫化钾:
[练习3]下列说法正确的是( )
A.离子键就是使阴、阳离子结合成化合物的静电作用
B.所有金属与所有非金属原子之间都能形成离子键
C.在化合物CaCl2中,两个氯离子之间也存在离子键
D.钠原子与氯原子结合成氯化钠分子
A
[练习4]下列各数值表示有关元素的原子序数,其所表示的各原子组中能以离子键相互结合成稳定化合物的是( )
A. 10与12 B. 8与17
C. 11与17 D. 6与14
C
[练习5]某化合物XY2中,各离子的电子层结构相同,且电子总数为54,则XY2的化学式为________,电子式为________________。
CaCl2
[练习6] X元素位于ⅡA族,原子核内有12个中子,它在最高价氧化物中的质量分数是60%,Y元素原子的原子核外有9个电子,X与Y能形成稳定化合物,该化合物的化学式是______,它是通过______键结合的,它形成过程的电子式
为 _________________________________。
MgF2
离子
本节小结
离子键:使阴、阳离子结合成化合物的静电作用.
(成键粒子、成键条件)
活泼金属原子M
活泼非金属原子N
失去电子
得到电子
阳离子Mm+
阴离子Nn-
静电作用 静电吸引=静电排斥
离 子 键
离子化合物
用电子式表示
例
我们知道钠在氯气中燃烧生成氯化钠,氯化钠是由钠离子和氯离子间的静电作用形成的。那我们在初中学习过的共价化合物HCl的形成和NaCl一样吗?H2和Cl2在点燃或光照的情况下,H2和Cl2分子被破坏成原子,当氢原子和氯原子相遇时是通过什么样的方式结合在一起的?是通过阴阳离子间静电作用结合在一起的吗?
[思考与交流]
它们之间通过共用电子对的方法使双方最外电子层均达到稳定结构。
☆★氯原子和氢原子之间通过共用电子对的方法使双方最外电子层均达到稳定结构。
氯化氢分子的形成:
+
→
H ·
(1)定义:原子之间通过共用电子对所形成的相互作用,叫做共价键。
二、共价键
[思考] 成键时,共用电子对在两个原子的中间还是偏向其中一方,为什么?
[成键特点] 共用电子对偏向氯原子,使氯原子带部分负电荷,氢原子带部分正电荷。
[思考与交流]为什么H2 、Cl2 是双原子分子,而稀有气体为单原子分子?
氢分子的形成:
+
H ·
· H
→
[思考] 成键时,共用电子对在两个原子的中间还是偏向其中一方,为什么?
[成键特点]共用电子对不偏移,成键原子不显电性。
☆★稀有气体元素的原子最外层电子数已达到2个或8个电子的稳定结构,不能再通过共用电子对相结合。
(1)定义:原子之间通过共用电子对所形成的相互作用,叫做共价键。
二、共价键
(2)成键微粒:
(3)相互作用:
原子
共用电子对
(4)成键条件:
同种或不同种非金属元素
共价化合物:象HCl这样以共用电子对
形成分子的化合物。
2.共价键的形成过程——电子式表示
[思考] 用电子式表示HCl、H2、Cl2、H2O分子的形成过程。
结构式 :用一根短线表示一对共用电子对的式子,而其他不共用的电子省略
H-Cl H-H Cl-Cl H-O-H
[练习] 写出下列物质的电子式和结构式。
电子式 结构式
HCl
H2O
NH3
N2
HClO
CO2
H2O2
H—Cl
H—O—H
N≡N
H—O—Cl
O=C=O
H—O—O—H
3.共价键的分类
(1)非极性共价键(简称非极性键)
概念:成键的共用电子对不发生偏向的共价键。
形成条件:同种元素的原子间。
例如,H—H键、N≡N键等。
(2)极性共价键(简称极性键)
概念:成键的共用电子对发生偏移的共价键。
形成条件:不同种元素的原子间。
例如,H—X键、H—O—Cl 键等。
离子键和共价键的比较
[ ]
+
-
离子键 共价键
成键微粒 阴、阳离子 原子
成键本质 静电作用 共用电子对
表示法 以NaCl为例
以为HCl例
成键元素 典型的金属元素、典型的非金属元素之间 同种元素或同类非金属元素之间
[思考与交流] 离子化合物与共价化合物有什么区别?
离子化合物:由离子键构成的化合物。
(1)强碱:如NaOH、Ca(OH)2等
(2)绝大多数盐:如Na2S、NH4Cl等
(3)活泼金属的氧化物:如Na2O、CaO等
(4)活泼金属与活泼非金属形成的化合物:如NaF、MgS
共价化合物:不同原子间以共用电子对形成分子的化合物。
非金属氢化物、非金属氧化物、酸,还有如AlCl3、BeCl2等。
判断的实验方法:抓化合物熔融状态是否导电。
有离子键,但可能有共价键
全部为共价键,不能有离子键
另:非金属单质(N2、卤素等)也含有共价键。但稀有气体原子不含化学键(达到了8电子(或2电子)稳定)
练习:下列物质中
1.含离子键的物质是
2.含非极性共价键的物质是
3.含极性共价键的物质是
A. KF B. H2O C. N2 D. F2
E. CS2 F. CaCl2、 G. CH4
H. CCl4 I. Br2 J. PH3
A、F、
B、E、G、H、J
C、D、I、
请分析:
Na2O2 NaOH NH4Cl中所含的化学键
[思考] 下列说法正确的是___________。
a.构成单质分子的粒子一定含有共价键
b.离子化合物中一定有离子键,也可能含有共价键;共价化合物中只含共价键,一定不含离子键
c.全部由非金属元素组成的化合物既可能是共价化合物,又可能是离子化合物
d.不同种元素组成的多原子分子里的化学键一定只含极性键
e.硫酸分子中只含共价键,MgCl2中既有离子键又有共价键,NaOH为离子化合物,其中含有共价键和离子键,Na2O2中既有离子键,又有非极性共价键
b、c
三、化学键的概念
使离子相结合或原子相结合的作用力叫做化学键。
四、化学反应的本质
结论:化学反应的过程,本质上就是旧化学键的断裂和新化学键形成的过程。
[讨论]用化学键的观点分析化学反应过程:
2.H和Cl结合生成HCl,形成了H和Cl之间的化学键H-Cl(新化学键)
用化学键的观点来分析H2与Cl2反应的过程,可以把它想象为2个步骤:
两者缺一不可
1.H2和Cl2中的化学键断裂(旧化学键),生成H和Cl
[思考1]:物质溶于水,在水的作用下电离出阴阳离子,是否发生化学变化?
离子化合物受热变为熔融状态,是否发生化学变 化?
不是化学变化。因为只有化学键断裂,无新键生成
[思考2]:NH4Cl受热分解需要断裂那些化学键,生成哪些化学键?
断裂N-H共价键、NH4+(阳离子)和Cl-(阴离子)之间的离子键
生成H-Cl共价键键
[科学视野] 分子间作用力和氢键
(思考)
1.在100℃、101 kPa时,将1 mol H2O(l)变成1 mol H2O(g)需吸收能量47.3 kJ。
想一想:以上两种变化所消耗的能量差距为什么有这么大呢?
2.将水分子分解为氢气和氧气需1000℃以上的高温,已知将1 mol H2O拆分为2 mol H和1 mol O需吸收能量436 kJ。
五、分子间作用力和氢键
分子与分子之间也是有相互作用的。
1.分子间作用力(又称范德华力):分子之间存在的那种把分子聚集在一起的作用力。
分子间作用力是一种微弱的相互作用,比化学键弱得多,它对物质的熔点、沸点、溶解性等物理性质有影响。
一般来说,对于组成和结构相似的物质,相对分子质量越大,分子间作用力越大,物质的熔点、沸点也越高。
2.氢键
一些氢化物的沸点
氢键比化学键弱,但比分子间作用力(范德华力)稍强。可以把氢键看作是一种较强的分子间作用力。
它只在非金属性较强且原子半径较小的F、O、N原子与H原子之间形成。如存在于H2O、HF、NH3、CH3CH2OH等部分物质中的一种特殊的分子间作用力。
氢键不是化学键
(1)氢键形成的条件
①分子中必须有H原子与其他原子形成的强极性键。如H―F。
②分子中必须有吸引电子能力很强、原子半径很小的非金属原子。如F、O、N。
*(2)氢键的表示方法:用“X―H…Y”表示,三原子要在一条直线上,其中X、Y可同可不同。如F―H…F、O―H…O、N―H…O。
(3)氢键的相对强弱:比化学键弱得多,但比分子间作用力(范德华力)强。
氢键的形成会使含有氢键的物质的熔、沸点大大升高。如:水的沸点高、氨易液化等。这是因为固体熔化或液体汽化时,必须破坏分子间作用力和氢键
氢键的形成对物质的溶解性也有影响,如:NH3极易溶于水。
(4)氢键作用:使物质有较高的熔沸点(H2O、 HF 、NH3) 使物质易溶于水(C2H5OH,CH3COOH) 解释一些反常现象
知识拓展
共价型分子中8电子稳定结构的判断
1.若分子中含有氢元素
氢原子不能满足最外层8电子稳定结构,只能形成最外层2电子稳定结构。
2.若分子中没有氢元素
对于非金属其他元素而言,如果该元素的原子在由共价键形成的分子中所形成的共用电子对个数为 8,那么该化合物中该元素的原子一定满足最外层8电子稳定结构,否则不满足。
I化合价I+族序数=2
I化合价I+族序数=8
[例题1]下列分子中所有原子都满足最外层8电子结构的是( )
A.光气(COCl2) B.六氟化硫
C.次氯酸 D.五氯化磷
E.BF3 F.H2O
A
[例题2] 下列说法中正确的是( )
A.离子化合物中可能含有共价键,共价化合物中不含离子键
B.冰融化时只需要克服范德华力
C.氨分解时主要克服分子间作用力和氢键的作用
D.水在结冰时体积膨胀,是由于水分子之间存在氢键
AD
[例题3]下列各组物质中均存在着范德华力和氢键的是( )
A.液氨和水 B.氢气和氟气
C.氨气和酒精 D.盐酸和二氧化硫
A
[例1] 用电子式表示下列共价分子的形成过程
碘
水
二氧化碳
氨
+
→
2 H ·
+
→
3 H ·
+
→
+
2
→
(5)共价键的类型
非极性键:
共用电子对不偏移,成键原子不显电性的共价键
H﹣H
(结构式)
I - I
特点:同种元素的原子之间形成的共价键。
极性键:
共用电子对偏移的共价键。
H﹣Cl
(结构式)
特点:不同种元素的原子之间形成的共价键。
两个原子对电子的吸引能力相差越大,键的极性越大.如:极性: H-F > H-Cl
☆★特殊的共价键:----- 配位键
共用电子对由某一原子单方面提供,而为两个原子所共用所形成的共价键。
如:NH4+的形成:
+ H +
配位键
配位键,箭头由提供电子的一方指向接受电子的一方。
☆在NH4+中,4个N-H完全相同。
[思考]氢氧化钠晶体中,钠离子与氢氧根离子以离子键结合;在氢氧根离子中,氢与氧以共价键结合。请用电子式表示氢氧化钠。
[思考]过氧化钠晶体中,过氧根离子 (O2 ) 2-与钠
离子以离子键结合;在过氧根离子中,两个氧
原子以共价键结合。请用电子式表示过氧化钠。
注意:含有共价键的化合物不一定是共价化合物,但含有离子键的化合物一定是离子化合物。
[思考与交流] 非金属元素原子之间能否形成离子键?
能(多原子之间) ,例如:NH4Cl、NH4HCO3等。
[思考与交流] 下列说法正确的是( )
A.含有金属元素的化合物一定是离子化合物
B.ⅠA族和ⅦA族原子化合时,一定生成离子键
C.由非金属元素形成的化合物一定不是离子化合物
D.活泼金属与活泼非金属化合时,能形成离子键
D
[过渡]从有关离子键和共价键的讨论中,我们可以看到,离子键使离子结合成离子化合物;共价键使原子结合成共价化合物分子这种使离子相结合或原子相结合的作用力统称为化学键。
三 、化学键(使离子相结合或原子相结合的作用力统称为化学键)
[思考与交流] 用化学键的观点来分析化学反应的本质是什么?
四 、化学反应的本质(动画演示)
一个化学反应的的过程,本质上就是旧化学键断裂和新化学键形成的过程。
[简介]分子间作用力和氢键
☆分子间作用力(范德华力)
1)概念:存在于分子之间的微弱作用力。
2)意义:决定分子晶体的物理性质。如力越大熔沸点越高
组成和结构相似:分子量越大,力越大。
如熔沸点 CF4
化学键 分子间作用力
概念 原子或离子间强烈相互作用 分子间微弱的相互作用
能量 一般较高 较低
性质影响 主要影响物质的化学性质 主要影响物质的物理性质
[简介]分子间作用力和氢键
☆氢键
[阅读思考]阅读P24 图1-12和1-13,回答:为什么NH3、H2O、HF的沸点出现反常?
它们的分子之间除了分子间作用力外,还存在氢键。氢键可以看成是较强的分子间作用力。其能量比分子间作用力强。
氢键存在与固体和液体中。
含有氢键的固体熔化或液体气化时还需破坏分子间的氢键,需要更多的能量。
(1)形成
(2)存在
(3)影响
一般:吸引电子能力强的原子(N、O、F)
和H原子间可形成氢键
分子间氢键影响分子晶体的熔点和沸点。
使其熔点和沸点升高。
[思考与交流] 共价化合物在熔化或气化时,共价键是否被破坏?
只破坏分子间作用力,共价键未被破坏。这与离子化合物不同。
D
[练习1]下列电子式中,正确的是 ( )
[练习2] 判断下列微粒:Cl2 、N2 、HCl、NH3 、Na2SO4、H2O2 所含有化学键的类型。
Cl2、N2非极性键;
HC、NH3极性键;
H2O2既有极性键又有非极性键;
Na2SO4既有极性键又有离子键。
[练习3] 下列叙述正确的是( )
A.N2分子间存在着非极性共价键
B.CO2分子内存在着极性共价键
C.SO2与H2O反应的产物是离子化合物
D.盐酸中含有H+和Cl-,故HCl为离子化合物
A B
[练习4]下列物质中,属于共价化合物的是
A. NH4Cl B. H2SO4
C. NaCl D. I2
B
[练习5] 下列各分子中所有原子都满足最外层为8电子结构的是( )
A、 BeCl2 B、 PCl3
C、 PCl5 D、 N2
BD
