鲁教化学下册第7单元第四节 酸碱中和反应(共17张PPT)
文档属性
| 名称 | 鲁教化学下册第7单元第四节 酸碱中和反应(共17张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 1.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-02-16 00:00:00 | ||
图片预览






文档简介
(共17张PPT)
1、溶液的酸碱性可用酸碱指示剂测定:
紫色石蕊试液在酸性溶液中变 ,在碱性溶液中变 。无色酚酞试液在酸性溶液中 ,在碱性溶液中变 。
不变色
红色
蓝色
红色
中性
碱性
酸性
pH值越大,碱性越强
pH值越小,酸性越强
同学们有这样的经历吗?
这是因为肥皂水中的碱与蚊虫分泌物中的酸发生了化学反应。
蚊虫叮咬后,可以涂上肥皂水
以减轻皮肤的痒痛。
2.碱为什么有共同的化学性质?
1.酸为什么有共同的化学性质?
NaOH = Na+ + OH-
KOH = K+ + OH-
Ca(OH)2 = Ca2+ + 2OH-
HCl = H+ + Cl-
H2SO4 = 2H+ + SO42-
HNO3 = H+ + NO3-
把具有上述特点的酸溶液和碱溶液相混合,它们之间是否会也能发生化学反应呢?
氢氧化钠溶液和盐酸可以发生反应吗?让我们做个实验看一下
没有现象就说明没有反应吗?
酸和碱之间的反应
用什么方法可以证明酸和碱
之间可以发生反应?
可以在酸或碱中加入指示剂以显示它的存在,然后加入碱或酸直到溶液变为另一种颜色或者褪色。
相关
链接
酸红碱蓝石蕊液 酸无碱红是酚酞
活动与探究
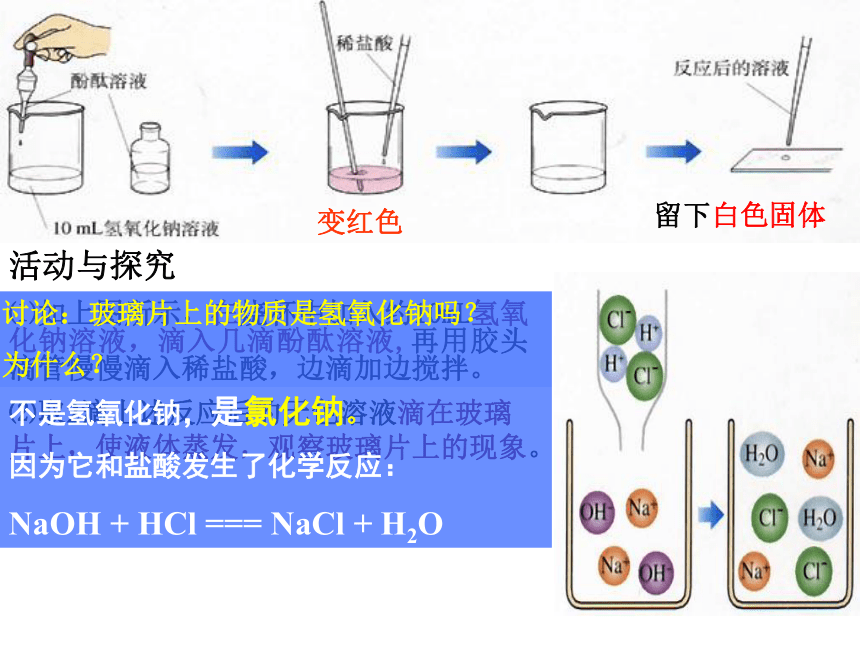
⑴如上图所示,在烧杯中加入约10mL氢氧化钠溶液,滴入几滴酚酞溶液,再用胶头滴管慢慢滴入稀盐酸,边滴加边搅拌。
⑵取2滴上述反应后的无色溶液滴在玻璃片上,使液体蒸发,观察玻璃片上的现象。
变红色
留下白色固体
讨论:玻璃片上的物质是氢氧化钠吗?
为什么?
不是氢氧化钠,是氯化钠。
因为它和盐酸发生了化学反应:
NaOH + HCl === NaCl + H2O
酸 性
碱性
HCl 和NaOH反应的微观示意图
中 性
消失的粒子:
生成的粒子:
反应的微观实质:
H+ + OH- —— H2O
H+、OH-
H2O分子
2HCl + Ca(OH)2 === CaCl2 + 2H2O
H2SO4 + 2NaOH === Na2SO4 + 2H2O
寻找酸和碱反应的规律
盐酸与氢氧化钙:
硫酸与氢氧化钠
: 酸与碱 作用生成 盐和水 的反应,
叫做中和反应。
酸 + 碱 → 盐 + 水
2、中和反应中加酚酞试液的目的是什么?
指示中和反应是否能发生
H+ + OH- —— H2O
中和反应的微观实质:
在下列反应中, 哪些属于中和反应?
MgO+2HCI==MgCI2+H2O
CO2+Ca(OH)2==CaCO3↓+2H2O
2KOH+H2SO4==K2SO4+2H2O
√
二.学以致用
问题:一块土壤酸性太强,不利于苹果树
的生长,应怎样降低该土壤的酸性?
(1)改变土壤的酸碱性
---中和反应在实际中的应用
问题 :如果你是某硫酸厂的厂长,你厂排放的污水
中含有硫酸等物质,为了保护环境,你会采
取怎样的措施来治理?
(2)处理工厂的废水
Ca(OH)2 + H2SO4 = CaSO4 + 2H2O
说明书
成份:氢氧化铝、碘甲基蛋氨酸、颠茄。
作用与用途:
具有除酸、收敛与促进溃疡愈合的作用。适用于胃溃疡、十二指肠溃疡、急慢性胃炎、胃酸过多、胃痉挛所致的胃痛。
用法与用量:口服,一次1粒,一日3次。
(3)用于医药
3HCl + Al(OH)3 = AlCl3 + 3H2O
原理:
皮蛋(松花蛋)有涩味,如何验证它呈酸性还是碱性,在食用前如何除去涩味?
1.中和反应在生活中有广泛应用,下列应用不属于中和反应( )
A.用盐酸除铁锈
B.服用含有氢氧化镁的药物治疗胃酸过多
C.用熟石灰改良酸性土壤
D.用硫酸处理印染厂含碱废水
A
2.在探究盐酸的性质时,下列实验中测得溶液pH的变化符合右图的是( )
A.向盐酸中加水稀释
B.向盐酸中加硝酸银溶液
C.向盐酸中加氯化钠溶液
D.向盐酸中加氢氧化钡溶液
D
1、溶液的酸碱性可用酸碱指示剂测定:
紫色石蕊试液在酸性溶液中变 ,在碱性溶液中变 。无色酚酞试液在酸性溶液中 ,在碱性溶液中变 。
不变色
红色
蓝色
红色
中性
碱性
酸性
pH值越大,碱性越强
pH值越小,酸性越强
同学们有这样的经历吗?
这是因为肥皂水中的碱与蚊虫分泌物中的酸发生了化学反应。
蚊虫叮咬后,可以涂上肥皂水
以减轻皮肤的痒痛。
2.碱为什么有共同的化学性质?
1.酸为什么有共同的化学性质?
NaOH = Na+ + OH-
KOH = K+ + OH-
Ca(OH)2 = Ca2+ + 2OH-
HCl = H+ + Cl-
H2SO4 = 2H+ + SO42-
HNO3 = H+ + NO3-
把具有上述特点的酸溶液和碱溶液相混合,它们之间是否会也能发生化学反应呢?
氢氧化钠溶液和盐酸可以发生反应吗?让我们做个实验看一下
没有现象就说明没有反应吗?
酸和碱之间的反应
用什么方法可以证明酸和碱
之间可以发生反应?
可以在酸或碱中加入指示剂以显示它的存在,然后加入碱或酸直到溶液变为另一种颜色或者褪色。
相关
链接
酸红碱蓝石蕊液 酸无碱红是酚酞
活动与探究
⑴如上图所示,在烧杯中加入约10mL氢氧化钠溶液,滴入几滴酚酞溶液,再用胶头滴管慢慢滴入稀盐酸,边滴加边搅拌。
⑵取2滴上述反应后的无色溶液滴在玻璃片上,使液体蒸发,观察玻璃片上的现象。
变红色
留下白色固体
讨论:玻璃片上的物质是氢氧化钠吗?
为什么?
不是氢氧化钠,是氯化钠。
因为它和盐酸发生了化学反应:
NaOH + HCl === NaCl + H2O
酸 性
碱性
HCl 和NaOH反应的微观示意图
中 性
消失的粒子:
生成的粒子:
反应的微观实质:
H+ + OH- —— H2O
H+、OH-
H2O分子
2HCl + Ca(OH)2 === CaCl2 + 2H2O
H2SO4 + 2NaOH === Na2SO4 + 2H2O
寻找酸和碱反应的规律
盐酸与氢氧化钙:
硫酸与氢氧化钠
: 酸与碱 作用生成 盐和水 的反应,
叫做中和反应。
酸 + 碱 → 盐 + 水
2、中和反应中加酚酞试液的目的是什么?
指示中和反应是否能发生
H+ + OH- —— H2O
中和反应的微观实质:
在下列反应中, 哪些属于中和反应?
MgO+2HCI==MgCI2+H2O
CO2+Ca(OH)2==CaCO3↓+2H2O
2KOH+H2SO4==K2SO4+2H2O
√
二.学以致用
问题:一块土壤酸性太强,不利于苹果树
的生长,应怎样降低该土壤的酸性?
(1)改变土壤的酸碱性
---中和反应在实际中的应用
问题 :如果你是某硫酸厂的厂长,你厂排放的污水
中含有硫酸等物质,为了保护环境,你会采
取怎样的措施来治理?
(2)处理工厂的废水
Ca(OH)2 + H2SO4 = CaSO4 + 2H2O
说明书
成份:氢氧化铝、碘甲基蛋氨酸、颠茄。
作用与用途:
具有除酸、收敛与促进溃疡愈合的作用。适用于胃溃疡、十二指肠溃疡、急慢性胃炎、胃酸过多、胃痉挛所致的胃痛。
用法与用量:口服,一次1粒,一日3次。
(3)用于医药
3HCl + Al(OH)3 = AlCl3 + 3H2O
原理:
皮蛋(松花蛋)有涩味,如何验证它呈酸性还是碱性,在食用前如何除去涩味?
1.中和反应在生活中有广泛应用,下列应用不属于中和反应( )
A.用盐酸除铁锈
B.服用含有氢氧化镁的药物治疗胃酸过多
C.用熟石灰改良酸性土壤
D.用硫酸处理印染厂含碱废水
A
2.在探究盐酸的性质时,下列实验中测得溶液pH的变化符合右图的是( )
A.向盐酸中加水稀释
B.向盐酸中加硝酸银溶液
C.向盐酸中加氯化钠溶液
D.向盐酸中加氢氧化钡溶液
D
同课章节目录
- 第七单元 常见的酸和碱
- 第一节 酸及其性质
- 第二节 碱及其性质
- 第三节 溶液的酸碱性
- 第四节 酸碱中和反应
- 到实验室去:探究酸和碱的化学性质
- 第八单元 海水中的化学
- 第一节 海洋化学资源
- 第二节 海水“晒盐“
- 第三节 海水“制碱“
- 到实验室去:粗盐中难溶性杂质的去除
- 第九单元 金属
- 第一节 常见的金属材料
- 第二节 金属的化学性质
- 第三节 钢铁的锈蚀与防护
- 到实验室去 探究金属的性质
- 第十单元 化学与健康
- 第一节 食物中的有机物
- 第二节 化学元素与人体健康
- 第三节 远离有毒物质
- 第十一单元 化学与社会发展
- 第一节 化学与能源开发
- 第二节 化学与材料研制
- 第三节 化学与农业生产
- 第四节 化学与环境保护
