2020年人教版九年级化学下册同步练习附答案9.3 溶液的浓度
文档属性
| 名称 | 2020年人教版九年级化学下册同步练习附答案9.3 溶液的浓度 |  | |
| 格式 | zip | ||
| 文件大小 | 148.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-02-16 17:01:46 | ||
图片预览



文档简介
课题9.3 溶液的浓度
一、单选题
1.关于100g 5%的NaCl溶液,下列叙述正确的是( )
A.100g水溶解了5g NaCl
B.5g NaCl溶于95g水中
C.溶液中NaCl与水的质量比为1︰20
D.溶液中NaCl与水的质量比为19︰1
2.对于“26%的食盐溶液”的含义解释正确的是( )
A.100g食盐溶液中溶解了26g食盐
B.100g水中溶解了26g食盐
C.将26g食盐溶解在100g水中所得的溶液
D.将食盐与水按13︰50的质量比配成的溶液
3.用、乙两种固体的溶解度曲线如图所示,下列说法正确的是( )。
A.甲的溶解度大于乙的溶解度
B.℃时,甲、乙饱和溶液中溶质的质量分数均为15%
C.℃时,将甲、乙的饱和溶液降温至℃,甲析出的固体一定大于乙
D.℃时,向30g甲、乙中分别加入100g水,所得溶液中溶质的质量分数甲一定大于乙
4.有关溶液(溶质为固体)的说法中,正确的是( )
A.在一定温度下,对于同一溶质的溶液而言,饱和溶液一定比不饱和溶液浓
B.只要温度不变,某物质饱和溶液中溶质的质量分数也不变
C.饱和溶液中析出晶体后,溶质的质量分数一定减小
D.不饱和溶液转化为饱和溶液,其溶质的质量分数一定增大
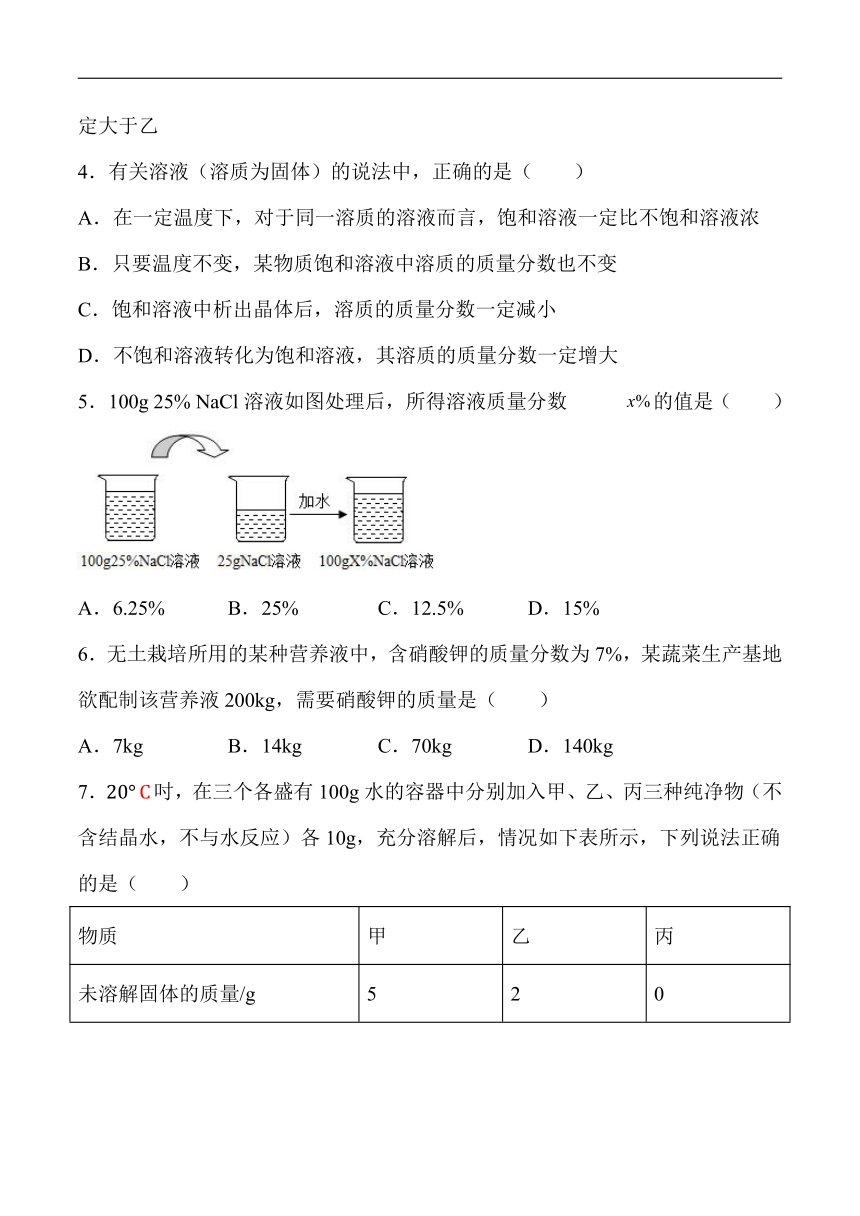
5.100g 25% NaCl溶液如图处理后,所得溶液质量分数 的值是( )
A.6.25% B.25% C.12.5% D.15%
6.无土栽培所用的某种营养液中,含硝酸钾的质量分数为7%,某蔬菜生产基地欲配制该营养液200kg,需要硝酸钾的质量是( )
A.7kg B.14kg C.70kg D.140kg
7.20°?C?吋,在三个各盛有100g水的容器中分别加入甲、乙、丙三种纯净物(不含结晶水,不与水反应)各10g,充分溶解后,情况如下表所示,下列说法正确的是( )
物质
甲
乙
丙
未溶解固体的质量/g
5
2
0
A.所得溶液一定都是饱和溶液 B.丙溶液一定是不饱和溶液
C.丙溶液的溶质质量分数最大 D.20°?C?时,甲的溶解度最大
8.下列关于溶液的叙述中,错误的是( )
A.饱和溶液不一定是浓溶液
B.氢氧化钠固体溶于水时,液体温度升高
C.20%的氯化钠溶液中溶质与溶剂的质量比为1:5
D.从100g质量分数 20%的食盐水中倒出10g,剩余溶液的溶质质量分数仍为20%
9.关于100g5%的氯化钠溶液,下列叙述正确的是( )
A.100g水中溶有5g氯化钠 B.将5g氯化钠溶于95g水中,可制得该溶液
C.溶液中氯化钠与水的质量比为1:20 D.溶液中氯化钠与水的质量比为19:1
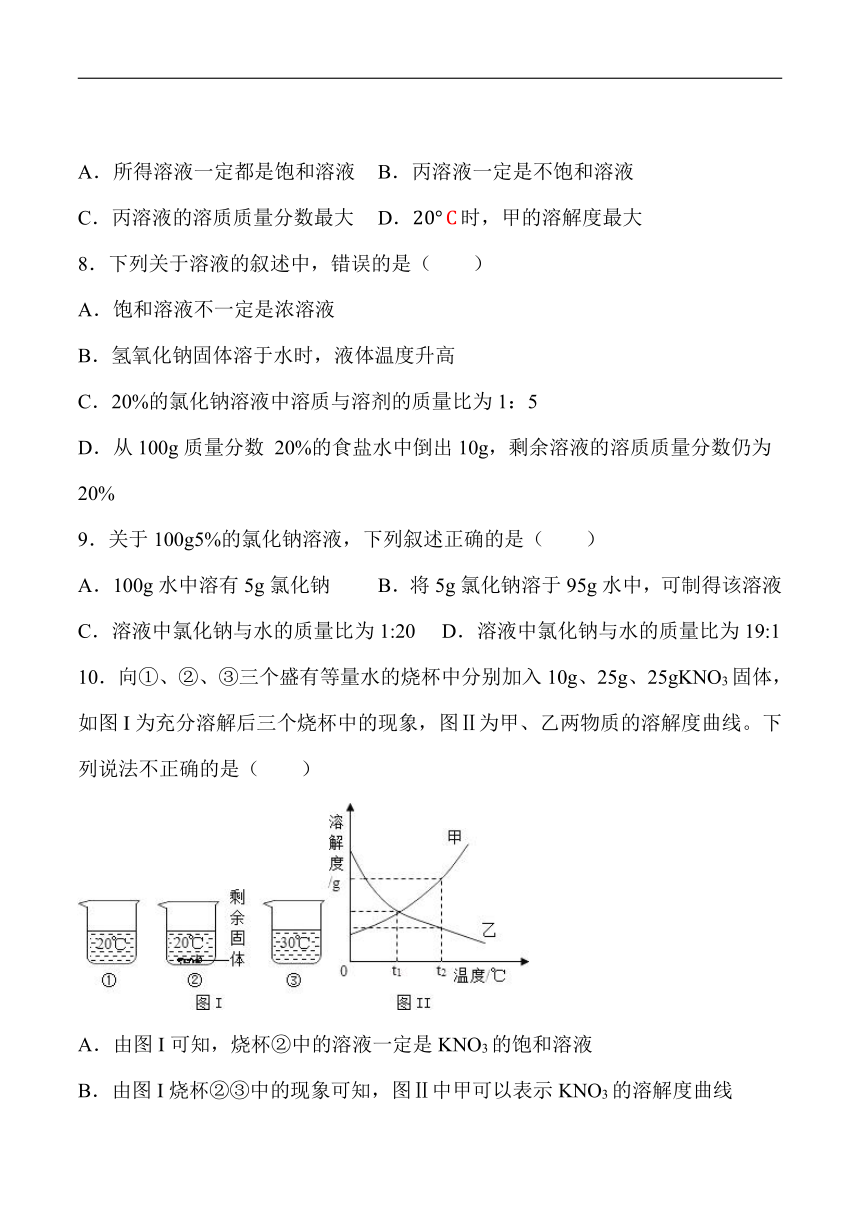
10.向①、②、③三个盛有等量水的烧杯中分别加入10g、25g、25gKNO3固体,如图I为充分溶解后三个烧杯中的现象,图Ⅱ为甲、乙两物质的溶解度曲线。下列说法不正确的是( )
A.由图I可知,烧杯②中的溶液一定是KNO3的饱和溶液
B.由图I烧杯②③中的现象可知,图Ⅱ中甲可以表示KNO3的溶解度曲线
C.t2℃甲、乙溶液中溶质的质量分数甲>乙
D.由图Ⅱ可知,t1℃甲、乙饱和溶液的溶质质量分数相等
二、填空题
11.如图是某输液瓶标签上的部分内容.葡萄糖由 种元素组成,其中碳元素的质量分数为 ,要把10g这种葡萄糖溶液稀释为2%的溶液,需要水的质量为 .
12.欲将80 g质量分数为20%的NaOH溶液稀释到质量分数为10%,需加水__________g
13.如图为A、B、C三种固体物质的溶解度曲线,根据图示完成下列问题:
(1)t2℃时,向70gA物质中加入100g水,充分溶解后,该溶液的溶质质量分数是_____;
(2)用一定的方法,将某温度下C的不饱和溶液变为饱和溶液,下列说法正确的是_____。
a 溶剂的质量可能不变 b 溶质质量分数一定变大
c 溶液的质量可能不变 d 溶质的质量一定变大
四、计算题
14.某学校的学习小组对当地的石灰石矿区进行调查,测定石灰石中碳酸钙的质量分数,取12克样品与100克某浓度的稀盐酸恰好完全反应,完全反应后测得烧杯内剩余物质总质量为107.6克,(已知石灰石样品中含有的二氧化硅等杂质不溶于水,不与稀盐酸反应)。请计算:
①共产生二氧化碳_________克?
②反应后所得溶液的溶质质量分数______?
课题9.3 溶液的浓度
一、单选题
1.关于100g 5%的NaCl溶液,下列叙述正确的是( )
A.100g水溶解了5g NaCl
B.5g NaCl溶于95g水中
C.溶液中NaCl与水的质量比为1︰20
D.溶液中NaCl与水的质量比为19︰1
【答案】B
【解析】100g 5%的NaCl溶液含有NaCl的质量为100g×5%=5g,水的质量为100g-5g=95g.溶液中NaCl与水的质量比为5︰95=1︰19.
2.对于“26%的食盐溶液”的含义解释正确的是( )
A.100g食盐溶液中溶解了26g食盐
B.100g水中溶解了26g食盐
C.将26g食盐溶解在100g水中所得的溶液
D.将食盐与水按13︰50的质量比配成的溶液
【答案】A
【解析】正确理解“26%”的含义,“100”是指溶液的质量为100份,“26”是指食盐的质量为26份,很显然,水的质量为74份.
3.用、乙两种固体的溶解度曲线如图所示,下列说法正确的是( )。
A.甲的溶解度大于乙的溶解度
B.℃时,甲、乙饱和溶液中溶质的质量分数均为15%
C.℃时,将甲、乙的饱和溶液降温至℃,甲析出的固体一定大于乙
D.℃时,向30g甲、乙中分别加入100g水,所得溶液中溶质的质量分数甲一定大于乙
【答案】D
【解析】
A、比较溶解度大小须确定温度,不知温度,无法比较,说法错误;
B、饱和溶液中,℃时,甲、乙溶解度均为15g,则溶质的质量分数为:,说法错误;
C、不知饱和溶液的质量多少,无法判断析出固体质量多少,说法错误;
D、℃时甲的溶解度是30g,乙的溶解度<30g,故向30g甲,乙中分别加入100g水,甲恰好完全溶解,乙溶解的质量小于30g,所以所得溶液中溶质的质量分数甲一定大于乙,说法正确。
故选D。
4.有关溶液(溶质为固体)的说法中,正确的是( )
A.在一定温度下,对于同一溶质的溶液而言,饱和溶液一定比不饱和溶液浓
B.只要温度不变,某物质饱和溶液中溶质的质量分数也不变
C.饱和溶液中析出晶体后,溶质的质量分数一定减小
D.不饱和溶液转化为饱和溶液,其溶质的质量分数一定增大
【答案】A
【解析】
A、在一定温度下,对于同一溶质的溶液而言,饱和溶液一定比不饱和溶液的质量分数大,即饱和溶液一定比不饱和溶液浓,故A正确;
B、一定温度下饱和溶液的溶质质量分数=,温度不变,该物质的溶解度不变,但还能溶解其它溶质,若溶解了其它溶质,其饱和溶液中溶质的质量分数会减小,故B错误;
C、饱和溶液析出晶体后溶质的质量分数是否发生改变,主要是取决于析出晶体的措施;当某物质一定温度下的饱和溶液在温度不变的条件下蒸发溶剂后,有晶体析出,因为温度不变,物质的溶解度不变,溶液中有晶体,剩下的溶液仍为该温度下的饱和溶液,则溶质质量分数不变,故C错误;
D、不饱和溶液转化为饱和溶液,可以采取增加溶质、蒸发溶剂、降低温度等方法,若采用的是降低温度至恰好饱和的方法,由于溶液的组成未发生改变,其溶质的质量分数不变,故D错误。故选A。
5.100g 25% NaCl溶液如图处理后,所得溶液质量分数 的值是( )
A.6.25% B.25% C.12.5% D.15%
【答案】A
【解析】
【详解】
依题意得 25g×25%=100g?x%,解得x%= 6.25%。故选A。
6.无土栽培所用的某种营养液中,含硝酸钾的质量分数为7%,某蔬菜生产基地欲配制该营养液200kg,需要硝酸钾的质量是( )
A.7kg B.14kg C.70kg D.140kg
【答案】B
【解析】
配制硝酸钾的质量分数为7%的营养液200kg,需要硝酸钾的质量=200kg×7%=14kg。
故选B。
7.20°?C?吋,在三个各盛有100g水的容器中分别加入甲、乙、丙三种纯净物(不含结晶水,不与水反应)各10g,充分溶解后,情况如下表所示,下列说法正确的是( )
物质
甲
乙
丙
未溶解固体的质量/g
5
2
0
A.所得溶液一定都是饱和溶液 B.丙溶液一定是不饱和溶液
C.丙溶液的溶质质量分数最大 D.20°?C?时,甲的溶解度最大
【答案】C
【解析】
A、丙物质未溶解固体的质量为0,则丙溶液可能恰好为饱和溶液,也可能为不饱和溶液,故A错误;
B、丙物质未溶解固体的质量为0,则丙溶液可能恰好为饱和溶液,也可能为不饱和溶液,故B错误;
C、溶剂质量相同(100g),而甲、乙、丙三种溶液中溶质质量的大小关系为丙>乙>甲,则丙溶液的溶质质量分数最大,故C正确;
D、溶剂质量相同(100g),而甲、乙、丙三种溶液中溶质质量的大小关系为丙>乙>甲,则20℃时,丙的溶解度最大,故D错误。故选C。
8.下列关于溶液的叙述中,错误的是( )
A.饱和溶液不一定是浓溶液
B.氢氧化钠固体溶于水时,液体温度升高
C.20%的氯化钠溶液中溶质与溶剂的质量比为1:5
D.从100g质量分数 20%的食盐水中倒出10g,剩余溶液的溶质质量分数仍为20%
【答案】C
【解析】
A、饱和溶液不一定是浓溶液,如氢氧化钙的饱和溶液是稀溶液,故选项说法正确;
B、氢氧化钠溶于水放热,溶液温度升高,故选项说法正确;
C、假设取100g20%的该溶液,溶质的质量=100×20%=20g,溶剂的质量=100-20=80g,所以该溶液中溶质与溶剂质量比=20:80=1:4,故选项说法错误;
D、溶液具有均一性,从100g质量分数20%的食盐水中倒出10g,剩余溶液的溶质质量分数仍为20%,故选项说法正确。
故选C。
9.关于100g5%的氯化钠溶液,下列叙述正确的是( )
A.100g水中溶有5g氯化钠 B.将5g氯化钠溶于95g水中,可制得该溶液
C.溶液中氯化钠与水的质量比为1:20 D.溶液中氯化钠与水的质量比为19:1
【答案】B
【解析】
A、100g5%的氯化钠溶液是指100g溶液中溶有5g氯化钠,故不符合题意;
B、将5g氯化钠溶于95g水中,可制得该溶液,故符合题意;
C、溶液中氯化钠与水的质量比为:5g:(100g-5g)=1:19,故不符合题意;
D、溶液中氯化钠与水的质量比为1:19,故不符合题意。
10.向①、②、③三个盛有等量水的烧杯中分别加入10g、25g、25gKNO3固体,如图I为充分溶解后三个烧杯中的现象,图Ⅱ为甲、乙两物质的溶解度曲线。下列说法不正确的是( )
A.由图I可知,烧杯②中的溶液一定是KNO3的饱和溶液
B.由图I烧杯②③中的现象可知,图Ⅱ中甲可以表示KNO3的溶解度曲线
C.t2℃甲、乙溶液中溶质的质量分数甲>乙
D.由图Ⅱ可知,t1℃甲、乙饱和溶液的溶质质量分数相等
【答案】C
【解析】
A、由于在三个烧杯中只有②有未溶解的固体存在,所以②中的溶液一定是饱和溶液,故A正确;
B、根据烧杯②③中的现象可知,等量的30℃的水中全部溶解了25g硝酸钾,而20℃的水没有全部溶解25g硝酸钾,说明硝酸钾的溶解度随温度的升高而增大,所以图Ⅱ中甲代表硝酸钾的溶解度曲线,故B正确;
C、t2℃甲、乙溶液的状态不能确定,所以溶液中溶质的质量分数不能确定,故C错误;
D、由图Ⅱ可知,t1℃甲、乙物质的溶解度相等,所以饱和溶液的溶质质量分数相等,故D正确。
故选C。
二、填空题
11.如图是某输液瓶标签上的部分内容.葡萄糖由 种元素组成,其中碳元素的质量分数为 ,要把10g这种葡萄糖溶液稀释为2%的溶液,需要水的质量为 .
【答案】三;40%;15g
【解析】试题分析:有葡萄糖的化学式可知,它是由碳、氢、氧三种元素组成的,相对分子质量=12×6+12+16×6=180,其中碳元素的质量分数=72/180 ×100%=40%;溶液在稀释前后溶质的质量不变,设稀释后溶液的质量为x,那么10g×5%=2%x,x=25g,加入水的质量="25g-10g=15g" 。
12.欲将80 g质量分数为20%的NaOH溶液稀释到质量分数为10%,需加水__________g
【答案】80g
【解析】考点定位分析:本题的考点是用水稀释改变浓度的方法。用水稀释改变浓度的方法就是指为了某种需要,向浓溶液中加入适量的水,将其稀释的所要求的浓度的方法,溶液稀释前后,溶质的质量是不变的。
解答过程分析:由于溶液稀释前后,溶质的质量是不变的,故可根据溶质的质量不变进行分析:若设浓溶液质量为mg,溶质的质量分数为a%,加水稀释成溶质的质量分数为b%的稀溶液ng,则等式mg×a%=ng×b%成立,加入水的质量为ng-mg。
解:设需要加水的质量为x,则有80g×20%=(80g+x)×10%,解得x=80g。
13.如图为A、B、C三种固体物质的溶解度曲线,根据图示完成下列问题:
(1)t2℃时,向70gA物质中加入100g水,充分溶解后,该溶液的溶质质量分数是_____;
(2)用一定的方法,将某温度下C的不饱和溶液变为饱和溶液,下列说法正确的是_____。
a 溶剂的质量可能不变 b 溶质质量分数一定变大
c 溶液的质量可能不变 d 溶质的质量一定变大
【答案】37.5% ac
【解析】
(1)t2℃时,A物质的溶解度是60g,所以向70gA物质中加入100g水,充分溶解后,所得溶液是饱和溶液,该溶液的溶质质量分数= ;
(2)a 升高温度时,可将某温度下C的不饱和溶液变为饱和溶液,溶剂的质量不变,故a正确;
b 升高温度时,可将某温度下C的不饱和溶液恰好变为饱和溶液,溶质质量分数不变,故b错误;
c 升高温度时,将某温度下C的不饱和溶液恰好变为饱和溶液,溶液的质量不变,故c正确;
d升高温度时,将某温度下C的不饱和溶液恰好变为饱和溶液,溶质的质量不变,故d错误。故选ac。
四、计算题
14.某学校的学习小组对当地的石灰石矿区进行调查,测定石灰石中碳酸钙的质量分数,取12克样品与100克某浓度的稀盐酸恰好完全反应,完全反应后测得烧杯内剩余物质总质量为107.6克,(已知石灰石样品中含有的二氧化硅等杂质不溶于水,不与稀盐酸反应)。请计算:
①共产生二氧化碳_________克?
②反应后所得溶液的溶质质量分数______?
【答案】4.4 10.5%
【解析】
①根据质量守恒定律,反应物的总质量等于生成物的总质量,减少的为二氧化碳的质量,故共产生二氧化碳的质量为
②设参加反应的碳酸钙的质量为y,反应后所得溶液的溶质质量为x
反应后所得溶液的溶质质量分数为
答:共产生二氧化碳4.4g,反应后所得溶液的溶质质量分数为10.5%。
一、单选题
1.关于100g 5%的NaCl溶液,下列叙述正确的是( )
A.100g水溶解了5g NaCl
B.5g NaCl溶于95g水中
C.溶液中NaCl与水的质量比为1︰20
D.溶液中NaCl与水的质量比为19︰1
2.对于“26%的食盐溶液”的含义解释正确的是( )
A.100g食盐溶液中溶解了26g食盐
B.100g水中溶解了26g食盐
C.将26g食盐溶解在100g水中所得的溶液
D.将食盐与水按13︰50的质量比配成的溶液
3.用、乙两种固体的溶解度曲线如图所示,下列说法正确的是( )。
A.甲的溶解度大于乙的溶解度
B.℃时,甲、乙饱和溶液中溶质的质量分数均为15%
C.℃时,将甲、乙的饱和溶液降温至℃,甲析出的固体一定大于乙
D.℃时,向30g甲、乙中分别加入100g水,所得溶液中溶质的质量分数甲一定大于乙
4.有关溶液(溶质为固体)的说法中,正确的是( )
A.在一定温度下,对于同一溶质的溶液而言,饱和溶液一定比不饱和溶液浓
B.只要温度不变,某物质饱和溶液中溶质的质量分数也不变
C.饱和溶液中析出晶体后,溶质的质量分数一定减小
D.不饱和溶液转化为饱和溶液,其溶质的质量分数一定增大
5.100g 25% NaCl溶液如图处理后,所得溶液质量分数 的值是( )
A.6.25% B.25% C.12.5% D.15%
6.无土栽培所用的某种营养液中,含硝酸钾的质量分数为7%,某蔬菜生产基地欲配制该营养液200kg,需要硝酸钾的质量是( )
A.7kg B.14kg C.70kg D.140kg
7.20°?C?吋,在三个各盛有100g水的容器中分别加入甲、乙、丙三种纯净物(不含结晶水,不与水反应)各10g,充分溶解后,情况如下表所示,下列说法正确的是( )
物质
甲
乙
丙
未溶解固体的质量/g
5
2
0
A.所得溶液一定都是饱和溶液 B.丙溶液一定是不饱和溶液
C.丙溶液的溶质质量分数最大 D.20°?C?时,甲的溶解度最大
8.下列关于溶液的叙述中,错误的是( )
A.饱和溶液不一定是浓溶液
B.氢氧化钠固体溶于水时,液体温度升高
C.20%的氯化钠溶液中溶质与溶剂的质量比为1:5
D.从100g质量分数 20%的食盐水中倒出10g,剩余溶液的溶质质量分数仍为20%
9.关于100g5%的氯化钠溶液,下列叙述正确的是( )
A.100g水中溶有5g氯化钠 B.将5g氯化钠溶于95g水中,可制得该溶液
C.溶液中氯化钠与水的质量比为1:20 D.溶液中氯化钠与水的质量比为19:1
10.向①、②、③三个盛有等量水的烧杯中分别加入10g、25g、25gKNO3固体,如图I为充分溶解后三个烧杯中的现象,图Ⅱ为甲、乙两物质的溶解度曲线。下列说法不正确的是( )
A.由图I可知,烧杯②中的溶液一定是KNO3的饱和溶液
B.由图I烧杯②③中的现象可知,图Ⅱ中甲可以表示KNO3的溶解度曲线
C.t2℃甲、乙溶液中溶质的质量分数甲>乙
D.由图Ⅱ可知,t1℃甲、乙饱和溶液的溶质质量分数相等
二、填空题
11.如图是某输液瓶标签上的部分内容.葡萄糖由 种元素组成,其中碳元素的质量分数为 ,要把10g这种葡萄糖溶液稀释为2%的溶液,需要水的质量为 .
12.欲将80 g质量分数为20%的NaOH溶液稀释到质量分数为10%,需加水__________g
13.如图为A、B、C三种固体物质的溶解度曲线,根据图示完成下列问题:
(1)t2℃时,向70gA物质中加入100g水,充分溶解后,该溶液的溶质质量分数是_____;
(2)用一定的方法,将某温度下C的不饱和溶液变为饱和溶液,下列说法正确的是_____。
a 溶剂的质量可能不变 b 溶质质量分数一定变大
c 溶液的质量可能不变 d 溶质的质量一定变大
四、计算题
14.某学校的学习小组对当地的石灰石矿区进行调查,测定石灰石中碳酸钙的质量分数,取12克样品与100克某浓度的稀盐酸恰好完全反应,完全反应后测得烧杯内剩余物质总质量为107.6克,(已知石灰石样品中含有的二氧化硅等杂质不溶于水,不与稀盐酸反应)。请计算:
①共产生二氧化碳_________克?
②反应后所得溶液的溶质质量分数______?
课题9.3 溶液的浓度
一、单选题
1.关于100g 5%的NaCl溶液,下列叙述正确的是( )
A.100g水溶解了5g NaCl
B.5g NaCl溶于95g水中
C.溶液中NaCl与水的质量比为1︰20
D.溶液中NaCl与水的质量比为19︰1
【答案】B
【解析】100g 5%的NaCl溶液含有NaCl的质量为100g×5%=5g,水的质量为100g-5g=95g.溶液中NaCl与水的质量比为5︰95=1︰19.
2.对于“26%的食盐溶液”的含义解释正确的是( )
A.100g食盐溶液中溶解了26g食盐
B.100g水中溶解了26g食盐
C.将26g食盐溶解在100g水中所得的溶液
D.将食盐与水按13︰50的质量比配成的溶液
【答案】A
【解析】正确理解“26%”的含义,“100”是指溶液的质量为100份,“26”是指食盐的质量为26份,很显然,水的质量为74份.
3.用、乙两种固体的溶解度曲线如图所示,下列说法正确的是( )。
A.甲的溶解度大于乙的溶解度
B.℃时,甲、乙饱和溶液中溶质的质量分数均为15%
C.℃时,将甲、乙的饱和溶液降温至℃,甲析出的固体一定大于乙
D.℃时,向30g甲、乙中分别加入100g水,所得溶液中溶质的质量分数甲一定大于乙
【答案】D
【解析】
A、比较溶解度大小须确定温度,不知温度,无法比较,说法错误;
B、饱和溶液中,℃时,甲、乙溶解度均为15g,则溶质的质量分数为:,说法错误;
C、不知饱和溶液的质量多少,无法判断析出固体质量多少,说法错误;
D、℃时甲的溶解度是30g,乙的溶解度<30g,故向30g甲,乙中分别加入100g水,甲恰好完全溶解,乙溶解的质量小于30g,所以所得溶液中溶质的质量分数甲一定大于乙,说法正确。
故选D。
4.有关溶液(溶质为固体)的说法中,正确的是( )
A.在一定温度下,对于同一溶质的溶液而言,饱和溶液一定比不饱和溶液浓
B.只要温度不变,某物质饱和溶液中溶质的质量分数也不变
C.饱和溶液中析出晶体后,溶质的质量分数一定减小
D.不饱和溶液转化为饱和溶液,其溶质的质量分数一定增大
【答案】A
【解析】
A、在一定温度下,对于同一溶质的溶液而言,饱和溶液一定比不饱和溶液的质量分数大,即饱和溶液一定比不饱和溶液浓,故A正确;
B、一定温度下饱和溶液的溶质质量分数=,温度不变,该物质的溶解度不变,但还能溶解其它溶质,若溶解了其它溶质,其饱和溶液中溶质的质量分数会减小,故B错误;
C、饱和溶液析出晶体后溶质的质量分数是否发生改变,主要是取决于析出晶体的措施;当某物质一定温度下的饱和溶液在温度不变的条件下蒸发溶剂后,有晶体析出,因为温度不变,物质的溶解度不变,溶液中有晶体,剩下的溶液仍为该温度下的饱和溶液,则溶质质量分数不变,故C错误;
D、不饱和溶液转化为饱和溶液,可以采取增加溶质、蒸发溶剂、降低温度等方法,若采用的是降低温度至恰好饱和的方法,由于溶液的组成未发生改变,其溶质的质量分数不变,故D错误。故选A。
5.100g 25% NaCl溶液如图处理后,所得溶液质量分数 的值是( )
A.6.25% B.25% C.12.5% D.15%
【答案】A
【解析】
【详解】
依题意得 25g×25%=100g?x%,解得x%= 6.25%。故选A。
6.无土栽培所用的某种营养液中,含硝酸钾的质量分数为7%,某蔬菜生产基地欲配制该营养液200kg,需要硝酸钾的质量是( )
A.7kg B.14kg C.70kg D.140kg
【答案】B
【解析】
配制硝酸钾的质量分数为7%的营养液200kg,需要硝酸钾的质量=200kg×7%=14kg。
故选B。
7.20°?C?吋,在三个各盛有100g水的容器中分别加入甲、乙、丙三种纯净物(不含结晶水,不与水反应)各10g,充分溶解后,情况如下表所示,下列说法正确的是( )
物质
甲
乙
丙
未溶解固体的质量/g
5
2
0
A.所得溶液一定都是饱和溶液 B.丙溶液一定是不饱和溶液
C.丙溶液的溶质质量分数最大 D.20°?C?时,甲的溶解度最大
【答案】C
【解析】
A、丙物质未溶解固体的质量为0,则丙溶液可能恰好为饱和溶液,也可能为不饱和溶液,故A错误;
B、丙物质未溶解固体的质量为0,则丙溶液可能恰好为饱和溶液,也可能为不饱和溶液,故B错误;
C、溶剂质量相同(100g),而甲、乙、丙三种溶液中溶质质量的大小关系为丙>乙>甲,则丙溶液的溶质质量分数最大,故C正确;
D、溶剂质量相同(100g),而甲、乙、丙三种溶液中溶质质量的大小关系为丙>乙>甲,则20℃时,丙的溶解度最大,故D错误。故选C。
8.下列关于溶液的叙述中,错误的是( )
A.饱和溶液不一定是浓溶液
B.氢氧化钠固体溶于水时,液体温度升高
C.20%的氯化钠溶液中溶质与溶剂的质量比为1:5
D.从100g质量分数 20%的食盐水中倒出10g,剩余溶液的溶质质量分数仍为20%
【答案】C
【解析】
A、饱和溶液不一定是浓溶液,如氢氧化钙的饱和溶液是稀溶液,故选项说法正确;
B、氢氧化钠溶于水放热,溶液温度升高,故选项说法正确;
C、假设取100g20%的该溶液,溶质的质量=100×20%=20g,溶剂的质量=100-20=80g,所以该溶液中溶质与溶剂质量比=20:80=1:4,故选项说法错误;
D、溶液具有均一性,从100g质量分数20%的食盐水中倒出10g,剩余溶液的溶质质量分数仍为20%,故选项说法正确。
故选C。
9.关于100g5%的氯化钠溶液,下列叙述正确的是( )
A.100g水中溶有5g氯化钠 B.将5g氯化钠溶于95g水中,可制得该溶液
C.溶液中氯化钠与水的质量比为1:20 D.溶液中氯化钠与水的质量比为19:1
【答案】B
【解析】
A、100g5%的氯化钠溶液是指100g溶液中溶有5g氯化钠,故不符合题意;
B、将5g氯化钠溶于95g水中,可制得该溶液,故符合题意;
C、溶液中氯化钠与水的质量比为:5g:(100g-5g)=1:19,故不符合题意;
D、溶液中氯化钠与水的质量比为1:19,故不符合题意。
10.向①、②、③三个盛有等量水的烧杯中分别加入10g、25g、25gKNO3固体,如图I为充分溶解后三个烧杯中的现象,图Ⅱ为甲、乙两物质的溶解度曲线。下列说法不正确的是( )
A.由图I可知,烧杯②中的溶液一定是KNO3的饱和溶液
B.由图I烧杯②③中的现象可知,图Ⅱ中甲可以表示KNO3的溶解度曲线
C.t2℃甲、乙溶液中溶质的质量分数甲>乙
D.由图Ⅱ可知,t1℃甲、乙饱和溶液的溶质质量分数相等
【答案】C
【解析】
A、由于在三个烧杯中只有②有未溶解的固体存在,所以②中的溶液一定是饱和溶液,故A正确;
B、根据烧杯②③中的现象可知,等量的30℃的水中全部溶解了25g硝酸钾,而20℃的水没有全部溶解25g硝酸钾,说明硝酸钾的溶解度随温度的升高而增大,所以图Ⅱ中甲代表硝酸钾的溶解度曲线,故B正确;
C、t2℃甲、乙溶液的状态不能确定,所以溶液中溶质的质量分数不能确定,故C错误;
D、由图Ⅱ可知,t1℃甲、乙物质的溶解度相等,所以饱和溶液的溶质质量分数相等,故D正确。
故选C。
二、填空题
11.如图是某输液瓶标签上的部分内容.葡萄糖由 种元素组成,其中碳元素的质量分数为 ,要把10g这种葡萄糖溶液稀释为2%的溶液,需要水的质量为 .
【答案】三;40%;15g
【解析】试题分析:有葡萄糖的化学式可知,它是由碳、氢、氧三种元素组成的,相对分子质量=12×6+12+16×6=180,其中碳元素的质量分数=72/180 ×100%=40%;溶液在稀释前后溶质的质量不变,设稀释后溶液的质量为x,那么10g×5%=2%x,x=25g,加入水的质量="25g-10g=15g" 。
12.欲将80 g质量分数为20%的NaOH溶液稀释到质量分数为10%,需加水__________g
【答案】80g
【解析】考点定位分析:本题的考点是用水稀释改变浓度的方法。用水稀释改变浓度的方法就是指为了某种需要,向浓溶液中加入适量的水,将其稀释的所要求的浓度的方法,溶液稀释前后,溶质的质量是不变的。
解答过程分析:由于溶液稀释前后,溶质的质量是不变的,故可根据溶质的质量不变进行分析:若设浓溶液质量为mg,溶质的质量分数为a%,加水稀释成溶质的质量分数为b%的稀溶液ng,则等式mg×a%=ng×b%成立,加入水的质量为ng-mg。
解:设需要加水的质量为x,则有80g×20%=(80g+x)×10%,解得x=80g。
13.如图为A、B、C三种固体物质的溶解度曲线,根据图示完成下列问题:
(1)t2℃时,向70gA物质中加入100g水,充分溶解后,该溶液的溶质质量分数是_____;
(2)用一定的方法,将某温度下C的不饱和溶液变为饱和溶液,下列说法正确的是_____。
a 溶剂的质量可能不变 b 溶质质量分数一定变大
c 溶液的质量可能不变 d 溶质的质量一定变大
【答案】37.5% ac
【解析】
(1)t2℃时,A物质的溶解度是60g,所以向70gA物质中加入100g水,充分溶解后,所得溶液是饱和溶液,该溶液的溶质质量分数= ;
(2)a 升高温度时,可将某温度下C的不饱和溶液变为饱和溶液,溶剂的质量不变,故a正确;
b 升高温度时,可将某温度下C的不饱和溶液恰好变为饱和溶液,溶质质量分数不变,故b错误;
c 升高温度时,将某温度下C的不饱和溶液恰好变为饱和溶液,溶液的质量不变,故c正确;
d升高温度时,将某温度下C的不饱和溶液恰好变为饱和溶液,溶质的质量不变,故d错误。故选ac。
四、计算题
14.某学校的学习小组对当地的石灰石矿区进行调查,测定石灰石中碳酸钙的质量分数,取12克样品与100克某浓度的稀盐酸恰好完全反应,完全反应后测得烧杯内剩余物质总质量为107.6克,(已知石灰石样品中含有的二氧化硅等杂质不溶于水,不与稀盐酸反应)。请计算:
①共产生二氧化碳_________克?
②反应后所得溶液的溶质质量分数______?
【答案】4.4 10.5%
【解析】
①根据质量守恒定律,反应物的总质量等于生成物的总质量,减少的为二氧化碳的质量,故共产生二氧化碳的质量为
②设参加反应的碳酸钙的质量为y,反应后所得溶液的溶质质量为x
反应后所得溶液的溶质质量分数为
答:共产生二氧化碳4.4g,反应后所得溶液的溶质质量分数为10.5%。
同课章节目录
