2020年必修2人教版 第一章 物质结构元素周期律 (共35张PPT)
文档属性
| 名称 | 2020年必修2人教版 第一章 物质结构元素周期律 (共35张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 1.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-02-15 00:00:00 | ||
图片预览











文档简介
(共35张PPT)
第一章 物质结构元素周期律(复习)
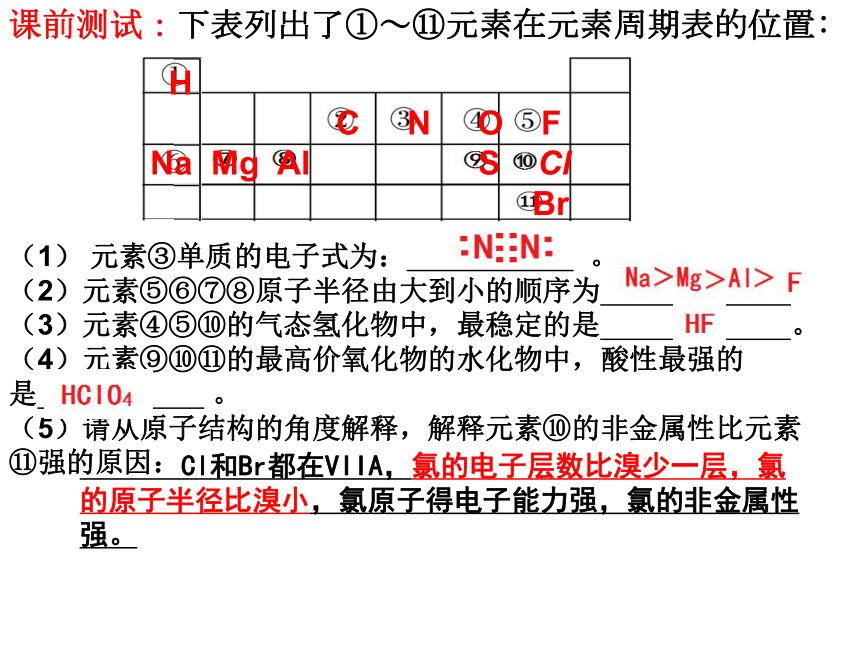
课前测试:下表列出了①~?元素在元素周期表的位置:
(1) 元素③单质的电子式为: 。
(2)元素⑤⑥⑦⑧原子半径由大到小的顺序为 。
(3)元素④⑤⑩的气态氢化物中,最稳定的是 。
(4)元素⑨⑩?的最高价氧化物的水化物中,酸性最强的
是 。
(5)请从原子结构的角度解释,解释元素⑩的非金属性比元素?强的原因:
Cl和Br都在VIIA,氯的电子层数比溴少一层,氯的原子半径比溴小,氯原子得电子能力强,氯的非金属性强。
H
C N O F
Na Mg Al S Cl
Br
一、原子的组成
2、几种微粒的作用
质子数决定元素的种类
质子数和中子数决定原子的种类
核外电子尤其是最外层电子数决定原子的化学性质
3、符号的含义
离子的电荷数
原子个数
质量数
质子数
元素符号
质量数(A)=(质子)Z+(中子)N
4、微粒电子数的计算
中性微粒:
核外电子数=质子数
阳离子:
核外电子数=质子数—离子所带电荷
阴离子:
核外电子数=质子数+离子所带电荷
例1:现有xMm- 和yNn+ 两种简单离子,它们的电子层结构相同。则下列正确表达式是( )
A.x-m=y+n B.x+m=y-n
C.x+m=y+n D.x-m=y-n
B
具有一定数目 质子 和一定数目 中子的
一种原子
二、元素、核素、同位素、同素异形体
2、核素:
3:同位素:
质子数相同,中子数不同的同种元素的不同原子
1、元素:
具有相同核电荷数(相同质子数)同一类原子的统称。
4、同素异形体
同种元素形成的不同种单质
思考:元素、核素、同位素、同素异形体之间的关系如何?
B
三:元素周期表和元素周期律
元
素
周
期
表
7个周期
短周期:一、二、三周期
长周期:四、五、六、七周期
16个族
主族元素特点:
族序数 = 最外层电子数=价电子数=最高化合价(除F和O外)
1:元素周期表的结构
0
1
B
Al
Si
Ge
As
Sb
Te
2
3
4
5
6
7
ⅠA
ⅡA
ⅢA
ⅣA
ⅤA
ⅥA
ⅦA
Po
At
非金属性逐渐增强
金属性逐渐增强
金属性逐渐增强
非金属性逐渐增强
金属性最强
非金属性最强
零
族
元
素
2、元素周期表中元素性质递变规律
大→小
小→大
电子层数相同、最外层电子增多
逐渐减弱
逐渐增强
金属性减、非金属性增
金属性增、非金属性减
最高正价+1→+7(一般)
最高正价=主族序数(一般)
碱性逐渐减弱
酸性逐渐增强
碱性逐渐增强
酸性逐渐减弱
形成:难→易
稳定性:弱→强
形成:易→难
稳定性:强→弱
电子层增多、最外层电子数相同
逐渐增强
逐渐减弱
内 容 同周期(从左到右) 同主族(从上到下)
原子半径
电子层结构
失电子能力
得电子能力
金属性非金属性
主要化合价
最高价氧化物对应的水化物酸碱性
非金属元素气态氢
化物的形成与稳定性
3、怎样判断元素的金属性、非金属性的强弱呢?
金属性:从化学性质上讲,就是金属原子失电子的能力?
最高价氧化物水化物碱性强
金属活动顺序表越靠前:K 、Ca、Na、Mg、Al
周期表越靠近左下角的位置
例3:设计实验证明金属性:Na > Mg > Al
答案:
(1)将钠和镁分别投入到盛有相同体积水的烧杯中,钠剧烈反应,镁表面有气泡反应很慢,证明钠的金属性比镁强。
(2)取两支试管,取等体积等浓度的盐酸,分别加入表面积相同的Mg和Al(除去氧化膜),镁条反应更加剧烈。
非金
属
性
强
非金属性:
单质氧化性强
气体氢化物越稳定(HF最稳定)
最高价氧化物水化物酸性强(HClO4最强酸)
从化学性质的角度,非金属原子得电子的能力
根据周期表除惰性气体外越靠近右上角(F)
例4:如何设计实验证明非金属性:氯的非金属性比碘强?
在一支试管中加入2~3mLKI溶液,滴加几滴淀粉溶液,再加少量新制氯水,振荡
现象:溶液变蓝
原理:Cl2+2KI=I2+2KCl
4、微粒半径的比较
(1)微粒半径的比较,主要是比较电子所占据的空间
(2)原子核带有正电,核外电子电子带负电,微粒半径主要取决与电子层数、原子核对电子引力的大小。
(3)微粒半径比较主要看
电子层数越多,一般微粒半径越大
电子层数相同,核电荷数越多,原子半径小
同种元素的不同微粒,电子数多,微粒半径越大
“四同法”比较微粒半径的大小
(4)特殊情况:具有相同电子层结构的微粒
阴前阳下,序小径大
氖型
氩型
氦型
H—
例5:a元素的阴离子;b元素的阴离子和c元素的阳离子具有相同的电子层结构。已知a的原子序数大于b的原子序数。则a、b、c三种离子半径大小的顺序是 ( )
A? a>b>c B? b>a>c
C? c>a>b D? c>b>a
B
例6:已知短周期元素的离子。aA2+、bB+、cC3-、dD-都具有相同的电子层结构,则下列叙述正确的 ( )
A.原子半径A>B>D>C
B.原子序数d>c>b>a
C.离子半径C>D>B>A
D.单质的还原性 A>B>D>C
C
5:“构,位,性”三者之间的关系
例7:如图所示是元素周期表的一部分,下列说法中不正确的是( )
A.原子半径:④>②>③
B.气态氢化物的稳定性:⑤>②
C.最高价氧化物对应水化物的酸性:⑥>⑤
D.非金属性:③>②>⑤
B
例8、下列排列顺序中,错误的( ) A、稳定性: NH3 > H2S> PH3 B、水溶液的酸性:H3PO4 > H2SO4 >HClO4 C、原子半径:O<S < Na D、水溶液的碱性:Al(OH)3 < Mg(OH)2 < NaOH
B
例9、电子层数相同的三种元素X Y Z,已知其最高价含氧酸的酸性强弱为HXO4>H2YO4>H3ZO4
则不正确的是 ( )
A.原子半径X>Y>Z
B.气态氢化物稳定性HX>H2Y>ZH3
C.非金属性X>Y>Z
D.气态氢化物的还原性HXA
三:化学键
1、概念:
2、分类
键:就是“相互作用”。
使离子或原子相结合的作用力
3、离子键
(1).定义:
使阴阳离子结合成化合物的静电作用
(2)成键粒子:
阴、阳离子
(3)相互作用:
静电作用
(4)成键元素:
活泼的金属元素(IA,IIA)和活泼的非金属元素(VIA,VIIA)
(5)离子化合物:
含有离子键的化合物就叫做离子化合物
4、共价键
(1)定义:
原子之间通过共用电子对所形成的相互作用
(2)作用力:
静电作用力
(3)成键粒子:
原子
(4)成键元素:
同种或不同种非金属元素之间
如:H2 N2 HCl H2O HF 等均以共价键形成分子
①非极性共价键(非极性键)
同种非金属原子间形成的共价键(H2、N2、Cl2等
共用电子对不发生偏移
②极性共价键(极性键)
由不同种非金属元素原子形成共价键
如:HCl、NH3、H2O等
共用电子对发生偏移
(5)共价键的分类
①:共价化合物如:HCl,CH4,CO2
②:非金属单质如:Cl2,O2
③:含原子团的离子化合物如:NaOH,Na2O2,NaNO3
(含有共价键的化合物不一定是共价化合物)
(6). 存在共价键的物质:
5、从化学键的角度认识化学反应
例1:化学反应的过程:H2 + Cl2 = 2HCl
旧键的断裂:
H—H → 2H
Cl—Cl→ 2Cl
新键的形成
从化学化学键的角度,化学反应分成两个过程,旧键的断裂和新建的形成。
例10、下列说法中不正确的是( )
A.在共价化合物中不可能含有离子键
B.非金属之间形成的化学键一定是共价键
C.含有共价键的化合物不一定是共价化合物
D.含有离子键的化合物一定是离子化合物
B
例11:下列关于化学键的说法中,不正确的是( )
A.化学键是一种力
B.任何物质都含有化学键
C.离子化合物一定含有离子键,可能还有共价键
D.化学反应的过程,从本质上就是旧化学键断裂和新化学键的形成的过程
B
第一章 物质结构元素周期律(复习)
课前测试:下表列出了①~?元素在元素周期表的位置:
(1) 元素③单质的电子式为: 。
(2)元素⑤⑥⑦⑧原子半径由大到小的顺序为 。
(3)元素④⑤⑩的气态氢化物中,最稳定的是 。
(4)元素⑨⑩?的最高价氧化物的水化物中,酸性最强的
是 。
(5)请从原子结构的角度解释,解释元素⑩的非金属性比元素?强的原因:
Cl和Br都在VIIA,氯的电子层数比溴少一层,氯的原子半径比溴小,氯原子得电子能力强,氯的非金属性强。
H
C N O F
Na Mg Al S Cl
Br
一、原子的组成
2、几种微粒的作用
质子数决定元素的种类
质子数和中子数决定原子的种类
核外电子尤其是最外层电子数决定原子的化学性质
3、符号的含义
离子的电荷数
原子个数
质量数
质子数
元素符号
质量数(A)=(质子)Z+(中子)N
4、微粒电子数的计算
中性微粒:
核外电子数=质子数
阳离子:
核外电子数=质子数—离子所带电荷
阴离子:
核外电子数=质子数+离子所带电荷
例1:现有xMm- 和yNn+ 两种简单离子,它们的电子层结构相同。则下列正确表达式是( )
A.x-m=y+n B.x+m=y-n
C.x+m=y+n D.x-m=y-n
B
具有一定数目 质子 和一定数目 中子的
一种原子
二、元素、核素、同位素、同素异形体
2、核素:
3:同位素:
质子数相同,中子数不同的同种元素的不同原子
1、元素:
具有相同核电荷数(相同质子数)同一类原子的统称。
4、同素异形体
同种元素形成的不同种单质
思考:元素、核素、同位素、同素异形体之间的关系如何?
B
三:元素周期表和元素周期律
元
素
周
期
表
7个周期
短周期:一、二、三周期
长周期:四、五、六、七周期
16个族
主族元素特点:
族序数 = 最外层电子数=价电子数=最高化合价(除F和O外)
1:元素周期表的结构
0
1
B
Al
Si
Ge
As
Sb
Te
2
3
4
5
6
7
ⅠA
ⅡA
ⅢA
ⅣA
ⅤA
ⅥA
ⅦA
Po
At
非金属性逐渐增强
金属性逐渐增强
金属性逐渐增强
非金属性逐渐增强
金属性最强
非金属性最强
零
族
元
素
2、元素周期表中元素性质递变规律
大→小
小→大
电子层数相同、最外层电子增多
逐渐减弱
逐渐增强
金属性减、非金属性增
金属性增、非金属性减
最高正价+1→+7(一般)
最高正价=主族序数(一般)
碱性逐渐减弱
酸性逐渐增强
碱性逐渐增强
酸性逐渐减弱
形成:难→易
稳定性:弱→强
形成:易→难
稳定性:强→弱
电子层增多、最外层电子数相同
逐渐增强
逐渐减弱
内 容 同周期(从左到右) 同主族(从上到下)
原子半径
电子层结构
失电子能力
得电子能力
金属性非金属性
主要化合价
最高价氧化物对应的水化物酸碱性
非金属元素气态氢
化物的形成与稳定性
3、怎样判断元素的金属性、非金属性的强弱呢?
金属性:从化学性质上讲,就是金属原子失电子的能力?
最高价氧化物水化物碱性强
金属活动顺序表越靠前:K 、Ca、Na、Mg、Al
周期表越靠近左下角的位置
例3:设计实验证明金属性:Na > Mg > Al
答案:
(1)将钠和镁分别投入到盛有相同体积水的烧杯中,钠剧烈反应,镁表面有气泡反应很慢,证明钠的金属性比镁强。
(2)取两支试管,取等体积等浓度的盐酸,分别加入表面积相同的Mg和Al(除去氧化膜),镁条反应更加剧烈。
非金
属
性
强
非金属性:
单质氧化性强
气体氢化物越稳定(HF最稳定)
最高价氧化物水化物酸性强(HClO4最强酸)
从化学性质的角度,非金属原子得电子的能力
根据周期表除惰性气体外越靠近右上角(F)
例4:如何设计实验证明非金属性:氯的非金属性比碘强?
在一支试管中加入2~3mLKI溶液,滴加几滴淀粉溶液,再加少量新制氯水,振荡
现象:溶液变蓝
原理:Cl2+2KI=I2+2KCl
4、微粒半径的比较
(1)微粒半径的比较,主要是比较电子所占据的空间
(2)原子核带有正电,核外电子电子带负电,微粒半径主要取决与电子层数、原子核对电子引力的大小。
(3)微粒半径比较主要看
电子层数越多,一般微粒半径越大
电子层数相同,核电荷数越多,原子半径小
同种元素的不同微粒,电子数多,微粒半径越大
“四同法”比较微粒半径的大小
(4)特殊情况:具有相同电子层结构的微粒
阴前阳下,序小径大
氖型
氩型
氦型
H—
例5:a元素的阴离子;b元素的阴离子和c元素的阳离子具有相同的电子层结构。已知a的原子序数大于b的原子序数。则a、b、c三种离子半径大小的顺序是 ( )
A? a>b>c B? b>a>c
C? c>a>b D? c>b>a
B
例6:已知短周期元素的离子。aA2+、bB+、cC3-、dD-都具有相同的电子层结构,则下列叙述正确的 ( )
A.原子半径A>B>D>C
B.原子序数d>c>b>a
C.离子半径C>D>B>A
D.单质的还原性 A>B>D>C
C
5:“构,位,性”三者之间的关系
例7:如图所示是元素周期表的一部分,下列说法中不正确的是( )
A.原子半径:④>②>③
B.气态氢化物的稳定性:⑤>②
C.最高价氧化物对应水化物的酸性:⑥>⑤
D.非金属性:③>②>⑤
B
例8、下列排列顺序中,错误的( ) A、稳定性: NH3 > H2S> PH3 B、水溶液的酸性:H3PO4 > H2SO4 >HClO4 C、原子半径:O<S < Na D、水溶液的碱性:Al(OH)3 < Mg(OH)2 < NaOH
B
例9、电子层数相同的三种元素X Y Z,已知其最高价含氧酸的酸性强弱为HXO4>H2YO4>H3ZO4
则不正确的是 ( )
A.原子半径X>Y>Z
B.气态氢化物稳定性HX>H2Y>ZH3
C.非金属性X>Y>Z
D.气态氢化物的还原性HX
三:化学键
1、概念:
2、分类
键:就是“相互作用”。
使离子或原子相结合的作用力
3、离子键
(1).定义:
使阴阳离子结合成化合物的静电作用
(2)成键粒子:
阴、阳离子
(3)相互作用:
静电作用
(4)成键元素:
活泼的金属元素(IA,IIA)和活泼的非金属元素(VIA,VIIA)
(5)离子化合物:
含有离子键的化合物就叫做离子化合物
4、共价键
(1)定义:
原子之间通过共用电子对所形成的相互作用
(2)作用力:
静电作用力
(3)成键粒子:
原子
(4)成键元素:
同种或不同种非金属元素之间
如:H2 N2 HCl H2O HF 等均以共价键形成分子
①非极性共价键(非极性键)
同种非金属原子间形成的共价键(H2、N2、Cl2等
共用电子对不发生偏移
②极性共价键(极性键)
由不同种非金属元素原子形成共价键
如:HCl、NH3、H2O等
共用电子对发生偏移
(5)共价键的分类
①:共价化合物如:HCl,CH4,CO2
②:非金属单质如:Cl2,O2
③:含原子团的离子化合物如:NaOH,Na2O2,NaNO3
(含有共价键的化合物不一定是共价化合物)
(6). 存在共价键的物质:
5、从化学键的角度认识化学反应
例1:化学反应的过程:H2 + Cl2 = 2HCl
旧键的断裂:
H—H → 2H
Cl—Cl→ 2Cl
新键的形成
从化学化学键的角度,化学反应分成两个过程,旧键的断裂和新建的形成。
例10、下列说法中不正确的是( )
A.在共价化合物中不可能含有离子键
B.非金属之间形成的化学键一定是共价键
C.含有共价键的化合物不一定是共价化合物
D.含有离子键的化合物一定是离子化合物
B
例11:下列关于化学键的说法中,不正确的是( )
A.化学键是一种力
B.任何物质都含有化学键
C.离子化合物一定含有离子键,可能还有共价键
D.化学反应的过程,从本质上就是旧化学键断裂和新化学键的形成的过程
B
