鲁教版第四节酸碱中和反应(共18张PPT)
文档属性
| 名称 | 鲁教版第四节酸碱中和反应(共18张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 2.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-02-22 00:00:00 | ||
图片预览


文档简介
(共18张PPT)
第四节 酸碱中和反应
第七单元 常见的酸和碱
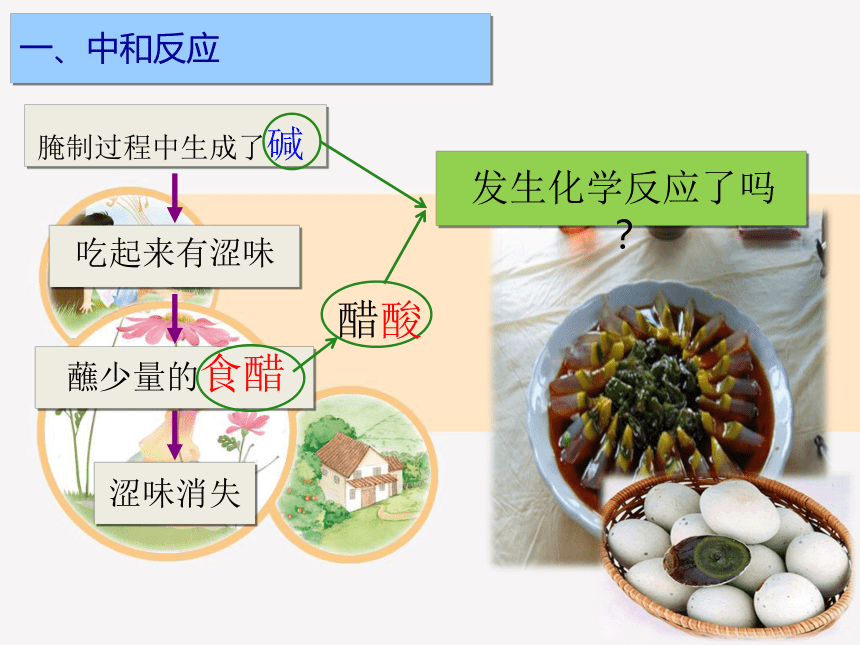
腌制过程中生成了碱
吃起来有涩味
蘸少量的食醋
涩味消失
醋酸
发生化学反应了吗?
一、中和反应
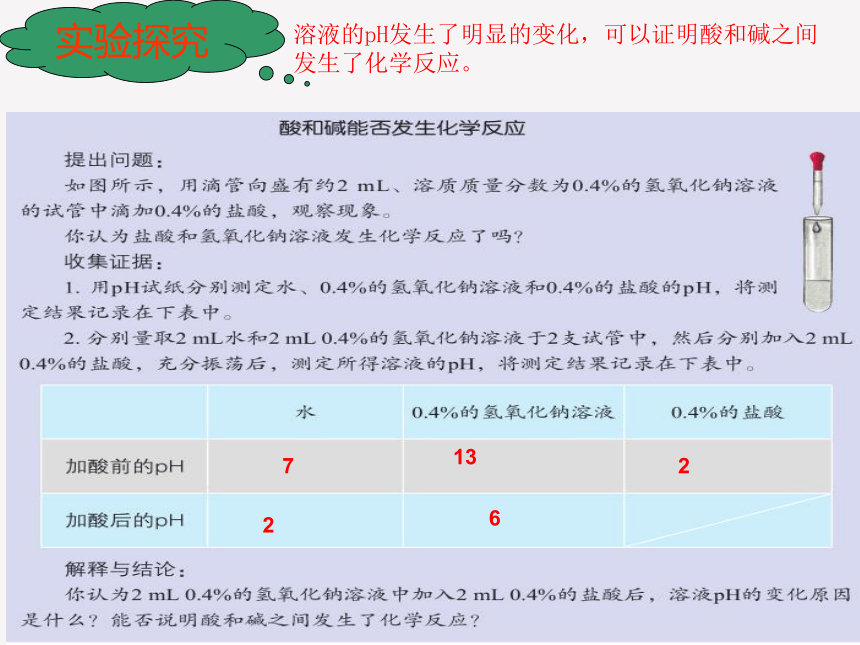
实验探究
7
13
2
2
6
溶液的pH发生了明显的变化,可以证明酸和碱之间发生了化学反应。
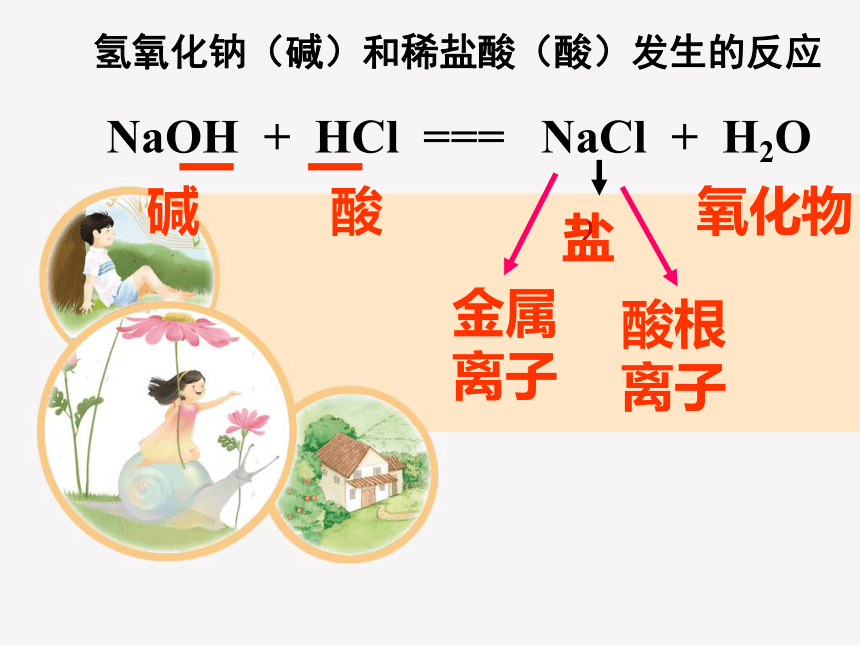
氢氧化钠(碱)和稀盐酸(酸)发生的反应
NaOH + HCl === NaCl + H2O
碱
酸
氧化物
?
盐
金属离子
酸根离子
活动天地
KOH + HCl = KCl + H2O Ba(OH)2 + 2HCl = BaCl2 + 2H2O 2NaOH + H2SO4 = Na2SO4 + 2H2O Ba(OH)2 + H2SO4 =BaSO4 ↓+ 2H2O
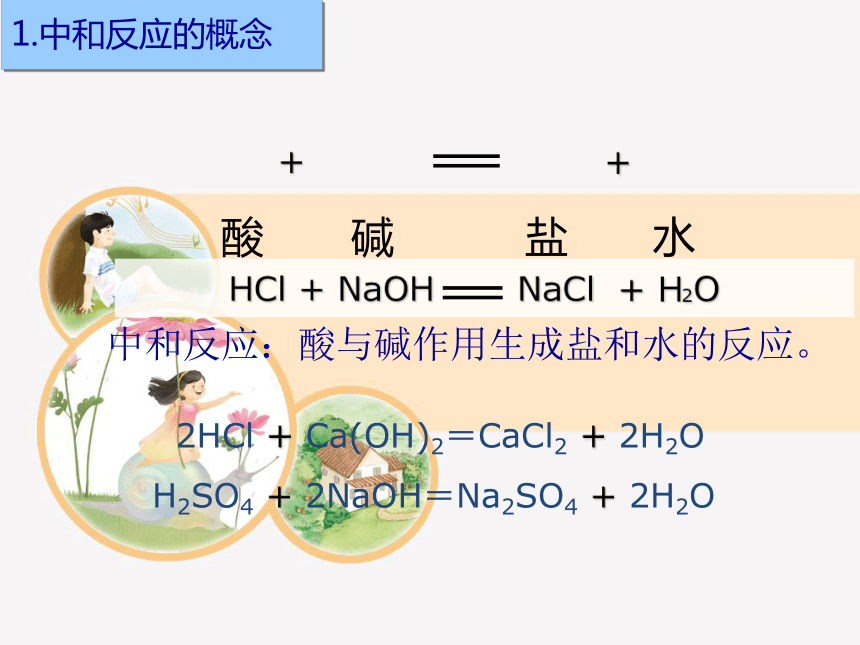
HCl + NaOH NaCl + H2O
碱
酸
盐
水
+
+
2HCl + Ca(OH)2=CaCl2 + 2H2O
H2SO4 + 2NaOH=Na2SO4 + 2H2O
中和反应:酸与碱作用生成盐和水的反应。
1.中和反应的概念
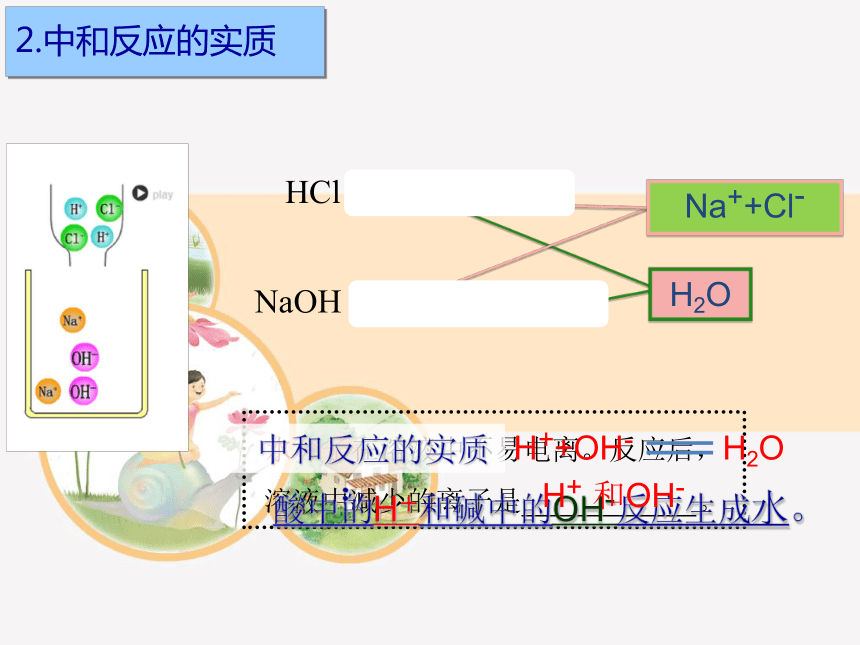
水分子在溶液中不易电离。反应后,
溶液中减少的离子是 。
酸中的H+和碱中的OH-反应生成水。
HCl H+ + Cl-
NaOH Na+ + OH-
H++OH- H2O
H2O
Na++Cl-
H+ 和OH-
中和反应的实质:
2.中和反应的实质
想一想
判断一个反应是不是中和反应的关键是什么?
反应物必须是酸与碱
生成物必须是盐和水
在线测试
Ca(OH)2+2HCl= CaCl2+2H2O 2KOH + H2SO4 =K2SO4+ 2H2O
活动天地
二、中和反应的应用
当滴入盐酸量较少时,溶液中氢氧化钠有剩余,溶液呈碱性,pH > 7; 当滴入盐酸恰好与溶液中氢氧化钠完全反应时,溶液呈中性,pH = 7; 当滴入盐酸过量时,溶液中盐酸有剩余,溶液呈酸性,pH < 7。 (18,7)表示当滴入盐酸的体积为18时,pH = 7。
1.应用于医疗卫生
2.改变土壤的酸碱性
3.处理工业废水
4.调节溶液的酸碱性
胃酸(HCl)过多,口服碱性药物[例:Mg(OH)2]
向酸性土壤(H2SO4)中撒熟石灰[Ca(OH)2]
向酸性废水(HCl)中加熟石灰[Ca(OH)2]
实际应用:做完化学实验后剩余的酸性废液或碱性废液能否直接倒入下水道?应如何处理?
课堂小结
一、 中和反应
1.定义:
酸和碱作用生成盐和水的反应
2.实质:
H+ 和OH- 结合生成水
H+ + OH- = H2O
二、中和反应的应用
1.应用于医药卫生
2.改变土壤的酸碱性
3.处理工业废水
4.调节溶液的酸碱性
酸 + 碱 = 盐+ H2O
挑战自我
1.在滴有石蕊的稀盐酸中,加入足量NaOH溶液,加酸前后溶液颜色依次为 ( )
A.红色、紫色、蓝色 B.紫色、红色、蓝色
C.红色、蓝色、紫色 D.蓝色、紫色、红色
挑战自我
2. 酸与碱作用生成盐和水的反应,叫作中和反应,它在工 农业生产和日常生活中有广泛的用途,下列应用一定与中和反应原理无关的是( )
A.服用含Al(OH)3的药物治疗胃酸过量
B.使用熟石灰改良酸性土壤
C.用熟石灰和硫酸铜配制波尔多液
D.用NaOH溶液洗涤石油产品中的残余硫酸
3.以下的反应均生成盐和水,是不是中和反应呢?
CO2+2NaOH=Na2CO3+H2O
不是中和反应。
Fe2O3+6HCl=2FeCl3+3H2O
不是中和反应。
挑战自我
挑战自我
4.小华向氢氧化钠溶液中直接滴加稀盐酸,为确定氢氧化钠是否和盐酸恰好完全反应,他取出少量反应后的溶液倒入一只试管中,向其中滴加酚酞试液,振荡观察到酚酞试液不变色,于是得出:“两种物质恰好完全反应”。小亮认为小华的结论不准确,请你设计另外一个实验探究该反应后的溶液是否恰好完全反应。
方案一:
测量二者反应时的温度变化
方案二:
向氢氧化钠溶液先加无色酚酞,再滴加稀盐酸溶液
向稀盐酸中先滴加石蕊试液,再滴加氢氧化钠溶液
方案三:
测量二者反应时pH的变化
使用酸碱指示剂
作业布置
课后查阅资料,了解有关中和反应在日常生活和工农业生产的应用。
再 见
第四节 酸碱中和反应
第七单元 常见的酸和碱
腌制过程中生成了碱
吃起来有涩味
蘸少量的食醋
涩味消失
醋酸
发生化学反应了吗?
一、中和反应
实验探究
7
13
2
2
6
溶液的pH发生了明显的变化,可以证明酸和碱之间发生了化学反应。
氢氧化钠(碱)和稀盐酸(酸)发生的反应
NaOH + HCl === NaCl + H2O
碱
酸
氧化物
?
盐
金属离子
酸根离子
活动天地
KOH + HCl = KCl + H2O Ba(OH)2 + 2HCl = BaCl2 + 2H2O 2NaOH + H2SO4 = Na2SO4 + 2H2O Ba(OH)2 + H2SO4 =BaSO4 ↓+ 2H2O
HCl + NaOH NaCl + H2O
碱
酸
盐
水
+
+
2HCl + Ca(OH)2=CaCl2 + 2H2O
H2SO4 + 2NaOH=Na2SO4 + 2H2O
中和反应:酸与碱作用生成盐和水的反应。
1.中和反应的概念
水分子在溶液中不易电离。反应后,
溶液中减少的离子是 。
酸中的H+和碱中的OH-反应生成水。
HCl H+ + Cl-
NaOH Na+ + OH-
H++OH- H2O
H2O
Na++Cl-
H+ 和OH-
中和反应的实质:
2.中和反应的实质
想一想
判断一个反应是不是中和反应的关键是什么?
反应物必须是酸与碱
生成物必须是盐和水
在线测试
Ca(OH)2+2HCl= CaCl2+2H2O 2KOH + H2SO4 =K2SO4+ 2H2O
活动天地
二、中和反应的应用
当滴入盐酸量较少时,溶液中氢氧化钠有剩余,溶液呈碱性,pH > 7; 当滴入盐酸恰好与溶液中氢氧化钠完全反应时,溶液呈中性,pH = 7; 当滴入盐酸过量时,溶液中盐酸有剩余,溶液呈酸性,pH < 7。 (18,7)表示当滴入盐酸的体积为18时,pH = 7。
1.应用于医疗卫生
2.改变土壤的酸碱性
3.处理工业废水
4.调节溶液的酸碱性
胃酸(HCl)过多,口服碱性药物[例:Mg(OH)2]
向酸性土壤(H2SO4)中撒熟石灰[Ca(OH)2]
向酸性废水(HCl)中加熟石灰[Ca(OH)2]
实际应用:做完化学实验后剩余的酸性废液或碱性废液能否直接倒入下水道?应如何处理?
课堂小结
一、 中和反应
1.定义:
酸和碱作用生成盐和水的反应
2.实质:
H+ 和OH- 结合生成水
H+ + OH- = H2O
二、中和反应的应用
1.应用于医药卫生
2.改变土壤的酸碱性
3.处理工业废水
4.调节溶液的酸碱性
酸 + 碱 = 盐+ H2O
挑战自我
1.在滴有石蕊的稀盐酸中,加入足量NaOH溶液,加酸前后溶液颜色依次为 ( )
A.红色、紫色、蓝色 B.紫色、红色、蓝色
C.红色、蓝色、紫色 D.蓝色、紫色、红色
挑战自我
2. 酸与碱作用生成盐和水的反应,叫作中和反应,它在工 农业生产和日常生活中有广泛的用途,下列应用一定与中和反应原理无关的是( )
A.服用含Al(OH)3的药物治疗胃酸过量
B.使用熟石灰改良酸性土壤
C.用熟石灰和硫酸铜配制波尔多液
D.用NaOH溶液洗涤石油产品中的残余硫酸
3.以下的反应均生成盐和水,是不是中和反应呢?
CO2+2NaOH=Na2CO3+H2O
不是中和反应。
Fe2O3+6HCl=2FeCl3+3H2O
不是中和反应。
挑战自我
挑战自我
4.小华向氢氧化钠溶液中直接滴加稀盐酸,为确定氢氧化钠是否和盐酸恰好完全反应,他取出少量反应后的溶液倒入一只试管中,向其中滴加酚酞试液,振荡观察到酚酞试液不变色,于是得出:“两种物质恰好完全反应”。小亮认为小华的结论不准确,请你设计另外一个实验探究该反应后的溶液是否恰好完全反应。
方案一:
测量二者反应时的温度变化
方案二:
向氢氧化钠溶液先加无色酚酞,再滴加稀盐酸溶液
向稀盐酸中先滴加石蕊试液,再滴加氢氧化钠溶液
方案三:
测量二者反应时pH的变化
使用酸碱指示剂
作业布置
课后查阅资料,了解有关中和反应在日常生活和工农业生产的应用。
再 见
同课章节目录
- 第七单元 常见的酸和碱
- 第一节 酸及其性质
- 第二节 碱及其性质
- 第三节 溶液的酸碱性
- 第四节 酸碱中和反应
- 到实验室去:探究酸和碱的化学性质
- 第八单元 海水中的化学
- 第一节 海洋化学资源
- 第二节 海水“晒盐“
- 第三节 海水“制碱“
- 到实验室去:粗盐中难溶性杂质的去除
- 第九单元 金属
- 第一节 常见的金属材料
- 第二节 金属的化学性质
- 第三节 钢铁的锈蚀与防护
- 到实验室去 探究金属的性质
- 第十单元 化学与健康
- 第一节 食物中的有机物
- 第二节 化学元素与人体健康
- 第三节 远离有毒物质
- 第十一单元 化学与社会发展
- 第一节 化学与能源开发
- 第二节 化学与材料研制
- 第三节 化学与农业生产
- 第四节 化学与环境保护
