10.2 酸和碱的中和反应 课件(28张PPT)
文档属性
| 名称 | 10.2 酸和碱的中和反应 课件(28张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 302.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-02-21 00:00:00 | ||
图片预览







文档简介
课件28张PPT。 第十单元 酸和碱
课题2 酸和碱的中和反应
学习目标1、通过实验得出酸和碱之间发生中和反应,什么是中和反应,会写有关的化学方程式。
2、 知道什么是盐。
3、了解中和反应在实际中的应用。
4、酸碱性与酸碱度的关系,酸碱度的表示,如何测量酸碱度即pH,酸碱度在实际中的应用。
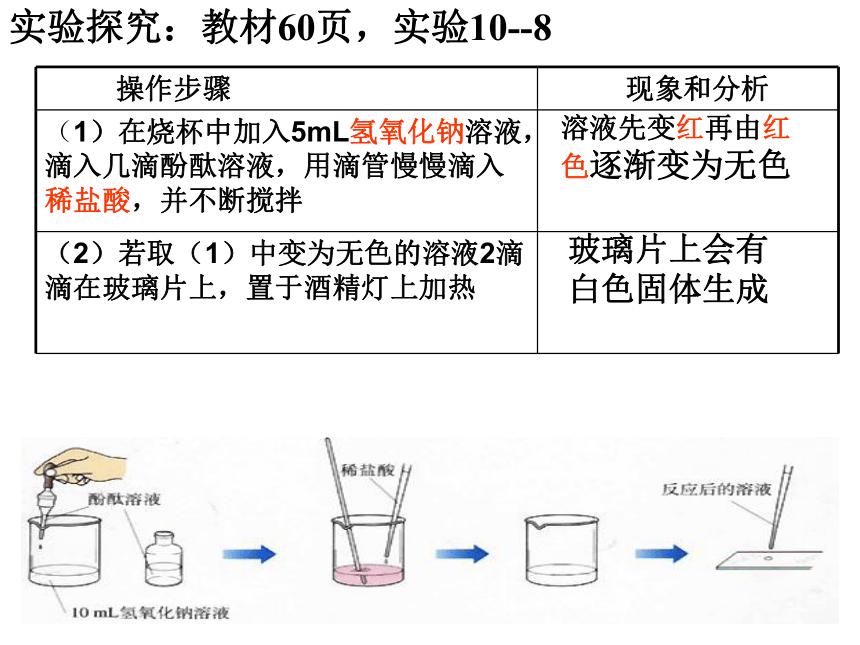
思考:酸有相似的化学性质,碱有相似的化学性质,那么,酸和碱会发生化学反应吗?实验探究:教材60页,实验10--8溶液先变红再由红色逐渐变为无色玻璃片上会有白色固体生成
思考:1.为什么要加入酚酞指示剂?
借以判断反应有无发生
2. 什么时候酸和碱恰好完全反应?
溶液恰好由红色变为无色
3. 氢氧化钠与盐酸反应了吗?
4.它们之间可能会生成什么物质?还会是氢氧化钠吗?为什么?
5.你能写出该反应的化学方程式吗? 发生了反应氯化钠和水 不会 酚酞变为无色氢氧化钠(碱)和稀盐酸(酸)发生的反应NaOH + HCl === NaCl + H2O碱酸盐1、盐:有金属离子或铵根离子和酸根离子构成的化合物叫做盐
2、中和反应:酸与碱作用生成盐和水的反应叫做中和反应
注意:中和反应的产物是盐和水,但有盐和水生成的反应不一定是中和反应。酸和金属氧化物,碱和非金属氧化物的反应
常见的中和反应,试写出化学方程式 酸 + 碱 = 盐 + 水
盐酸 + 氢氧化钙
硫酸 + 氢氧化钠
硫酸 + 氢氧化钙 常见的中和反应 酸 + 碱 = 盐 + 水
2HCl + Ca(OH)2 = CaCl2 + 2H2O
H2SO4+ 2NaOH = Na2SO4 + 2H2O
H2SO4+ Ca(OH)2 = CaSO4 + 2H2O
反应实质:氢离子与氢氧根离子结合成水分子。
(或H+ + OH- = H2O)总结、辨识:化合物的分类
化合物分为酸、碱、盐、氧化物
酸------H+ + 酸根离子
碱------金属离子+ OH-
盐------金属离子+酸根离子
氧化物------金属或非金属元素+氧元素
1.下列物质属于盐的是( )
A. CuO B. Cu(OH)2 C. CuSO4 D. HCl 2.填写下表(类别按酸、碱、盐、氧化物填写)CNaOH碱硫酸铜盐H2SO4酸Fe2O3氧化物随堂练习3.下列反应,属于中和反应的是( )
A. Zn +2HCl = ZnCl2 + H2 ↑ B. CuO + 2HCl = CuCl2 +H2O
C. Ca(OH)2 + H2SO4 = CaSO4 + 2H2O
D. CaCO3 + 2HCl = CaCl2 + H2O +CO2↑C阅读教材61页,总结中和反应在实际中的应用
二、中和反应在实际中的应用 植物需要在一定酸碱性的土壤中生长,但近年来由于不合理使用化肥,或酸雨的形成,破坏土壤的酸碱性,不利于植物的生长。应怎样去改变酸性土壤?用熟石灰中和。1、改变土壤的酸碱性
根据土壤情况,可以利用中和反应,在土壤中加入酸性或碱性物质,以调节土壤的酸碱性,利用植物生长。 某硫酸厂排出的废水中含有硫酸等杂质,严重危害当地的生态环境,你会怎样处理这些废水呢?
印染厂的废水成碱性呢? 应在排放前用碱性物质(例如熟石灰)进行中和处理。
可加入硫酸中和2、处理工厂的废水盐酸Al(OH)3 + 3HCl === AlCl3 + 3H2O氢氧化铝能中和过多的胃酸你能写出化学方程式吗?3、用于医药二、中和反应在实际中的应用1、改变土壤的酸碱性2、处理工厂的废水3、用于医药 (1)中和胃酸 (2)制成含碱性物质的药水,
减轻蚊虫叮咬的痛痒 三、溶液酸碱度的表示法—pH(阅读教材61页第三部分)1. pH的范围通常为0~14(包括0、14) 溶液的酸碱性:酸溶液具有酸性;碱溶液具有碱性
(注意:酸溶液≠酸性溶液 碱溶液≠碱性溶液)检验溶液是酸性还是碱性的,可用酸碱指示剂溶液的酸碱度: 表示溶液酸碱性的强弱程度即溶液酸碱度,用 pH表示2. pH试纸测液体的pH(实验10--9) 在玻璃片上(或白瓷板或点滴板)放一小片pH 试纸,用干净的玻璃棒蘸取被测液滴到试纸上,把试纸显示的颜色与标准比色卡比较,即可得出被测液的pH 。
(测出的pH只能为整数哟)测定方法:⑴pH 7,溶液显中性 。⑶ pH 7,溶液显碱性,pH越大,碱性越强。=﹥如NaCl、等溶液如H2SO4等溶液⑵ pH 7,溶液显酸性, pH越小,酸性越强。如 NaOH 等溶液 3. 溶液的酸碱性与酸碱度(即pH)的关系:0 7 14中性﹤4. 了解溶液的酸碱度有重要意义: ①化工生产中许多反应必须在一定pH溶液里才能进行; ②在农业生产中,农作物一般适宜在pH为7或接近7的土壤中生长;
(土壤 pH<4或 pH>8,一般不适于种植)③测定雨水的pH,可以了解空气的污染情况
(注:正常雨水(含H2CO3)的pH约为5.6,酸雨的pH小于5.6); ④测定人体内或排出的液体的pH,可以了解人体的健康状况。小结:1.中和反应:中和反应的应用: ⑴农业 ⑵工业 ⑶生活 2.溶液的酸碱度:pH表示,pH通常为0—14。
用pH试纸可以测定溶液的酸碱度。 ⑵了解溶液酸碱度在实际中有重要的意义农业 、工业 、环境 、生活定义:酸+碱→盐+水
实质:H+ + OH- = H2O
盐=金属离子+酸根离子①pH 7,溶液呈中性,
②pH 7溶液呈酸性, pH越小,酸性越强,
③pH 7溶液呈碱性, pH越大,碱性越强。⑴溶液的酸碱性与pH的关系:﹥﹤= 巩固练习:
1.pH=0的溶液是( )
A.不存在 B.酸性溶液 C.碱性溶液 D.中性溶液
2、下列关于中和反应的说法中,正确的是( )
A.酸与碱作用,生成盐和水的反应
B.能生成水的反应
C.能生成盐的反应
D.能生成盐和水的反应
3.只用一种试剂将蒸馏水、氢氧化钠、稀硫酸三种无色溶液一次性区别开,这种试剂是( )
A.酚酞试液 B.紫色石蕊试液 C.二氧化碳 D.石灰水
4.某工厂排放的废水的pH是4.5,取少量该废水加入试管中,再滴酚酞溶液,溶液呈______色,如果要使试管里溶液的pH升高到=7,可以采用 __________ 的方法。
B A B 无碱性溶液5.在用稀盐酸和氢氧化钠溶液进行中和反应实验时,反应过程中溶液的酸碱度变化如图13所示。 ?????????????????????
(1)该反应的化学方程式为:
(2)该实验操作是将
?
??????????????? ? 滴加到另一种溶液中。
(3)当加入溶液的质量为a g时,所得溶液中的溶
质为(写化学式)???????? 。
(4)当加入溶液的质量为b g时,向所得溶液中滴加酚酞溶液,溶液呈? ???色。
NaOH+HCl=NaCl+H2O氢氧化钠溶液HCl NaCl红作业:1、熟记本节知识点
2、做本节练习题
(后面附练习题) 谢谢! 10.2 酸和碱的中和反应(练习题)
1、下列反应属于中和反应的是( )
A. CuO+ H2SO4= CuSO4 +H2O B.2HCl +Ca(OH)2 = CaCl2+2H2O
C. 2NaOH+CO2=Na2CO3+ H2O D. CuSO4+2NaOH=Cu(OH)2 ↓ +Na2SO4
2、下列物质属于盐的是( ) A. Fe2O3 B.Mg(OH)2 C. Zn D. CaCO3
3、改良酸性土壤应施加的物质是(? ?) A. 食盐 B. 烧碱 C.稀盐酸 D.熟石灰
4、向滴有酚酞的NaOH溶液中滴入稀盐酸至过量,下列叙述正确的是(? ?)
A.溶液由红色变为无色,pH逐渐增大 B. 溶液由无色变为红色,pH逐渐减小
C.溶液由红色变为无色,pH逐渐减小 D.溶液颜色不变,pH逐渐增大
5、下列溶液中,碱性最强的是( ) A. pH=0 B. pH=1 C. pH=7 D. pH=14
6、蚊虫叮咬人时,会向人体注入一种叫做蚁酸的物质,使人疼痛瘙痒,要消除这种症状可在叮咬处涂抹 A. pH=9的牙膏或者 pH=10的肥皂水
B. pH=7的食盐水 C. pH=13的烧碱溶液 D. pH=3的食醋
7、下列操作导致原溶液 pH降低的是( )
A.向稀酸溶液里加少许氢氧化钠溶液 B.向水里加少许氢氧化钠溶液
C.向NaOH溶液里加少许稀盐酸 D.向氯化钠溶液里加入氯化钠固体
8、某溶液pH=8,要想使pH增大( )
A.加固体NaOH B.加足量浓硫酸 C.加足量水 D.加适量稀硫酸
9、下列说法正确的是 ( )
A. 紫色石蕊试液可使盐酸变红 B. 中和反应一定生成盐和水
C. 生成盐和水的反应一定是中和反应 D. 测溶液 pH时先用蒸馏水润湿 pH试纸
10、将某氢氧化钾溶液加水稀释,加水质量跟溶液pH变化关系为( ? )
A. 溶液pH减小,无限接近于7 B.溶液pH由小于7 到大于7
C.溶液pH由大于7 到小于7 D.pH始终小于7
11、将下列不同pH的各对溶液混合,其pH可能为7的是( )
A. pH=3、pH=4 B. pH=11、pH=7 C. pH=6、pH=8 D.pH=0、pH=5
12、下列农作物生长最适宜土壤的pH范围:
棉花:6.0---6.8 玉米6.0----7.0 大豆:6.5----- 7.5 茶树:5.0----5.5
某地土壤pH接近于7,最不适宜种植( )
A.?棉花 B.?玉米 C.?大豆 D.?茶树
13、打印墨水pH:7.5---9.0; 打印纸pH:4.5--6.5,下列说法正确是( )
A.打印墨水偏酸性 B. 打印墨水显中性
C. 打印纸偏酸性 D. 打印纸偏碱性
14、当溶液pH=7时,滴入石蕊溶液显_____色,当pH<7时,溶液呈______性, 滴入石蕊溶液显_____色,当pH>7时,溶液呈______性,滴入酚酞溶液显_____色。
15、测定pH最简单的方法是使用_______,测定时,用______蘸取待测溶液滴在_______上,然后把限时的颜色跟_________对照,便可知溶液的pH.若测得某土壤的pH<4,可以施入适量的___________来改良土壤
16、某工厂排出的无色废水的pH=3,若往此废水中滴入紫色石蕊溶液,溶液变成_______色,若将此废水调节为微碱性,可在石灰石,生石灰,铁屑这几种物质中选择______以达到目的
17、在氢氧化钠溶液中滴入几滴紫色石蕊溶液,溶液呈_____色,在此溶液中逐渐滴入盐酸至恰好反应时,溶液呈______色,此时若分离其中的溶质,最简单的方法是________。
18、有三种物质①CO2、②生石灰、③食盐把它们分别放入或通入蒸馏水中所得溶液pH由小到大的排列顺序是_________(填序号
19、向盛有10ml稀盐酸(滴有少量紫色石蕊溶液)的烧杯中逐滴加入氢氧化钠溶液,用pH计(测pH的仪器)测定溶液的pH,所得数据如下,并回答问题 (1)当加入NaOH溶液_______ml时,稀盐酸和氢氧化钠溶液恰好完全反应
(2)当加入NaOH溶液13ml时,溶液显_______色 (3)当烧杯溶液pH=1.4时,溶液中的溶质有____________
20、(1)某同学近日常吐酸水,医生开的药方中有一种含氢氧化铝的药物,其作用是什么?
(2)医生提醒要注意饮食,少吃酸性过强的食品,下列食品最适宜该同学食用的是_______
葡萄pH为3.5----4.5 苹果pH为2.9----3.3
牛奶pH为6.3----6.6 玉米粥萄pH为6.8----8.0
21、对于稀硫酸而言,溶质质量分数越大溶液的酸性越强。常温下,10%的稀硫酸pH_______
(填大于、小于或者等于)20%的稀硫酸的pH。如果要使稀硫酸的pH升高,你采取的方法:
(1)不发生化学反应的方法有_________
(2)发生化学反应的方法有(要求各种方法中所选物质的类别不同)_______、________、_________
22、设计实验:测一块土地的酸碱度(写出实验用品,实验步骤)
23、喇叭花汁液性质与紫色石蕊试液性质相似。喇叭花在肥皂水里变成蓝色,在家庭厨房里的某种调味品中变成红色。 (1)肥皂水pH_______7(填<、>或=)
(2)选用的调味品可能是___________
24、向100g稀硫酸中滴加100g17.1%的氢氧化钡溶液,溶液的导电性变为0。求稀硫酸溶液的溶质质量分数。(提示:H2SO4+Ba(OH)2 = BaSO4↓+2H2O )
课题2 酸和碱的中和反应
学习目标1、通过实验得出酸和碱之间发生中和反应,什么是中和反应,会写有关的化学方程式。
2、 知道什么是盐。
3、了解中和反应在实际中的应用。
4、酸碱性与酸碱度的关系,酸碱度的表示,如何测量酸碱度即pH,酸碱度在实际中的应用。
思考:酸有相似的化学性质,碱有相似的化学性质,那么,酸和碱会发生化学反应吗?实验探究:教材60页,实验10--8溶液先变红再由红色逐渐变为无色玻璃片上会有白色固体生成
思考:1.为什么要加入酚酞指示剂?
借以判断反应有无发生
2. 什么时候酸和碱恰好完全反应?
溶液恰好由红色变为无色
3. 氢氧化钠与盐酸反应了吗?
4.它们之间可能会生成什么物质?还会是氢氧化钠吗?为什么?
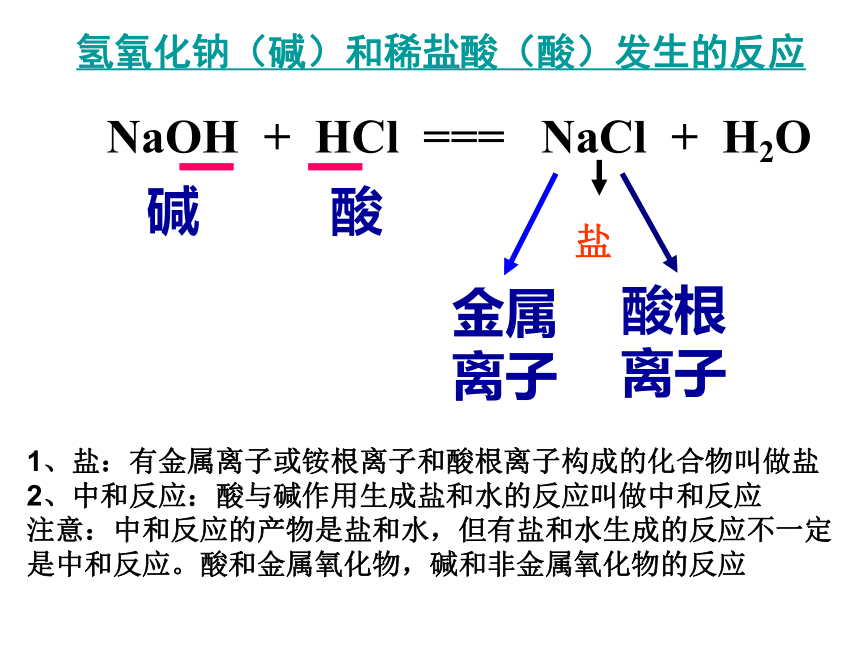
5.你能写出该反应的化学方程式吗? 发生了反应氯化钠和水 不会 酚酞变为无色氢氧化钠(碱)和稀盐酸(酸)发生的反应NaOH + HCl === NaCl + H2O碱酸盐1、盐:有金属离子或铵根离子和酸根离子构成的化合物叫做盐
2、中和反应:酸与碱作用生成盐和水的反应叫做中和反应
注意:中和反应的产物是盐和水,但有盐和水生成的反应不一定是中和反应。酸和金属氧化物,碱和非金属氧化物的反应
常见的中和反应,试写出化学方程式 酸 + 碱 = 盐 + 水
盐酸 + 氢氧化钙
硫酸 + 氢氧化钠
硫酸 + 氢氧化钙 常见的中和反应 酸 + 碱 = 盐 + 水
2HCl + Ca(OH)2 = CaCl2 + 2H2O
H2SO4+ 2NaOH = Na2SO4 + 2H2O
H2SO4+ Ca(OH)2 = CaSO4 + 2H2O
反应实质:氢离子与氢氧根离子结合成水分子。
(或H+ + OH- = H2O)总结、辨识:化合物的分类
化合物分为酸、碱、盐、氧化物
酸------H+ + 酸根离子
碱------金属离子+ OH-
盐------金属离子+酸根离子
氧化物------金属或非金属元素+氧元素
1.下列物质属于盐的是( )
A. CuO B. Cu(OH)2 C. CuSO4 D. HCl 2.填写下表(类别按酸、碱、盐、氧化物填写)CNaOH碱硫酸铜盐H2SO4酸Fe2O3氧化物随堂练习3.下列反应,属于中和反应的是( )
A. Zn +2HCl = ZnCl2 + H2 ↑ B. CuO + 2HCl = CuCl2 +H2O
C. Ca(OH)2 + H2SO4 = CaSO4 + 2H2O
D. CaCO3 + 2HCl = CaCl2 + H2O +CO2↑C阅读教材61页,总结中和反应在实际中的应用
二、中和反应在实际中的应用 植物需要在一定酸碱性的土壤中生长,但近年来由于不合理使用化肥,或酸雨的形成,破坏土壤的酸碱性,不利于植物的生长。应怎样去改变酸性土壤?用熟石灰中和。1、改变土壤的酸碱性
根据土壤情况,可以利用中和反应,在土壤中加入酸性或碱性物质,以调节土壤的酸碱性,利用植物生长。 某硫酸厂排出的废水中含有硫酸等杂质,严重危害当地的生态环境,你会怎样处理这些废水呢?
印染厂的废水成碱性呢? 应在排放前用碱性物质(例如熟石灰)进行中和处理。
可加入硫酸中和2、处理工厂的废水盐酸Al(OH)3 + 3HCl === AlCl3 + 3H2O氢氧化铝能中和过多的胃酸你能写出化学方程式吗?3、用于医药二、中和反应在实际中的应用1、改变土壤的酸碱性2、处理工厂的废水3、用于医药 (1)中和胃酸 (2)制成含碱性物质的药水,
减轻蚊虫叮咬的痛痒 三、溶液酸碱度的表示法—pH(阅读教材61页第三部分)1. pH的范围通常为0~14(包括0、14) 溶液的酸碱性:酸溶液具有酸性;碱溶液具有碱性
(注意:酸溶液≠酸性溶液 碱溶液≠碱性溶液)检验溶液是酸性还是碱性的,可用酸碱指示剂溶液的酸碱度: 表示溶液酸碱性的强弱程度即溶液酸碱度,用 pH表示2. pH试纸测液体的pH(实验10--9) 在玻璃片上(或白瓷板或点滴板)放一小片pH 试纸,用干净的玻璃棒蘸取被测液滴到试纸上,把试纸显示的颜色与标准比色卡比较,即可得出被测液的pH 。
(测出的pH只能为整数哟)测定方法:⑴pH 7,溶液显中性 。⑶ pH 7,溶液显碱性,pH越大,碱性越强。=﹥如NaCl、等溶液如H2SO4等溶液⑵ pH 7,溶液显酸性, pH越小,酸性越强。如 NaOH 等溶液 3. 溶液的酸碱性与酸碱度(即pH)的关系:0 7 14中性﹤4. 了解溶液的酸碱度有重要意义: ①化工生产中许多反应必须在一定pH溶液里才能进行; ②在农业生产中,农作物一般适宜在pH为7或接近7的土壤中生长;
(土壤 pH<4或 pH>8,一般不适于种植)③测定雨水的pH,可以了解空气的污染情况
(注:正常雨水(含H2CO3)的pH约为5.6,酸雨的pH小于5.6); ④测定人体内或排出的液体的pH,可以了解人体的健康状况。小结:1.中和反应:中和反应的应用: ⑴农业 ⑵工业 ⑶生活 2.溶液的酸碱度:pH表示,pH通常为0—14。
用pH试纸可以测定溶液的酸碱度。 ⑵了解溶液酸碱度在实际中有重要的意义农业 、工业 、环境 、生活定义:酸+碱→盐+水
实质:H+ + OH- = H2O
盐=金属离子+酸根离子①pH 7,溶液呈中性,
②pH 7溶液呈酸性, pH越小,酸性越强,
③pH 7溶液呈碱性, pH越大,碱性越强。⑴溶液的酸碱性与pH的关系:﹥﹤= 巩固练习:
1.pH=0的溶液是( )
A.不存在 B.酸性溶液 C.碱性溶液 D.中性溶液
2、下列关于中和反应的说法中,正确的是( )
A.酸与碱作用,生成盐和水的反应
B.能生成水的反应
C.能生成盐的反应
D.能生成盐和水的反应
3.只用一种试剂将蒸馏水、氢氧化钠、稀硫酸三种无色溶液一次性区别开,这种试剂是( )
A.酚酞试液 B.紫色石蕊试液 C.二氧化碳 D.石灰水
4.某工厂排放的废水的pH是4.5,取少量该废水加入试管中,再滴酚酞溶液,溶液呈______色,如果要使试管里溶液的pH升高到=7,可以采用 __________ 的方法。
B A B 无碱性溶液5.在用稀盐酸和氢氧化钠溶液进行中和反应实验时,反应过程中溶液的酸碱度变化如图13所示。 ?????????????????????
(1)该反应的化学方程式为:
(2)该实验操作是将
?
??????????????? ? 滴加到另一种溶液中。
(3)当加入溶液的质量为a g时,所得溶液中的溶
质为(写化学式)???????? 。
(4)当加入溶液的质量为b g时,向所得溶液中滴加酚酞溶液,溶液呈? ???色。
NaOH+HCl=NaCl+H2O氢氧化钠溶液HCl NaCl红作业:1、熟记本节知识点
2、做本节练习题
(后面附练习题) 谢谢! 10.2 酸和碱的中和反应(练习题)
1、下列反应属于中和反应的是( )
A. CuO+ H2SO4= CuSO4 +H2O B.2HCl +Ca(OH)2 = CaCl2+2H2O
C. 2NaOH+CO2=Na2CO3+ H2O D. CuSO4+2NaOH=Cu(OH)2 ↓ +Na2SO4
2、下列物质属于盐的是( ) A. Fe2O3 B.Mg(OH)2 C. Zn D. CaCO3
3、改良酸性土壤应施加的物质是(? ?) A. 食盐 B. 烧碱 C.稀盐酸 D.熟石灰
4、向滴有酚酞的NaOH溶液中滴入稀盐酸至过量,下列叙述正确的是(? ?)
A.溶液由红色变为无色,pH逐渐增大 B. 溶液由无色变为红色,pH逐渐减小
C.溶液由红色变为无色,pH逐渐减小 D.溶液颜色不变,pH逐渐增大
5、下列溶液中,碱性最强的是( ) A. pH=0 B. pH=1 C. pH=7 D. pH=14
6、蚊虫叮咬人时,会向人体注入一种叫做蚁酸的物质,使人疼痛瘙痒,要消除这种症状可在叮咬处涂抹 A. pH=9的牙膏或者 pH=10的肥皂水
B. pH=7的食盐水 C. pH=13的烧碱溶液 D. pH=3的食醋
7、下列操作导致原溶液 pH降低的是( )
A.向稀酸溶液里加少许氢氧化钠溶液 B.向水里加少许氢氧化钠溶液
C.向NaOH溶液里加少许稀盐酸 D.向氯化钠溶液里加入氯化钠固体
8、某溶液pH=8,要想使pH增大( )
A.加固体NaOH B.加足量浓硫酸 C.加足量水 D.加适量稀硫酸
9、下列说法正确的是 ( )
A. 紫色石蕊试液可使盐酸变红 B. 中和反应一定生成盐和水
C. 生成盐和水的反应一定是中和反应 D. 测溶液 pH时先用蒸馏水润湿 pH试纸
10、将某氢氧化钾溶液加水稀释,加水质量跟溶液pH变化关系为( ? )
A. 溶液pH减小,无限接近于7 B.溶液pH由小于7 到大于7
C.溶液pH由大于7 到小于7 D.pH始终小于7
11、将下列不同pH的各对溶液混合,其pH可能为7的是( )
A. pH=3、pH=4 B. pH=11、pH=7 C. pH=6、pH=8 D.pH=0、pH=5
12、下列农作物生长最适宜土壤的pH范围:
棉花:6.0---6.8 玉米6.0----7.0 大豆:6.5----- 7.5 茶树:5.0----5.5
某地土壤pH接近于7,最不适宜种植( )
A.?棉花 B.?玉米 C.?大豆 D.?茶树
13、打印墨水pH:7.5---9.0; 打印纸pH:4.5--6.5,下列说法正确是( )
A.打印墨水偏酸性 B. 打印墨水显中性
C. 打印纸偏酸性 D. 打印纸偏碱性
14、当溶液pH=7时,滴入石蕊溶液显_____色,当pH<7时,溶液呈______性, 滴入石蕊溶液显_____色,当pH>7时,溶液呈______性,滴入酚酞溶液显_____色。
15、测定pH最简单的方法是使用_______,测定时,用______蘸取待测溶液滴在_______上,然后把限时的颜色跟_________对照,便可知溶液的pH.若测得某土壤的pH<4,可以施入适量的___________来改良土壤
16、某工厂排出的无色废水的pH=3,若往此废水中滴入紫色石蕊溶液,溶液变成_______色,若将此废水调节为微碱性,可在石灰石,生石灰,铁屑这几种物质中选择______以达到目的
17、在氢氧化钠溶液中滴入几滴紫色石蕊溶液,溶液呈_____色,在此溶液中逐渐滴入盐酸至恰好反应时,溶液呈______色,此时若分离其中的溶质,最简单的方法是________。
18、有三种物质①CO2、②生石灰、③食盐把它们分别放入或通入蒸馏水中所得溶液pH由小到大的排列顺序是_________(填序号
19、向盛有10ml稀盐酸(滴有少量紫色石蕊溶液)的烧杯中逐滴加入氢氧化钠溶液,用pH计(测pH的仪器)测定溶液的pH,所得数据如下,并回答问题 (1)当加入NaOH溶液_______ml时,稀盐酸和氢氧化钠溶液恰好完全反应
(2)当加入NaOH溶液13ml时,溶液显_______色 (3)当烧杯溶液pH=1.4时,溶液中的溶质有____________
20、(1)某同学近日常吐酸水,医生开的药方中有一种含氢氧化铝的药物,其作用是什么?
(2)医生提醒要注意饮食,少吃酸性过强的食品,下列食品最适宜该同学食用的是_______
葡萄pH为3.5----4.5 苹果pH为2.9----3.3
牛奶pH为6.3----6.6 玉米粥萄pH为6.8----8.0
21、对于稀硫酸而言,溶质质量分数越大溶液的酸性越强。常温下,10%的稀硫酸pH_______
(填大于、小于或者等于)20%的稀硫酸的pH。如果要使稀硫酸的pH升高,你采取的方法:
(1)不发生化学反应的方法有_________
(2)发生化学反应的方法有(要求各种方法中所选物质的类别不同)_______、________、_________
22、设计实验:测一块土地的酸碱度(写出实验用品,实验步骤)
23、喇叭花汁液性质与紫色石蕊试液性质相似。喇叭花在肥皂水里变成蓝色,在家庭厨房里的某种调味品中变成红色。 (1)肥皂水pH_______7(填<、>或=)
(2)选用的调味品可能是___________
24、向100g稀硫酸中滴加100g17.1%的氢氧化钡溶液,溶液的导电性变为0。求稀硫酸溶液的溶质质量分数。(提示:H2SO4+Ba(OH)2 = BaSO4↓+2H2O )
同课章节目录
