九年级化学下册第八章常见的酸、碱、盐8.2常见的酸和碱教学课件(新版)粤教版(29张PPT)
文档属性
| 名称 | 九年级化学下册第八章常见的酸、碱、盐8.2常见的酸和碱教学课件(新版)粤教版(29张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 1.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 粤教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-02-22 22:30:15 | ||
图片预览







文档简介
(共29张PPT)
教学课件
化学 九年级下册 科粤版
第八章 常见的酸、碱、盐
8.2 常见的酸和碱
常见的酸
常见的碱
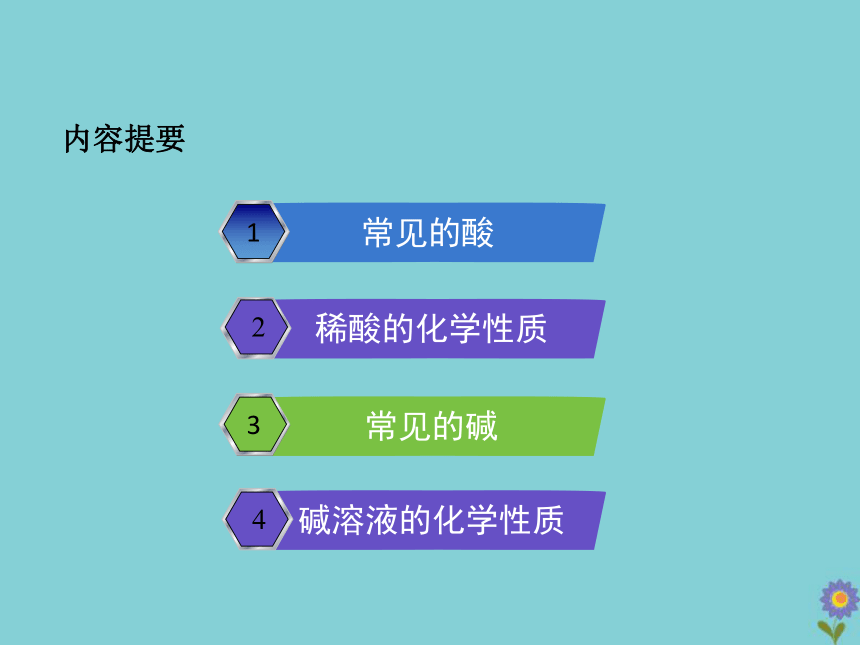
内容提要
1
3
稀酸的化学性质
2
碱溶液的化学性质
4
学习目标
1.知道常见的酸,掌握硫酸、盐酸、硝酸的物理性质及用途,了解浓硫酸的特性与稀释方法;
2.掌握稀酸的化学通性;
3.知道常见的碱,掌握氢氧化钠、氢氧化钙、氢氧化钾的物理性质和用途;
4.掌握碱溶液的化学通性。
一、常见的酸
盐酸、硫酸、硝酸都是常见的重要的酸
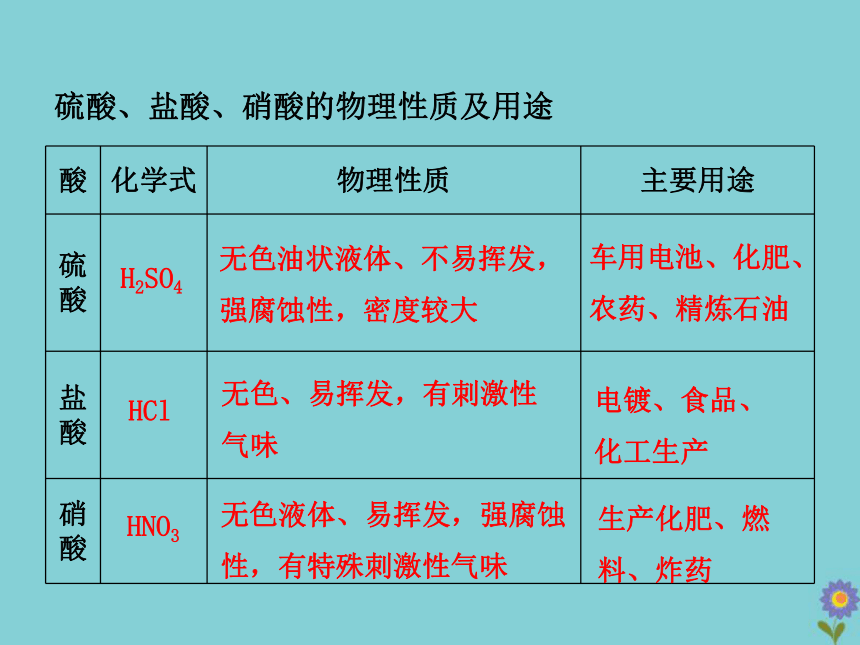
硫酸、盐酸、硝酸的物理性质及用途
酸 化学式 物理性质 主要用途
硫酸
盐酸
硝酸
H2SO4
HCl
HNO3
无色、易挥发,有刺激性气味
电镀、食品、化工生产
无色油状液体、不易挥发,强腐蚀性,密度较大
车用电池、化肥、农药、精炼石油
无色液体、易挥发,强腐蚀性,有特殊刺激性气味
生产化肥、燃料、炸药
操作 现象
用玻璃棒蘸浓硫酸在纸上写字
在表面皿里的肉皮上滴些浓硫酸
烧杯内的蔗糖润湿后滴10ml浓硫酸
观察活动一:浓硫酸的脱水性
蔗糖迅速变黑、膨胀、有刺激性气味的气体放出
接触到浓硫酸的纸张先变黄后变黑
肉皮腐烂,颜色变为鲜红色
浓硫酸有强腐蚀性
实验表明:浓硫酸很快使蔗糖、纸张等脱水,变成碳,可见它有强脱水性。
浓硫酸是危险品,保管和使用都要格外小心。
——可做干燥剂
浓硫酸有强吸水性
浓硫酸对衣物、皮肤等有强腐蚀性。
如果不慎沾上硫酸,应立即用布抹去,再用大量水冲洗。
浓硫酸稀释方法:
把浓硫酸缓缓注入盛有水的烧杯中,用玻璃棒引流(或沿着烧杯壁缓缓倾倒)并不断搅拌。
切记:不可将水倒进浓硫酸里
稀释浓硫酸时为什么不能将水倒进浓硫酸里而是要将浓硫酸沿着器壁慢慢注入水中,而且还不断搅拌?
水的密度较浓硫酸小,当水滴入浓硫酸溶解时会产生大量热使水立即沸腾,带着硫酸液滴向四周飞溅,十分危险!
而将密度大的浓硫酸缓慢地注入水中,及时搅拌,使产生的热得以迅速扩散,操作安全!
实验内容 现象 化学方程式 酸的化学相似性
将镁、锌、铁铝分别与稀盐酸反应
实验活动一:酸与较活泼金属反应
有气泡产生,反应速率:镁>铝>锌>铁
二、稀酸的化学性质
较活泼
金属
+
酸
↓
盐
+
氢气
①Zn + 2HCl === ZnCl2 + H2↑
②Mg + 2HCl === MgCl2 + H2↑
③2Al + 6HCl === 2AlCl3 + 3H2↑
④Fe + 2HCl === FeCl2 + H2↑
注:由金属离子和酸根离子组成的化合物统称为盐
实验内容 现象 化学方程式 酸的化学相似性
向试管中生满铁锈的铁钉滴加稀硫酸
实验活动二:酸与金属氧化物反应
金属氧化物
+
酸
↓
盐
+
氢气
Fe2O3+3H2SO4 == Fe2(SO4)3 + 3H2O
铁锈溶解,溶液变黄
实验内容 现象 化学方程式 酸的化学相似性
将稀盐酸滴入硝酸银溶液中
实验活动三:酸与盐反应
盐
+
酸
↓
新盐
+
新酸
AgNO3+HCl == AgCl ↓ + HNO3
有白色沉淀生成
注:硝酸银呈白色沉淀,且不溶于稀硝酸,是检验氯离子的试剂。
稀盐酸、稀硫酸溶液中都含有大量的氢离子(H+),所以酸溶液具有相似的化学性质。
注:硝酸的性质比较特殊,它与较活泼金属反应时,一般不产生氢气,而是生成氮氧化物等,故无此通性。
三、常见的碱
氢氧化钙、氢氧化钠、氢氧化钾是常见的碱
氢氧化钠
氢氧化钙
氢氧化钾
氢氧化钙、氢氧化钠、氢氧化钾的俗称及用途:
名称 化学式 俗称 用途
氢氧化钙
氢氧化钠
氢氧化钾
熟石灰或消石灰
烧碱、火碱或苛性钠
苛性钾
Ca(OH)2
NaOH
KOH
建筑材料、漂白剂、处理污水、改良酸性土壤
制肥皂、洗涤剂、造纸、纺织工业、炼制石油
电池工业
CaO + H2O == Ca(OH)2
石灰吟 于谦
千锤万凿出深山,
烈火焚烧若等闲。
粉身碎骨全不怕,
要留清白在人间。
CaCO3 === CaO + CO2↑
高温
NaOH溶液和石灰水都能吸收二氧化碳气体,固体氢氧化钠在空气中不但易吸收水蒸气而潮解,还能吸收二氧化碳气体而变质。
注:氢氧化钠有强烈的腐蚀性,使用时要十分小心,特别注意防止它对眼睛的伤害。如果不慎沾到氢氧化钠,应立即用水冲洗。
实验内容 现象 化学方程式 碱的化学相似性
两支充满CO2的试管,一支插入水中,一支插入氢氧化钠溶液中
实验活动一:碱与非金属氧化物反应
试管液面上升,第一支试管液面比第二支低
非金属氧化物+
碱
↓
盐
+
水
①H2O + CO2 == H2CO3
②2NaOH+CO2=Na2CO3+H2O
四、碱溶液的化学性质
实验内容 现象 化学方程式 碱的化学相似性
用澄清石灰水分别与硫酸铜溶液和氯化铁溶液反应
实验活动二:碱与盐反应
①蓝色退去,生成蓝色沉淀
②黄色退去,生成红褐色沉淀
盐
+
碱
↓
新盐
+
新碱
①Ca(OH)2+CuSO4 ==
Cu(OH)2↓+CaSO4
②2FeCl3 +3Ca(OH)2 ==
2Fe(OH)3↓ +3CaCl2
氢氧化钠、氢氧化钙、氢氧化钾在水溶液中都能产生氢氧根离子(OH-),这使碱溶液具有相似的化学性质。
知识点1:常见的酸
1.下列物质质量置于空气中,一段时间后,质量减小的是( )
A.碳酸钙 B.氯化钠
C.浓盐酸 D.氢氧化钠
经典例题
C
知识点2:稀酸的化学性质
1.盐酸或稀硫酸常用作金属表面的清洁剂是利用了它们化学性质中的( )
A.能与碱反应
B.能与金属反应
C.能与某些金属氧化物反应
D.能与紫色石蕊试液反应
C
知识点3:常见的碱
1.下列有关Ca(OH)2的说法,错误的是( )
A.俗称熟石灰或消石灰
B.可用于治疗胃酸过多症
C.可用于改良酸性土壤
D.可用于处理硫酸厂排出的酸性废水
B
知识点4:碱溶液的化学性质
1.下面是某同学进行碱的化学性质实验时记录的实验现象,其中与事实不相符的是( )
A.在Ca(OH)2溶液中加入稀盐酸,无明显变化
B.在NaOH溶液中通入CO2气体,有白色沉淀生成
C.在Ca(OH)2溶液中加入几滴石蕊溶液,溶液呈蓝色
D.在NaOH溶液中加入CuSO4溶液,有蓝色沉淀生成
B
1.酸具有酸的通性的原因是( )
A.酸都能电离出H+ B.酸都含有酸根
C.酸中都含有氢元素 D.酸中都含有氧元素
2.下列物质长时间暴露在空气中,会变质的是( )
A.CaCO3 B.浓盐酸
C.浓硫酸 D.烧碱
知能训练
A
D
3.一定量的空气依次通过足量石灰水及浓硫酸,分别被除去的是( )
A.氮气和氧气 B.氮气、氧气和稀有气体
C.二氧化碳和水蒸气 D.二氧化碳和氮气
4.下列物质中有一种与其他三种物质都能发生反应的是( )
A.铁 B.稀盐酸
C.碳酸钙 D.氢氧化钠
C
B
5.在实验室制备氢气可以用( )
A.炭粒跟水起反应
B.铁屑跟盐酸起反应
C.锌粒跟硝酸起反应
D.氧化锌跟盐酸起反应
B
6.已知氢氧化锂(LiOH)可溶于水,其化学性质与氢氧化钠相似。下列对氢氧化锂的化学性质的说法中错误的是( )
A.能与二氧化碳反应
B.能使无色酚酞溶液变红
C.能与稀硫酸反应
D.能使紫色石蕊溶液变红
D
教学课件
化学 九年级下册 科粤版
第八章 常见的酸、碱、盐
8.2 常见的酸和碱
常见的酸
常见的碱
内容提要
1
3
稀酸的化学性质
2
碱溶液的化学性质
4
学习目标
1.知道常见的酸,掌握硫酸、盐酸、硝酸的物理性质及用途,了解浓硫酸的特性与稀释方法;
2.掌握稀酸的化学通性;
3.知道常见的碱,掌握氢氧化钠、氢氧化钙、氢氧化钾的物理性质和用途;
4.掌握碱溶液的化学通性。
一、常见的酸
盐酸、硫酸、硝酸都是常见的重要的酸
硫酸、盐酸、硝酸的物理性质及用途
酸 化学式 物理性质 主要用途
硫酸
盐酸
硝酸
H2SO4
HCl
HNO3
无色、易挥发,有刺激性气味
电镀、食品、化工生产
无色油状液体、不易挥发,强腐蚀性,密度较大
车用电池、化肥、农药、精炼石油
无色液体、易挥发,强腐蚀性,有特殊刺激性气味
生产化肥、燃料、炸药
操作 现象
用玻璃棒蘸浓硫酸在纸上写字
在表面皿里的肉皮上滴些浓硫酸
烧杯内的蔗糖润湿后滴10ml浓硫酸
观察活动一:浓硫酸的脱水性
蔗糖迅速变黑、膨胀、有刺激性气味的气体放出
接触到浓硫酸的纸张先变黄后变黑
肉皮腐烂,颜色变为鲜红色
浓硫酸有强腐蚀性
实验表明:浓硫酸很快使蔗糖、纸张等脱水,变成碳,可见它有强脱水性。
浓硫酸是危险品,保管和使用都要格外小心。
——可做干燥剂
浓硫酸有强吸水性
浓硫酸对衣物、皮肤等有强腐蚀性。
如果不慎沾上硫酸,应立即用布抹去,再用大量水冲洗。
浓硫酸稀释方法:
把浓硫酸缓缓注入盛有水的烧杯中,用玻璃棒引流(或沿着烧杯壁缓缓倾倒)并不断搅拌。
切记:不可将水倒进浓硫酸里
稀释浓硫酸时为什么不能将水倒进浓硫酸里而是要将浓硫酸沿着器壁慢慢注入水中,而且还不断搅拌?
水的密度较浓硫酸小,当水滴入浓硫酸溶解时会产生大量热使水立即沸腾,带着硫酸液滴向四周飞溅,十分危险!
而将密度大的浓硫酸缓慢地注入水中,及时搅拌,使产生的热得以迅速扩散,操作安全!
实验内容 现象 化学方程式 酸的化学相似性
将镁、锌、铁铝分别与稀盐酸反应
实验活动一:酸与较活泼金属反应
有气泡产生,反应速率:镁>铝>锌>铁
二、稀酸的化学性质
较活泼
金属
+
酸
↓
盐
+
氢气
①Zn + 2HCl === ZnCl2 + H2↑
②Mg + 2HCl === MgCl2 + H2↑
③2Al + 6HCl === 2AlCl3 + 3H2↑
④Fe + 2HCl === FeCl2 + H2↑
注:由金属离子和酸根离子组成的化合物统称为盐
实验内容 现象 化学方程式 酸的化学相似性
向试管中生满铁锈的铁钉滴加稀硫酸
实验活动二:酸与金属氧化物反应
金属氧化物
+
酸
↓
盐
+
氢气
Fe2O3+3H2SO4 == Fe2(SO4)3 + 3H2O
铁锈溶解,溶液变黄
实验内容 现象 化学方程式 酸的化学相似性
将稀盐酸滴入硝酸银溶液中
实验活动三:酸与盐反应
盐
+
酸
↓
新盐
+
新酸
AgNO3+HCl == AgCl ↓ + HNO3
有白色沉淀生成
注:硝酸银呈白色沉淀,且不溶于稀硝酸,是检验氯离子的试剂。
稀盐酸、稀硫酸溶液中都含有大量的氢离子(H+),所以酸溶液具有相似的化学性质。
注:硝酸的性质比较特殊,它与较活泼金属反应时,一般不产生氢气,而是生成氮氧化物等,故无此通性。
三、常见的碱
氢氧化钙、氢氧化钠、氢氧化钾是常见的碱
氢氧化钠
氢氧化钙
氢氧化钾
氢氧化钙、氢氧化钠、氢氧化钾的俗称及用途:
名称 化学式 俗称 用途
氢氧化钙
氢氧化钠
氢氧化钾
熟石灰或消石灰
烧碱、火碱或苛性钠
苛性钾
Ca(OH)2
NaOH
KOH
建筑材料、漂白剂、处理污水、改良酸性土壤
制肥皂、洗涤剂、造纸、纺织工业、炼制石油
电池工业
CaO + H2O == Ca(OH)2
石灰吟 于谦
千锤万凿出深山,
烈火焚烧若等闲。
粉身碎骨全不怕,
要留清白在人间。
CaCO3 === CaO + CO2↑
高温
NaOH溶液和石灰水都能吸收二氧化碳气体,固体氢氧化钠在空气中不但易吸收水蒸气而潮解,还能吸收二氧化碳气体而变质。
注:氢氧化钠有强烈的腐蚀性,使用时要十分小心,特别注意防止它对眼睛的伤害。如果不慎沾到氢氧化钠,应立即用水冲洗。
实验内容 现象 化学方程式 碱的化学相似性
两支充满CO2的试管,一支插入水中,一支插入氢氧化钠溶液中
实验活动一:碱与非金属氧化物反应
试管液面上升,第一支试管液面比第二支低
非金属氧化物+
碱
↓
盐
+
水
①H2O + CO2 == H2CO3
②2NaOH+CO2=Na2CO3+H2O
四、碱溶液的化学性质
实验内容 现象 化学方程式 碱的化学相似性
用澄清石灰水分别与硫酸铜溶液和氯化铁溶液反应
实验活动二:碱与盐反应
①蓝色退去,生成蓝色沉淀
②黄色退去,生成红褐色沉淀
盐
+
碱
↓
新盐
+
新碱
①Ca(OH)2+CuSO4 ==
Cu(OH)2↓+CaSO4
②2FeCl3 +3Ca(OH)2 ==
2Fe(OH)3↓ +3CaCl2
氢氧化钠、氢氧化钙、氢氧化钾在水溶液中都能产生氢氧根离子(OH-),这使碱溶液具有相似的化学性质。
知识点1:常见的酸
1.下列物质质量置于空气中,一段时间后,质量减小的是( )
A.碳酸钙 B.氯化钠
C.浓盐酸 D.氢氧化钠
经典例题
C
知识点2:稀酸的化学性质
1.盐酸或稀硫酸常用作金属表面的清洁剂是利用了它们化学性质中的( )
A.能与碱反应
B.能与金属反应
C.能与某些金属氧化物反应
D.能与紫色石蕊试液反应
C
知识点3:常见的碱
1.下列有关Ca(OH)2的说法,错误的是( )
A.俗称熟石灰或消石灰
B.可用于治疗胃酸过多症
C.可用于改良酸性土壤
D.可用于处理硫酸厂排出的酸性废水
B
知识点4:碱溶液的化学性质
1.下面是某同学进行碱的化学性质实验时记录的实验现象,其中与事实不相符的是( )
A.在Ca(OH)2溶液中加入稀盐酸,无明显变化
B.在NaOH溶液中通入CO2气体,有白色沉淀生成
C.在Ca(OH)2溶液中加入几滴石蕊溶液,溶液呈蓝色
D.在NaOH溶液中加入CuSO4溶液,有蓝色沉淀生成
B
1.酸具有酸的通性的原因是( )
A.酸都能电离出H+ B.酸都含有酸根
C.酸中都含有氢元素 D.酸中都含有氧元素
2.下列物质长时间暴露在空气中,会变质的是( )
A.CaCO3 B.浓盐酸
C.浓硫酸 D.烧碱
知能训练
A
D
3.一定量的空气依次通过足量石灰水及浓硫酸,分别被除去的是( )
A.氮气和氧气 B.氮气、氧气和稀有气体
C.二氧化碳和水蒸气 D.二氧化碳和氮气
4.下列物质中有一种与其他三种物质都能发生反应的是( )
A.铁 B.稀盐酸
C.碳酸钙 D.氢氧化钠
C
B
5.在实验室制备氢气可以用( )
A.炭粒跟水起反应
B.铁屑跟盐酸起反应
C.锌粒跟硝酸起反应
D.氧化锌跟盐酸起反应
B
6.已知氢氧化锂(LiOH)可溶于水,其化学性质与氢氧化钠相似。下列对氢氧化锂的化学性质的说法中错误的是( )
A.能与二氧化碳反应
B.能使无色酚酞溶液变红
C.能与稀硫酸反应
D.能使紫色石蕊溶液变红
D
