高中化学人教化学必修2第1章物质结构 元素周期律复习课件(共24张PPT)
文档属性
| 名称 | 高中化学人教化学必修2第1章物质结构 元素周期律复习课件(共24张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 1.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-02-22 18:54:02 | ||
图片预览








文档简介
(共24张PPT)
第一章
物质结构 元素周期律
1. 136C-NMR(核磁共振)可以用含碳化合物的结构分析,有关136C的说法正确的是( )
A.核外有13个电子,其中最外层有4个电子
B.核内有6个质子,核外有7个电子
C.质量数为13,核电荷数为6,核内有7个质子
D.质量数为13,核电荷数为6,核外有7个中子
D
2、X、Y、Z和R分别代表四种元素.如果aXm+、bYn+、
cZn-、dRm-四种离子的电子层结构相同(a、b、c、d为
元素的原子序数),则下列关系正确的是( )
A.a-c=m-n B.a-b=n-m
C.c-d=m+n D.b-d=n+m
D
知识结构
一、元素:
二、原子的构成:
具有相同核电荷数(即核内质子数)的一类原子的总称。
原子核
核外电子
{
质子
中子
原子序数=核电荷数=质子数=核外电子数
元素种类
原子(核素)种类
元素的化学性质
质量数(A)=质子数(Z)+中子数(N)
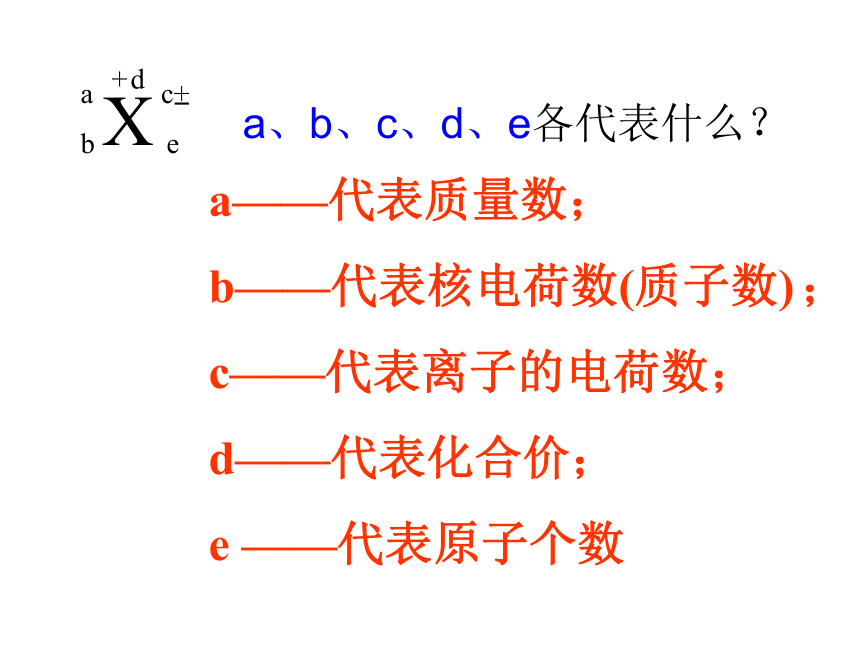
-表示核电荷数(质子数)为Z,质 量数为A的一个X原子
a——代表质量数;
b——代表核电荷数(质子数) ;
c——代表离子的电荷数;
d——代表化合价;
e ——代表原子个数
a、b、c、d、e各代表什么?
*核素:把具有一定数目的质子和一定数目的中子的一种原子叫做核素。
*同位素:质子数相同而中子数不同的同一种元素的不同原子互称为同位素。(同一种元素的不同核素互称为同位素)
如:1H、2H、3H;12C、14C
*质量数:忽略电子的质量,将核内所有质子和中子的相对质量取近似值加起来,该数值即为质量数。
质量数(A)= 质子数(Z)+ 中子数(N)
三、核外电子的排布规律及表示方法
1、核外电子总是尽先排布在能量最低的电子层里,然后由里往外,依次排布在能量较高的电子层里(这就是能量最低原理)。
2、各电子层最多能容纳的电子数为 2n2
3、最外层电子数不能超过 8(当K层为最外层时不能超过 2 )。
4、次外层电子数不能超过 18 ,倒数第三层电子数不能超过 32 。
注意:以上四条规律是相互联系的,不能孤
立地理解。
熟练掌握1-20号元素的原子结构示意图、化学符号
电子层的代号 n
各
电
子
层
序号 1 2 3 4 5 6 7
K L M N O P Q
与原子核的距离 从近到远
能量 从低到高
几个关系式
1.质量数(A)=质子数(Z)+中子数(N)
2.原子
原子序数=核电荷数=质子数=核外电子数
3. 阳离子 :
核外电子数=
4. 阴离子 :
核外电子数=
质子数 + 电荷数
质子数—电荷数
周期
短周期
长周期
第1周期:2 种元素
第2周期:8 种元素
第3周期:8 种元素
第4周期:18 种元素
第5周期:18 种元素
第6周期:32 种元素
不完全周期
第7周期:26种元素(32)
15 种元素称镧系元素
15 种元素称锕系元素
周期数 = 电子层数
三短三长一不全
族
主族:
副族:
ⅠA , ⅡA (1、2列)
ⅢA , ⅣA ,ⅤA , ⅥA , ⅦA(13—17列)
第VIII族:
稀有气体元素(第18列)
Groups
零族:
共七个主族
ⅠB , ⅡB(11、12列)
ⅢB , ⅣB ,ⅤB , ⅥB , ⅦB (3—7列)
共七个副族
三个纵行,(8、9、10三列)
主族序数=最外层电子数=最高正化合价
例:硫元素位置:
第三周期, ⅥA族
一主二主三七副,VIII族三列紧排布,
一副二副三七主,最后一列是零族。
过渡元素:3---12列(共10列,包括所有副族和 VIII族),全部为金属元素
2、元素周期律
元素的性质随着原子序数的递增而呈周期性变化的规律叫做元素周期律。
(1)同周期元素随原子序数递增,核外电子排布 呈周期性变化;
(2)同周期元素随原子序数递增,原子半径减小;
原因:同周期元素电子层数相同,从左到右,核电荷数(原子序数)越大,核对电子吸引力越强,则原子半径越小。
(3)同周期元素随原子序数递增,主要化合价呈周期性变化;
最高正价:+1~+7 最低负价:由-4~-1
3、元素性质呈周期性变化的根本原因是元素原子的核外电子排列呈周期性变化
4、同周期、同主族元素结构、性质的递变规律及金属元素、非金属元素的分区:
分界线左边是金属元素,分界线右边是非金属元素,最右一个纵行是稀有气体元素。见下图:
金属性、非金属性是元素的性质
注意:
得电子能力和失电子能力判断依据
失电子能力强弱的判断依据:
单质跟水或酸起反应置换出氢的难易;
最高价氧化物的水化物——氢氧化物的碱性强弱。
得电子能力强弱的判断依据:
最高价氧化物的水化物的酸性强弱;
单质与氢气生成氢化物的难易或生成氢化物的稳定性。
“越易越强、越强越强”
3)金属单质之间的置换。4)金属阳离子的氧化性。
3)非金属单质之间的置换. 4)非金属阴离子的还原性
1
B
Al
Si
Ge
As
Sb
Te
2
3
4
5
6
7
ⅠA
ⅡA
ⅢA
ⅣA
ⅤA
ⅥA
ⅦA
0
Po
At
非金属性逐渐增强
金属性逐渐增强
金属性逐渐增强
非金属性逐渐增强
非金属区
金属区
零
族
元
素
元素周期表和元素周期律的应用
1.元素的金属性和非金属性与元素在周期表中位置的关系
元素金属性和非金属性的递变
(1)同一周期从左到右元素的金属性逐渐 ,非金属性逐渐 (不包括稀有气体元素)。
(2)同一主族从上到下元素的金属性逐渐 ,非金属性逐渐 (不包括稀有气体元素)。
2.元素化合价与元素在周期表中位置的关系。?
(2)主族序数= =主族元素最高 数
(3)|最高正价|+|最低负价|=
(4)特殊:氧元素的化合价一般是 价,而氟元素 正化合价。 元素只有正化合价而无负价。
减弱
减弱
增强
增强
最外层电子数
正化合价
8
-2
无
金属
最高正价常可写成氧化物,最低负价常写成氢化物。
微粒半径的大小比较
(2)层数相同时,核电荷数越大,半径越小;
(例如:Na>Mg、Na+>Mg2+)
(3)核电荷数相同时,电子数越多,半径越大;
(例如:Cl(1)电子层数越多,半径越大(例如:Na先层,再核,后电子
在同一周期中,各元素原子的核外电子层数 ,但从左到右核电荷数依次 ,原子核对外层电子引力依次 ,原子半径逐渐 (稀有气体元素除外),原子失电子能力逐渐 ,得电子能力逐渐 。
小结:
相同
增大
增强
减小
减弱
增强
2、已知X、Y、Z三种元素原子的电子层数相同,且原子序数XA、原子半径XB、得电子能力X、Y、Z逐渐减弱
C、最高价含氧酸酸性H3XO4D、气态氢化物的稳定性按照X、Y、Z顺序减弱
C
E、气态氢化物的还原性按照X、Y、Z顺序增强
同主族规律
同主族元素原子的 相同。(相似性)
从上到下,随原子序数递增,电子层数增多,原子半径逐渐 ,原子核对外层电子的吸引能力逐渐 ,原子的失电子能力逐渐 ,得电子能力逐渐 ;元素单质的还原性逐渐 ,氧化性逐渐 ;最高价氧化物对应水化物的碱性 ,酸性 ;气态氢化物的稳定性 。(递变性)
最外层电子数
减弱
减弱
减弱
增强
增强
增强
减弱
增大
减弱
同主族元素从上向下金属性越来越强,非金属性越来越弱
例题下表是周期表中的一部分,根据A—I在周期表中的位置,用元素符号或化学式回答下列问题:
(1)表中元素,化学性质最不活泼的是 ,只有负价而无正价的是 ,氧化性最强的单质是 ,还原性最强的单质是 ;
(2)最高价氧化物的水化物碱性最强的是 ,酸性最强的
是 , 呈两性的是 ;
(3)A分别与D、E、F、G、H形成的化合物中,最稳定的 ;
(4)在B、C、D、E、F、G、H中,原子半径最大的是 .
(5)A和E形成化合物的化学式 。
Ne
F
F2
Na
NaOH
HClO4
Al(OH)3
HF
Na
NH3
ⅠA ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA 0
1 A
2 D E G I
3 B C F H
二、下表中的实线是元素周期表的部分边界,请在表中用实线补全元素周期表的边界。
2
10
18
36
54
86
118
下表是元素周期表的一部分,数字
是该元素的原子序数,请填出其下一周期元素的原子序数:
19
35
11 17
……
…….
不查元素周期表,根据所学知识推断原子序数为56的元素在周期表中处于
( )
A.第五周期第VIA B.第五周期第ⅡA
C.第六周期第IA D.第六周期第ⅡA
已知短周期元素的离子aA2+、bB+、cC3-、dD-都具有相同的电子层结构.则下列叙述正确的是( )
A.原子半径 A>B>D>C
B.原子序数 d>c>b>a
C.离子半径 C>D>B>A
D.原子结构的最外层电子数目 A>B>D>C
D
C
第一章
物质结构 元素周期律
1. 136C-NMR(核磁共振)可以用含碳化合物的结构分析,有关136C的说法正确的是( )
A.核外有13个电子,其中最外层有4个电子
B.核内有6个质子,核外有7个电子
C.质量数为13,核电荷数为6,核内有7个质子
D.质量数为13,核电荷数为6,核外有7个中子
D
2、X、Y、Z和R分别代表四种元素.如果aXm+、bYn+、
cZn-、dRm-四种离子的电子层结构相同(a、b、c、d为
元素的原子序数),则下列关系正确的是( )
A.a-c=m-n B.a-b=n-m
C.c-d=m+n D.b-d=n+m
D
知识结构
一、元素:
二、原子的构成:
具有相同核电荷数(即核内质子数)的一类原子的总称。
原子核
核外电子
{
质子
中子
原子序数=核电荷数=质子数=核外电子数
元素种类
原子(核素)种类
元素的化学性质
质量数(A)=质子数(Z)+中子数(N)
-表示核电荷数(质子数)为Z,质 量数为A的一个X原子
a——代表质量数;
b——代表核电荷数(质子数) ;
c——代表离子的电荷数;
d——代表化合价;
e ——代表原子个数
a、b、c、d、e各代表什么?
*核素:把具有一定数目的质子和一定数目的中子的一种原子叫做核素。
*同位素:质子数相同而中子数不同的同一种元素的不同原子互称为同位素。(同一种元素的不同核素互称为同位素)
如:1H、2H、3H;12C、14C
*质量数:忽略电子的质量,将核内所有质子和中子的相对质量取近似值加起来,该数值即为质量数。
质量数(A)= 质子数(Z)+ 中子数(N)
三、核外电子的排布规律及表示方法
1、核外电子总是尽先排布在能量最低的电子层里,然后由里往外,依次排布在能量较高的电子层里(这就是能量最低原理)。
2、各电子层最多能容纳的电子数为 2n2
3、最外层电子数不能超过 8(当K层为最外层时不能超过 2 )。
4、次外层电子数不能超过 18 ,倒数第三层电子数不能超过 32 。
注意:以上四条规律是相互联系的,不能孤
立地理解。
熟练掌握1-20号元素的原子结构示意图、化学符号
电子层的代号 n
各
电
子
层
序号 1 2 3 4 5 6 7
K L M N O P Q
与原子核的距离 从近到远
能量 从低到高
几个关系式
1.质量数(A)=质子数(Z)+中子数(N)
2.原子
原子序数=核电荷数=质子数=核外电子数
3. 阳离子 :
核外电子数=
4. 阴离子 :
核外电子数=
质子数 + 电荷数
质子数—电荷数
周期
短周期
长周期
第1周期:2 种元素
第2周期:8 种元素
第3周期:8 种元素
第4周期:18 种元素
第5周期:18 种元素
第6周期:32 种元素
不完全周期
第7周期:26种元素(32)
15 种元素称镧系元素
15 种元素称锕系元素
周期数 = 电子层数
三短三长一不全
族
主族:
副族:
ⅠA , ⅡA (1、2列)
ⅢA , ⅣA ,ⅤA , ⅥA , ⅦA(13—17列)
第VIII族:
稀有气体元素(第18列)
Groups
零族:
共七个主族
ⅠB , ⅡB(11、12列)
ⅢB , ⅣB ,ⅤB , ⅥB , ⅦB (3—7列)
共七个副族
三个纵行,(8、9、10三列)
主族序数=最外层电子数=最高正化合价
例:硫元素位置:
第三周期, ⅥA族
一主二主三七副,VIII族三列紧排布,
一副二副三七主,最后一列是零族。
过渡元素:3---12列(共10列,包括所有副族和 VIII族),全部为金属元素
2、元素周期律
元素的性质随着原子序数的递增而呈周期性变化的规律叫做元素周期律。
(1)同周期元素随原子序数递增,核外电子排布 呈周期性变化;
(2)同周期元素随原子序数递增,原子半径减小;
原因:同周期元素电子层数相同,从左到右,核电荷数(原子序数)越大,核对电子吸引力越强,则原子半径越小。
(3)同周期元素随原子序数递增,主要化合价呈周期性变化;
最高正价:+1~+7 最低负价:由-4~-1
3、元素性质呈周期性变化的根本原因是元素原子的核外电子排列呈周期性变化
4、同周期、同主族元素结构、性质的递变规律及金属元素、非金属元素的分区:
分界线左边是金属元素,分界线右边是非金属元素,最右一个纵行是稀有气体元素。见下图:
金属性、非金属性是元素的性质
注意:
得电子能力和失电子能力判断依据
失电子能力强弱的判断依据:
单质跟水或酸起反应置换出氢的难易;
最高价氧化物的水化物——氢氧化物的碱性强弱。
得电子能力强弱的判断依据:
最高价氧化物的水化物的酸性强弱;
单质与氢气生成氢化物的难易或生成氢化物的稳定性。
“越易越强、越强越强”
3)金属单质之间的置换。4)金属阳离子的氧化性。
3)非金属单质之间的置换. 4)非金属阴离子的还原性
1
B
Al
Si
Ge
As
Sb
Te
2
3
4
5
6
7
ⅠA
ⅡA
ⅢA
ⅣA
ⅤA
ⅥA
ⅦA
0
Po
At
非金属性逐渐增强
金属性逐渐增强
金属性逐渐增强
非金属性逐渐增强
非金属区
金属区
零
族
元
素
元素周期表和元素周期律的应用
1.元素的金属性和非金属性与元素在周期表中位置的关系
元素金属性和非金属性的递变
(1)同一周期从左到右元素的金属性逐渐 ,非金属性逐渐 (不包括稀有气体元素)。
(2)同一主族从上到下元素的金属性逐渐 ,非金属性逐渐 (不包括稀有气体元素)。
2.元素化合价与元素在周期表中位置的关系。?
(2)主族序数= =主族元素最高 数
(3)|最高正价|+|最低负价|=
(4)特殊:氧元素的化合价一般是 价,而氟元素 正化合价。 元素只有正化合价而无负价。
减弱
减弱
增强
增强
最外层电子数
正化合价
8
-2
无
金属
最高正价常可写成氧化物,最低负价常写成氢化物。
微粒半径的大小比较
(2)层数相同时,核电荷数越大,半径越小;
(例如:Na>Mg、Na+>Mg2+)
(3)核电荷数相同时,电子数越多,半径越大;
(例如:Cl
在同一周期中,各元素原子的核外电子层数 ,但从左到右核电荷数依次 ,原子核对外层电子引力依次 ,原子半径逐渐 (稀有气体元素除外),原子失电子能力逐渐 ,得电子能力逐渐 。
小结:
相同
增大
增强
减小
减弱
增强
2、已知X、Y、Z三种元素原子的电子层数相同,且原子序数X
C、最高价含氧酸酸性H3XO4
C
E、气态氢化物的还原性按照X、Y、Z顺序增强
同主族规律
同主族元素原子的 相同。(相似性)
从上到下,随原子序数递增,电子层数增多,原子半径逐渐 ,原子核对外层电子的吸引能力逐渐 ,原子的失电子能力逐渐 ,得电子能力逐渐 ;元素单质的还原性逐渐 ,氧化性逐渐 ;最高价氧化物对应水化物的碱性 ,酸性 ;气态氢化物的稳定性 。(递变性)
最外层电子数
减弱
减弱
减弱
增强
增强
增强
减弱
增大
减弱
同主族元素从上向下金属性越来越强,非金属性越来越弱
例题下表是周期表中的一部分,根据A—I在周期表中的位置,用元素符号或化学式回答下列问题:
(1)表中元素,化学性质最不活泼的是 ,只有负价而无正价的是 ,氧化性最强的单质是 ,还原性最强的单质是 ;
(2)最高价氧化物的水化物碱性最强的是 ,酸性最强的
是 , 呈两性的是 ;
(3)A分别与D、E、F、G、H形成的化合物中,最稳定的 ;
(4)在B、C、D、E、F、G、H中,原子半径最大的是 .
(5)A和E形成化合物的化学式 。
Ne
F
F2
Na
NaOH
HClO4
Al(OH)3
HF
Na
NH3
ⅠA ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA 0
1 A
2 D E G I
3 B C F H
二、下表中的实线是元素周期表的部分边界,请在表中用实线补全元素周期表的边界。
2
10
18
36
54
86
118
下表是元素周期表的一部分,数字
是该元素的原子序数,请填出其下一周期元素的原子序数:
19
35
11 17
……
…….
不查元素周期表,根据所学知识推断原子序数为56的元素在周期表中处于
( )
A.第五周期第VIA B.第五周期第ⅡA
C.第六周期第IA D.第六周期第ⅡA
已知短周期元素的离子aA2+、bB+、cC3-、dD-都具有相同的电子层结构.则下列叙述正确的是( )
A.原子半径 A>B>D>C
B.原子序数 d>c>b>a
C.离子半径 C>D>B>A
D.原子结构的最外层电子数目 A>B>D>C
D
C
