(人教版)高一化学必修2第一章第三节化学键课件(共28张PPT)
文档属性
| 名称 | (人教版)高一化学必修2第一章第三节化学键课件(共28张PPT) |
|
|
| 格式 | zip | ||
| 文件大小 | 516.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-02-22 00:00:00 | ||
图片预览






文档简介
(共28张PPT)
第一章 物质结构 元素周期律
第三节化学键
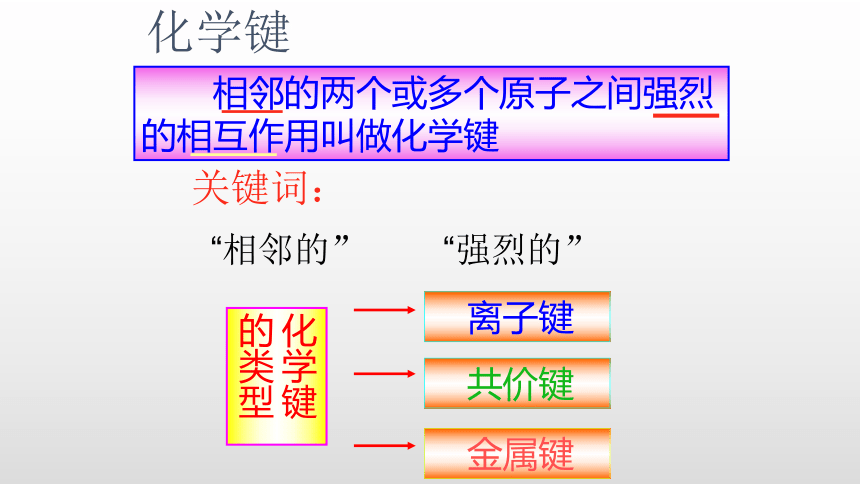
关键词:
“相邻的”
“强烈的”
相邻的两个或多个原子之间强烈的相互作用叫做化学键
化学键的类型
离子键
共价键
金属键
化学键
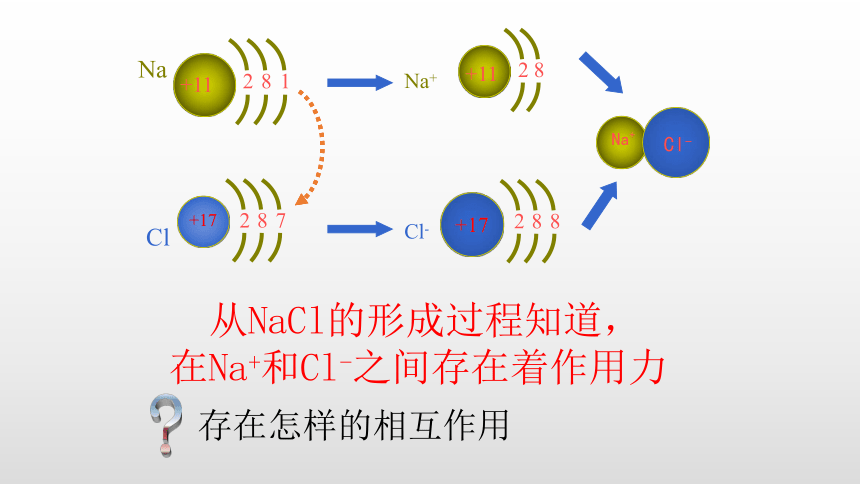
Na
+11
8
1
2
Cl
+17
8
7
2
Na+
Cl-
+11
8
2
+17
8
8
2
Na+
Cl-
从NaCl的形成过程知道,
在Na+和Cl-之间存在着作用力
?
存在怎样的相互作用
Na和Cl发生反应,Na失去了一个电子,Cl就得到这个电子,双方都达到了8电子的稳定结构,形成了带正电荷的Na+ 和带负电荷的Cl-,Na+和Cl-之间有静电相互吸引作用;同时电子和电子之间、原子核和原子核之间有相互排斥作用。当两种离子接近到某一距离时,吸引作用和排斥作用达到平衡,于是,阴、阳离子之间就形成了稳定的化合物。
一、离子键
离子键:
阴、阳离子间通过静电作用形成的化学键
③核外电子与核外电子间的排斥作用。
(1)静电作用
①带正电的离子与带负电的离子间的吸引作用;
②原子核与原子核间的排斥作用;
⑵成键的主要原因:
⑶成键微粒:
⑷键的本质:
⑸ 成键元素:
电子得失
阴阳离子
静电作用
活泼的金属元素与活泼的非金属元素
(6)哪些物质能形成离子键?
1.活泼的金属元素(IA,IIA)和活泼的非金属
元素(VIA,VIIA)之间的化合物。
2.活泼的金属元素和酸根离子形成的盐
3.铵根离子和酸根离子(或活泼非金属元素)形成的盐。
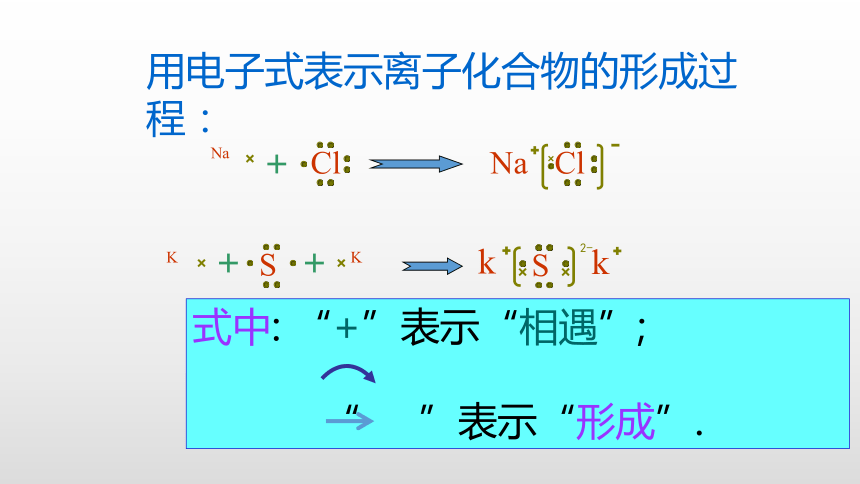
式中: “+”表示“相遇”;
“ ”表示“形成”.
用电子式表示离子化合物的形成过程:
Cl
Na
Cl
Na
S
K
K
化 学 键
k
S
2-
k
用电子式表示粒子及离子化合物的形成过程时,
注意
①阳离子须标明电荷数,阴离子要用方括号括起来,并标明电荷数如:Al、
②相同的原子、离子要单个写.
③不能把“ ”写成“ ”.
3+
S
2-
小结
阴离子
阳离子
离子化合物
活泼金属原子
活泼非金属原子
失去电子
得到电子
静电作用 静电吸引=静电排斥
离 子 键
离子键:使阴、阳离子结合成化合物的静电作用.
共价键的形成
[讨论]
氢气与氯气是如何形成氯化氢的?原子与原子是如何结合形成共价化合物的呢?
Cl2 气体分子
H2 气体分子
分开后,她们为什么不高兴?让我们听听她们说些什么?
我只有一个电子,太少了
我也少一个电子
e
H 原子
Cl 原子
二位好!我有一个好办法.你们每人拿出一个电子共用,就象共同分享快乐一样共同拥有.行吗?
e
好
呵
谢
谢
好
呵
谢
谢
愿意
愿意
电子
电子
H原子,你愿意拿出一个电子共用吗?
Cl原子,你愿意拿出一个电子共用吗?
我给你们点燃之后,你们要结合在一起,为人类做出自己的贡献.
我们的接合使人类的生活多了一点味道
我们的接合使人类的工厂有了活力
H2+Cl2===2HCl
点燃
共价键
原子之间通过共用电子对所形成的相互作用,叫做共价键。
⑵成键的主要原因:
⑶成键微粒:
⑷键的本质:
⑸ 成键元素:
⑹存在物质:
成键原子的原子核共同吸引共用电子对。
原子
静电作用
非金属元素与非金属元素
多数非金属单质,气态氢化物,酸分子,酸酐分子,某些离子化合物中,大多数有机物里都有共价键。
共用电子对
共用电子对
共用电子对
共用电子对
共价化合物的形成过程(或单质)
H + O + H → H O H
×
×
×
×
注意事项:1、相同原子不能合并在一起;
2、没有形成离子
HCl
H2O
F2
×
H
Cl
+
→
×
H Cl
F
+
→
F
F
F
共用电子对
共用电子对
结构式:
H-H Cl-Cl H-Cl H-O-H
说明:
1)共价键可形成单质;可形成共价化合物;
2)共价化合物只含有共价键,不含离子键;
H
?
?
H
共用电子对无偏向
共用电子对偏向Cl
不显电性
相对显正电性
相对显负电性
H
Cl
? ?
? ?
? ?
? ?
1、非极性键和极性键
非极性键:
共用电子对无偏向(电荷分布均匀)
如:H2(H-H)
Cl2(Cl-Cl)
N2(N N)
极性键
共用电子对有偏向(电荷分布不均匀)
如:HCl(H-Cl) H2O(H-O-H)
共价键的类型
2、配位键
由一个原子单独提供一对电子为两个原子共用而形成的共价键,称为为配位键
再见
谢谢!
第一章 物质结构 元素周期律
第三节化学键
关键词:
“相邻的”
“强烈的”
相邻的两个或多个原子之间强烈的相互作用叫做化学键
化学键的类型
离子键
共价键
金属键
化学键
Na
+11
8
1
2
Cl
+17
8
7
2
Na+
Cl-
+11
8
2
+17
8
8
2
Na+
Cl-
从NaCl的形成过程知道,
在Na+和Cl-之间存在着作用力
?
存在怎样的相互作用
Na和Cl发生反应,Na失去了一个电子,Cl就得到这个电子,双方都达到了8电子的稳定结构,形成了带正电荷的Na+ 和带负电荷的Cl-,Na+和Cl-之间有静电相互吸引作用;同时电子和电子之间、原子核和原子核之间有相互排斥作用。当两种离子接近到某一距离时,吸引作用和排斥作用达到平衡,于是,阴、阳离子之间就形成了稳定的化合物。
一、离子键
离子键:
阴、阳离子间通过静电作用形成的化学键
③核外电子与核外电子间的排斥作用。
(1)静电作用
①带正电的离子与带负电的离子间的吸引作用;
②原子核与原子核间的排斥作用;
⑵成键的主要原因:
⑶成键微粒:
⑷键的本质:
⑸ 成键元素:
电子得失
阴阳离子
静电作用
活泼的金属元素与活泼的非金属元素
(6)哪些物质能形成离子键?
1.活泼的金属元素(IA,IIA)和活泼的非金属
元素(VIA,VIIA)之间的化合物。
2.活泼的金属元素和酸根离子形成的盐
3.铵根离子和酸根离子(或活泼非金属元素)形成的盐。
式中: “+”表示“相遇”;
“ ”表示“形成”.
用电子式表示离子化合物的形成过程:
Cl
Na
Cl
Na
S
K
K
化 学 键
k
S
2-
k
用电子式表示粒子及离子化合物的形成过程时,
注意
①阳离子须标明电荷数,阴离子要用方括号括起来,并标明电荷数如:Al、
②相同的原子、离子要单个写.
③不能把“ ”写成“ ”.
3+
S
2-
小结
阴离子
阳离子
离子化合物
活泼金属原子
活泼非金属原子
失去电子
得到电子
静电作用 静电吸引=静电排斥
离 子 键
离子键:使阴、阳离子结合成化合物的静电作用.
共价键的形成
[讨论]
氢气与氯气是如何形成氯化氢的?原子与原子是如何结合形成共价化合物的呢?
Cl2 气体分子
H2 气体分子
分开后,她们为什么不高兴?让我们听听她们说些什么?
我只有一个电子,太少了
我也少一个电子
e
H 原子
Cl 原子
二位好!我有一个好办法.你们每人拿出一个电子共用,就象共同分享快乐一样共同拥有.行吗?
e
好
呵
谢
谢
好
呵
谢
谢
愿意
愿意
电子
电子
H原子,你愿意拿出一个电子共用吗?
Cl原子,你愿意拿出一个电子共用吗?
我给你们点燃之后,你们要结合在一起,为人类做出自己的贡献.
我们的接合使人类的生活多了一点味道
我们的接合使人类的工厂有了活力
H2+Cl2===2HCl
点燃
共价键
原子之间通过共用电子对所形成的相互作用,叫做共价键。
⑵成键的主要原因:
⑶成键微粒:
⑷键的本质:
⑸ 成键元素:
⑹存在物质:
成键原子的原子核共同吸引共用电子对。
原子
静电作用
非金属元素与非金属元素
多数非金属单质,气态氢化物,酸分子,酸酐分子,某些离子化合物中,大多数有机物里都有共价键。
共用电子对
共用电子对
共用电子对
共用电子对
共价化合物的形成过程(或单质)
H + O + H → H O H
×
×
×
×
注意事项:1、相同原子不能合并在一起;
2、没有形成离子
HCl
H2O
F2
×
H
Cl
+
→
×
H Cl
F
+
→
F
F
F
共用电子对
共用电子对
结构式:
H-H Cl-Cl H-Cl H-O-H
说明:
1)共价键可形成单质;可形成共价化合物;
2)共价化合物只含有共价键,不含离子键;
H
?
?
H
共用电子对无偏向
共用电子对偏向Cl
不显电性
相对显正电性
相对显负电性
H
Cl
? ?
? ?
? ?
? ?
1、非极性键和极性键
非极性键:
共用电子对无偏向(电荷分布均匀)
如:H2(H-H)
Cl2(Cl-Cl)
N2(N N)
极性键
共用电子对有偏向(电荷分布不均匀)
如:HCl(H-Cl) H2O(H-O-H)
共价键的类型
2、配位键
由一个原子单独提供一对电子为两个原子共用而形成的共价键,称为为配位键
再见
谢谢!
