(人教版)高一化学必修2第一章第一节元素周期表(原子结构及核外电子的排布)课件(共34张PPT)
文档属性
| 名称 | (人教版)高一化学必修2第一章第一节元素周期表(原子结构及核外电子的排布)课件(共34张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 767.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-02-22 19:04:27 | ||
图片预览






文档简介
(共34张PPT)
第一章第一节元素周期表
--原子结构及核外电子的排布
人教版高一化学必修二
情境导入
学生发展层级:无机物核心知识、认识发展和能力表现的学习进阶
认识发展
核心知识
能力表现
基于结构和价键认知物质世界
化学键、物质结构、性质等
解释、论证、比较、预测
学段
基于反应原理认识物质世界
电化学、平衡、电离、水解等
解释、预测
基于位构性认识物质世界
元素周期律、表等
解释、比较、预测、推论
基于原子结构认识元素性质
原子序数、原子结构模型、核外电子排布、元素性质
解释
基于类别和价态认识物质性质
金属、非金属、氧化物、酸碱盐、二维图
描述、归纳、分析、预测、设计、证明
基于代表物及分类认识物质性质
混合物、纯净物、元素、单质、化合物、物理性质、化学性质、化合价
描述
情境导入
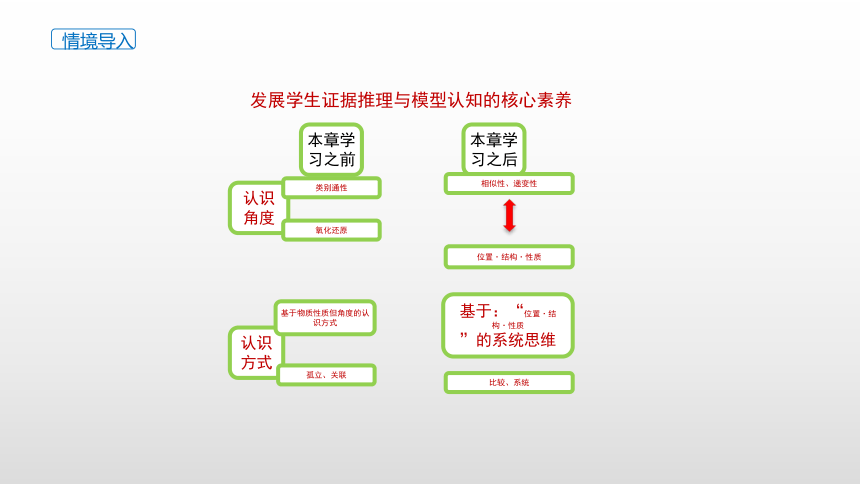
发展学生证据推理与模型认知的核心素养
认识角度
认识方式
本章学习之前
本章学习之后
类别通性
氧化还原
相似性、递变性
位置·结构·性质
基于物质性质但角度的认识方式
孤立、关联
基于:“位置·结构·性质
”的系统思维
比较、系统
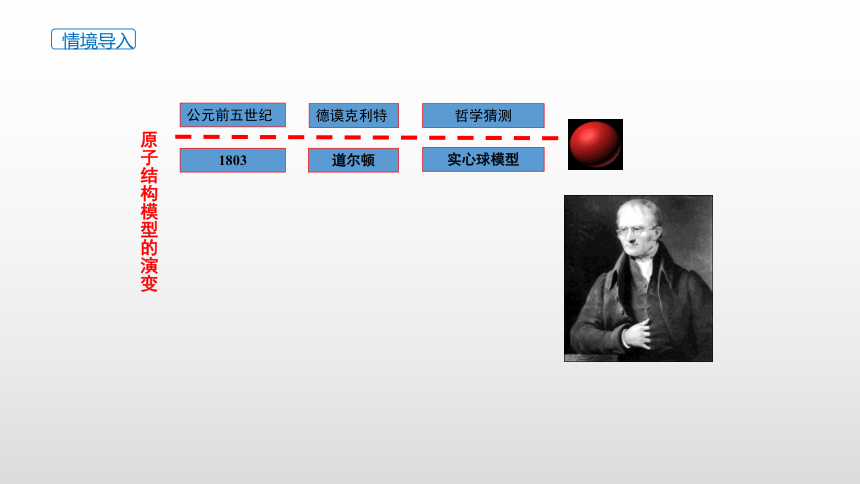
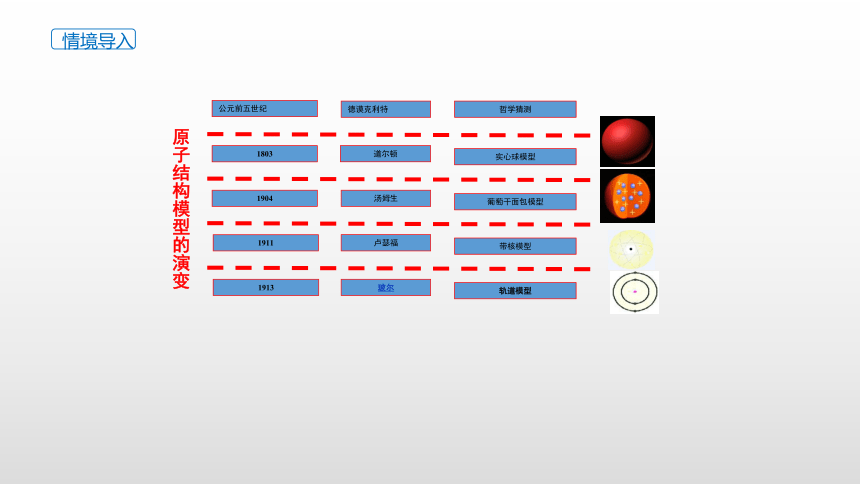
公元前五世纪
德谟克利特
哲学猜测
1803
道尔顿
实心球模型
原子结构模型的演变
情境导入
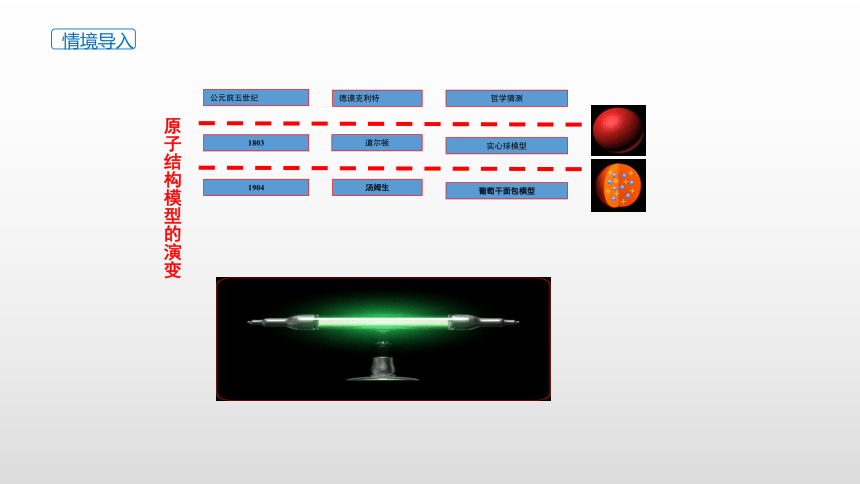
原子结构模型的演变
公元前五世纪
德谟克利特
哲学猜测
1803
道尔顿
实心球模型
葡萄干面包模型
汤姆生
1904
情境导入
原子结构模型的演变
公元前五世纪
德谟克利特
哲学猜测
1803
道尔顿
实心球模型
葡萄干面包模型
汤姆生——发现电子
1904
1911
卢瑟福
情境导入
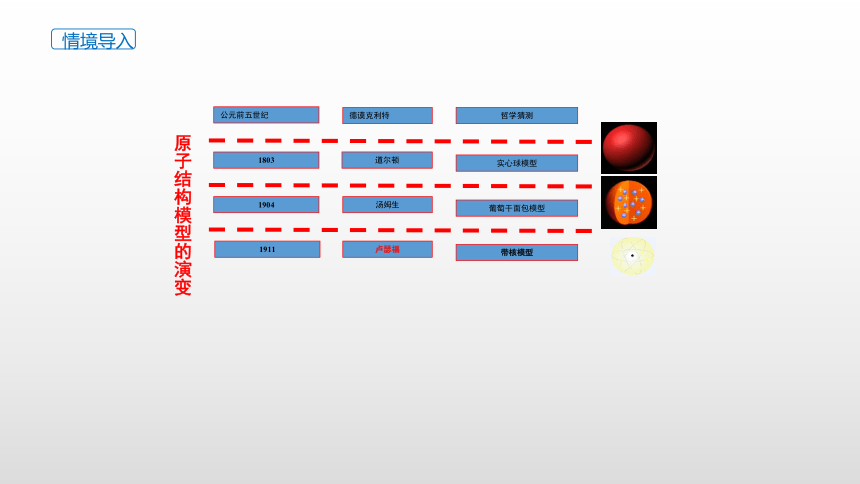
原子结构模型的演变
公元前五世纪
德谟克利特
哲学猜测
1803
道尔顿
实心球模型
葡萄干面包模型
带核模型
1911
汤姆生
卢瑟福
1904
情境导入
根据a粒子散射实验,卢瑟福提出了带核的原子结构模型,原子由原子核和电子构成,电子在核周围做高速无规则运动,就像行星围绕太阳运转一样。
情境导入
原子结构模型的演变
公元前五世纪
德谟克利特
哲学猜测
1803
道尔顿
实心球模型
葡萄干面包模型
带核模型
1911
汤姆生
卢瑟福
1904
1913
玻尔
轨道模型
情境导入
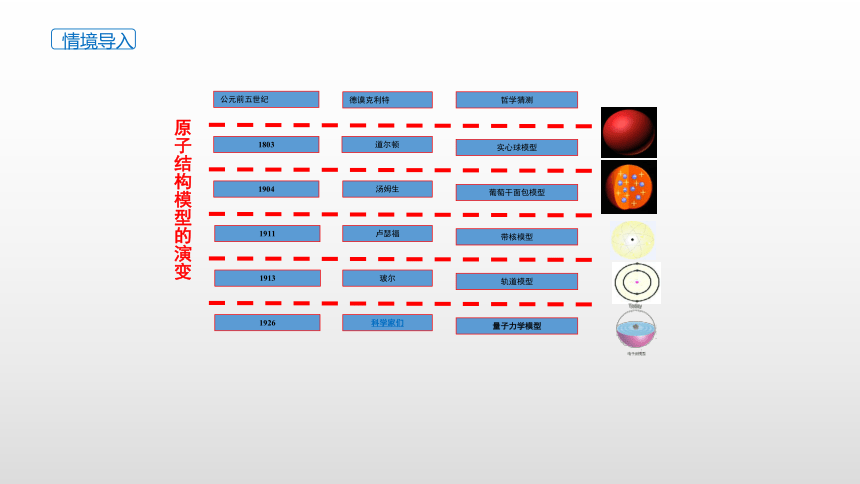
原子结构模型的演变
公元前五世纪
德谟克利特
哲学猜测
1803
道尔顿
实心球模型
葡萄干面包模型
带核模型
1911
汤姆生
卢瑟福
1904
1913
玻尔
轨道模型
1926
量子力学模型
科学家们
情境导入
知识海洋
一、原子的结构
1、原子的构成
2、原子内微粒间的电荷关系
质子、中子、电子的电性和电量情况?
1个质子带一个单位正电荷
中子不带电
1个电子带一个单位负电荷
知识海洋
原子核所带的电荷数=质子所带的电荷数
核电荷数=质子数
原子中:核外电子数=质子数=核电荷数=原子序数
离子中:核外电子数≠质子数=核电荷数=原子序数
阳离子:核外电子数=质子数-离子所带电荷数
阴离子:核外电子数=质子数+离子所带电荷数
知识海洋
原子:没有得失电子,显电中性
离子:得到或失去电子,带负电或正电性
2、原子内微粒间的电荷关系
粒子 电子 原子核
质子 中子
电性和电量 1个电子带一个单位负电荷 1个质子带一个单位正电荷 不显电性
质量/kg 9.109×10-31 1.673×10-27 1.675×10-27
相对质量
1.007
1.008
知识海洋
3、原子内微粒间的质量关系
原子 质子数(Z) 中子数(N) 质子数+中子数(A) 相对原子质量
F 9 10 19 18.998
Na 11 12 23 22.989
Al 13 14 27 26.982
将原子核内所有的质子和中子的相对质量取近似整数值加起来,所得的数值,叫质量数。
质量数(A) = 质子数(Z) + 中子数(N)
将有关原子的质子数和中子数之和填入表中,并
与原子的相对原子质量作比较,得出什么结论
质量数 = 近似相对原子质量
知识海洋
知识海洋
X
A
Z
—元素符号
质量数——
核电荷数(核内质子数)——
质量数(A) = 质子数(Z) + 中子数(N)
4、表示原子组成的一种方法
知识海洋
a——代表质量数;
b——代表质子数既核电荷数;
c——代表离子的所带电荷数;
d——代表化合价
e——代表原子个数
a b c d e各代表什么
请看下列表示
a
b
+d
X
c+
e
4、表示原子组成的一种方法
微粒间的数量关系
质子Z 中子N 电子e- 质量数A
1H217O2
92
92
235
143
18
36
18
18
应用探究
92U
235
微粒间的数量关系
应用探究
质子Z 中子N 电子e- 质量数A
中性原子 Z A-Z Z A
阳离子 Z A-Z Z-n A
阴离子 Z A-Z Z+n A
A
Z
X
A
Z
X
n+
A
Z
X
n-
【例】某元素X的原子,质量数为A,含N个中子,它与1H原子组成HmX分子。在a g HmX中所含质子的物质的量是( )
X
A
(A-N)
HmAX
氢化物摩尔质量=m+A
氢化物质子数=m+(A-N)
A
应用探究
A.(A-N+m)mol
B.(A-N) mol
C.(A-N) mol
D.(A-N+m)mol
质子数= A - N
(m + A-N)
1、核外电子运动特征
⑴ 运动微粒(电子)的质量很小
9.11×10-31 kg ,只有质子质量的1/1836
⑵ 运动速度极高
2200km/s (约为光速的1%)
汽车 0.03
炮弹 2.00
人造卫星 7.8
宇宙飞船 11.2
⑶ 运动范围极小
知识海洋
二、原子核外电子排布
科学模型处理:
问题:目前人们把原子核外分为几个电子层呢?
在各电子层上运动的电子的能量有什么区别呢?
知识海洋
2、各个区域上运动着的电子的能量是不同的,即各电子层上电子的能量不同
1、原子核外电子是分区域运动的,人们把核外电子运动的不同区域看作不同的电子层(模型思想)
为了形象、简单的表示原子的结构,人们就创造了“原子结构示意图”这种特殊的图形。
2、原子结构示意图
原子核
质子数
该电子层上的电子
电子层
知识海洋
+12
第1层
第2层
第3层
2
2
原子核
原子核带正电
质子数
K层
L层
M层
8
二、原子核外电子排布
思考:核外电子分层排布有什么规律吗?
应用探究
【例】请画出下列原子结构示意图:
He
Ne
Ar
H
O
Mg
8
2
8
+18
2
8
+10
2
+2
2
2
8
+12
2
6
+8
1
+1
排布规律:
1、能量最低原理:由内往外排,先排K层,排满K层再排L层、N层、O层……
2、每层最多容纳电子数2n2(n表示电子层),最外层中的电子数最多只有8个( K层只有2个),次外层不超过18个电子,倒数第三层不超过32个电子。
【注意】这些规律是相互联系,相互制约,不可割裂。
应用探究
【例】请画出下列原子结构示意图:
He
Ne
Ar
H
O
Mg
8
2
8
+18
2
8
+10
2
+2
2
2
8
+12
2
6
+8
1
+1
【例】判断下列原子结构示意图是否正确?为什么?
A、
B、
D、
C、
×
×
×
×
应用探究
+19
2
8
9
+12
2
7
3
+54
2
8
18
20
6
+3
1
2
应用探究
【例】根据核外电子排布规律,画出下列元素原子的结构示意图。
(1)55Cs
(2)35Br
+55
2
8
18
18
8
1
+35
2
8
18
7
氧、镁原子核外电子排布都没有达到稳定结构,它们是如何发生化学反应形成氧化镁的?
失去2e-
得到2e-
应用探究
Ne
8
2
+10
Mg
2
2
8
+12
O
6
2
+8
O2-
8
2
+8
Mg2+
2
8
+12
Mg2+
O2-
+11
8
2
Na+
+17
8
8
2
Cl-
Na+
Cl-
Na
+11
8
1
2
Cl
+17
8
7
2
氯化钠的形成
Mg
+12
2
2
8
O
+8
6
2
2e-
Mg2+
+12
2
8
O2-
+8
8
2
Mg2+
O2-
应用探究
应用探究
一些元素的原子得失电子的情况
元素 化合价 原子最外层电子数目 失去(或得到)电子的数目
Na
Mg
O
Cl
+1
-1
+2
-2
2
失去1个
失去2个
得到1个
得到2个
1
6
7
讨论:化合价与得失电子的数目、最外层电子数目之间的关系。
结论: 正化合价=失电子数 |负化合价|=得电子数
【例】用下面的结构示意图的字母填空:
应用探究
C
C
B
A
(1)属于金属原子的是_______________;
(2)属于非金属原子的是_____________;
(3)属于离子结构示意图的是_________;
(4)具有稳定结构的是_______________。
7
2
8
+17
2
2
8
+12
2
8
+11
A
B
C
【例】已知最外层电子数相等的元素原子具有相似化学性质。下列原子中,与氧元素原子的化学性质相似的是( )
A. Ne B. Mg C. S D. C
应用探究
+16
2
8
6
原子
种类
电性
化学性质
电子式
课堂小结
电子数
中子
质子
质量数
核电荷数
电子排布
原子
原子核
核外电子
在质子数确定后,决定① 种类
(核素→同位素)
近似相对原子质量
最外层电子数
各层
电子数
电子数
原子结构示意图
决定元素②
决定整个原子显不显③
书写原子的④
决定主族元素的⑤
电子层序数(n) 1 2 3 4 5 6 7
符号
能量大小
距核远近
K L M N O P Q
小 大
近 远
课堂小结
{
数量规律
能量规律
离核由近到远,电子能量由低到高
每层最多能容纳的电子数为2n2
最外层不超过8个(K层为最外层时不超过2个)
次外层不超过18个
第一章第一节元素周期表
--原子结构及核外电子的排布
人教版高一化学必修二
情境导入
学生发展层级:无机物核心知识、认识发展和能力表现的学习进阶
认识发展
核心知识
能力表现
基于结构和价键认知物质世界
化学键、物质结构、性质等
解释、论证、比较、预测
学段
基于反应原理认识物质世界
电化学、平衡、电离、水解等
解释、预测
基于位构性认识物质世界
元素周期律、表等
解释、比较、预测、推论
基于原子结构认识元素性质
原子序数、原子结构模型、核外电子排布、元素性质
解释
基于类别和价态认识物质性质
金属、非金属、氧化物、酸碱盐、二维图
描述、归纳、分析、预测、设计、证明
基于代表物及分类认识物质性质
混合物、纯净物、元素、单质、化合物、物理性质、化学性质、化合价
描述
情境导入
发展学生证据推理与模型认知的核心素养
认识角度
认识方式
本章学习之前
本章学习之后
类别通性
氧化还原
相似性、递变性
位置·结构·性质
基于物质性质但角度的认识方式
孤立、关联
基于:“位置·结构·性质
”的系统思维
比较、系统
公元前五世纪
德谟克利特
哲学猜测
1803
道尔顿
实心球模型
原子结构模型的演变
情境导入
原子结构模型的演变
公元前五世纪
德谟克利特
哲学猜测
1803
道尔顿
实心球模型
葡萄干面包模型
汤姆生
1904
情境导入
原子结构模型的演变
公元前五世纪
德谟克利特
哲学猜测
1803
道尔顿
实心球模型
葡萄干面包模型
汤姆生——发现电子
1904
1911
卢瑟福
情境导入
原子结构模型的演变
公元前五世纪
德谟克利特
哲学猜测
1803
道尔顿
实心球模型
葡萄干面包模型
带核模型
1911
汤姆生
卢瑟福
1904
情境导入
根据a粒子散射实验,卢瑟福提出了带核的原子结构模型,原子由原子核和电子构成,电子在核周围做高速无规则运动,就像行星围绕太阳运转一样。
情境导入
原子结构模型的演变
公元前五世纪
德谟克利特
哲学猜测
1803
道尔顿
实心球模型
葡萄干面包模型
带核模型
1911
汤姆生
卢瑟福
1904
1913
玻尔
轨道模型
情境导入
原子结构模型的演变
公元前五世纪
德谟克利特
哲学猜测
1803
道尔顿
实心球模型
葡萄干面包模型
带核模型
1911
汤姆生
卢瑟福
1904
1913
玻尔
轨道模型
1926
量子力学模型
科学家们
情境导入
知识海洋
一、原子的结构
1、原子的构成
2、原子内微粒间的电荷关系
质子、中子、电子的电性和电量情况?
1个质子带一个单位正电荷
中子不带电
1个电子带一个单位负电荷
知识海洋
原子核所带的电荷数=质子所带的电荷数
核电荷数=质子数
原子中:核外电子数=质子数=核电荷数=原子序数
离子中:核外电子数≠质子数=核电荷数=原子序数
阳离子:核外电子数=质子数-离子所带电荷数
阴离子:核外电子数=质子数+离子所带电荷数
知识海洋
原子:没有得失电子,显电中性
离子:得到或失去电子,带负电或正电性
2、原子内微粒间的电荷关系
粒子 电子 原子核
质子 中子
电性和电量 1个电子带一个单位负电荷 1个质子带一个单位正电荷 不显电性
质量/kg 9.109×10-31 1.673×10-27 1.675×10-27
相对质量
1.007
1.008
知识海洋
3、原子内微粒间的质量关系
原子 质子数(Z) 中子数(N) 质子数+中子数(A) 相对原子质量
F 9 10 19 18.998
Na 11 12 23 22.989
Al 13 14 27 26.982
将原子核内所有的质子和中子的相对质量取近似整数值加起来,所得的数值,叫质量数。
质量数(A) = 质子数(Z) + 中子数(N)
将有关原子的质子数和中子数之和填入表中,并
与原子的相对原子质量作比较,得出什么结论
质量数 = 近似相对原子质量
知识海洋
知识海洋
X
A
Z
—元素符号
质量数——
核电荷数(核内质子数)——
质量数(A) = 质子数(Z) + 中子数(N)
4、表示原子组成的一种方法
知识海洋
a——代表质量数;
b——代表质子数既核电荷数;
c——代表离子的所带电荷数;
d——代表化合价
e——代表原子个数
a b c d e各代表什么
请看下列表示
a
b
+d
X
c+
e
4、表示原子组成的一种方法
微粒间的数量关系
质子Z 中子N 电子e- 质量数A
1H217O2
92
92
235
143
18
36
18
18
应用探究
92U
235
微粒间的数量关系
应用探究
质子Z 中子N 电子e- 质量数A
中性原子 Z A-Z Z A
阳离子 Z A-Z Z-n A
阴离子 Z A-Z Z+n A
A
Z
X
A
Z
X
n+
A
Z
X
n-
【例】某元素X的原子,质量数为A,含N个中子,它与1H原子组成HmX分子。在a g HmX中所含质子的物质的量是( )
X
A
(A-N)
HmAX
氢化物摩尔质量=m+A
氢化物质子数=m+(A-N)
A
应用探究
A.(A-N+m)mol
B.(A-N) mol
C.(A-N) mol
D.(A-N+m)mol
质子数= A - N
(m + A-N)
1、核外电子运动特征
⑴ 运动微粒(电子)的质量很小
9.11×10-31 kg ,只有质子质量的1/1836
⑵ 运动速度极高
2200km/s (约为光速的1%)
汽车 0.03
炮弹 2.00
人造卫星 7.8
宇宙飞船 11.2
⑶ 运动范围极小
知识海洋
二、原子核外电子排布
科学模型处理:
问题:目前人们把原子核外分为几个电子层呢?
在各电子层上运动的电子的能量有什么区别呢?
知识海洋
2、各个区域上运动着的电子的能量是不同的,即各电子层上电子的能量不同
1、原子核外电子是分区域运动的,人们把核外电子运动的不同区域看作不同的电子层(模型思想)
为了形象、简单的表示原子的结构,人们就创造了“原子结构示意图”这种特殊的图形。
2、原子结构示意图
原子核
质子数
该电子层上的电子
电子层
知识海洋
+12
第1层
第2层
第3层
2
2
原子核
原子核带正电
质子数
K层
L层
M层
8
二、原子核外电子排布
思考:核外电子分层排布有什么规律吗?
应用探究
【例】请画出下列原子结构示意图:
He
Ne
Ar
H
O
Mg
8
2
8
+18
2
8
+10
2
+2
2
2
8
+12
2
6
+8
1
+1
排布规律:
1、能量最低原理:由内往外排,先排K层,排满K层再排L层、N层、O层……
2、每层最多容纳电子数2n2(n表示电子层),最外层中的电子数最多只有8个( K层只有2个),次外层不超过18个电子,倒数第三层不超过32个电子。
【注意】这些规律是相互联系,相互制约,不可割裂。
应用探究
【例】请画出下列原子结构示意图:
He
Ne
Ar
H
O
Mg
8
2
8
+18
2
8
+10
2
+2
2
2
8
+12
2
6
+8
1
+1
【例】判断下列原子结构示意图是否正确?为什么?
A、
B、
D、
C、
×
×
×
×
应用探究
+19
2
8
9
+12
2
7
3
+54
2
8
18
20
6
+3
1
2
应用探究
【例】根据核外电子排布规律,画出下列元素原子的结构示意图。
(1)55Cs
(2)35Br
+55
2
8
18
18
8
1
+35
2
8
18
7
氧、镁原子核外电子排布都没有达到稳定结构,它们是如何发生化学反应形成氧化镁的?
失去2e-
得到2e-
应用探究
Ne
8
2
+10
Mg
2
2
8
+12
O
6
2
+8
O2-
8
2
+8
Mg2+
2
8
+12
Mg2+
O2-
+11
8
2
Na+
+17
8
8
2
Cl-
Na+
Cl-
Na
+11
8
1
2
Cl
+17
8
7
2
氯化钠的形成
Mg
+12
2
2
8
O
+8
6
2
2e-
Mg2+
+12
2
8
O2-
+8
8
2
Mg2+
O2-
应用探究
应用探究
一些元素的原子得失电子的情况
元素 化合价 原子最外层电子数目 失去(或得到)电子的数目
Na
Mg
O
Cl
+1
-1
+2
-2
2
失去1个
失去2个
得到1个
得到2个
1
6
7
讨论:化合价与得失电子的数目、最外层电子数目之间的关系。
结论: 正化合价=失电子数 |负化合价|=得电子数
【例】用下面的结构示意图的字母填空:
应用探究
C
C
B
A
(1)属于金属原子的是_______________;
(2)属于非金属原子的是_____________;
(3)属于离子结构示意图的是_________;
(4)具有稳定结构的是_______________。
7
2
8
+17
2
2
8
+12
2
8
+11
A
B
C
【例】已知最外层电子数相等的元素原子具有相似化学性质。下列原子中,与氧元素原子的化学性质相似的是( )
A. Ne B. Mg C. S D. C
应用探究
+16
2
8
6
原子
种类
电性
化学性质
电子式
课堂小结
电子数
中子
质子
质量数
核电荷数
电子排布
原子
原子核
核外电子
在质子数确定后,决定① 种类
(核素→同位素)
近似相对原子质量
最外层电子数
各层
电子数
电子数
原子结构示意图
决定元素②
决定整个原子显不显③
书写原子的④
决定主族元素的⑤
电子层序数(n) 1 2 3 4 5 6 7
符号
能量大小
距核远近
K L M N O P Q
小 大
近 远
课堂小结
{
数量规律
能量规律
离核由近到远,电子能量由低到高
每层最多能容纳的电子数为2n2
最外层不超过8个(K层为最外层时不超过2个)
次外层不超过18个
