2020年必修一人教版第二册 第一章 第一节 第三课时 不同价态含硫物质的转化(18张)
文档属性
| 名称 | 2020年必修一人教版第二册 第一章 第一节 第三课时 不同价态含硫物质的转化(18张) |  | |
| 格式 | zip | ||
| 文件大小 | 3.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-02-23 13:03:05 | ||
图片预览




文档简介
(共18张PPT)
不同价态含硫物质的转化
第五章 第一节 硫及其化合物
学习目标
核心素养
1.了解不同价态含硫物质之间的转化。
2.能利用氧化还原反应原理设计不同价态物质之间的相互转化。
通过对不同价态含硫物质之间相互转化的学习,培养学生论据推理与模型认知的化学核心素养;知道不同价态物质之间能相互转化,使学生形成变化观的素养。
不同价态含硫物质的转化
化工工程师
化工工程师是解决人类在生产、生活等领域面临的化工相关问题的专业技术人才,工作在石油炼制、化肥生产、医药开发和环境治理等了领域。主要工作是依据科学原理,统筹各方面的资源,设计化工生产的工艺流程,并监控生产过程,及时解决生产中遇到的技术问题。
化工工程师需要具有高度的社会责任感、团队精神、全局观念、风险管控意识和创新能力,并具备化学、化工、安全、经济、环境等方面的专业知识。
新课导入
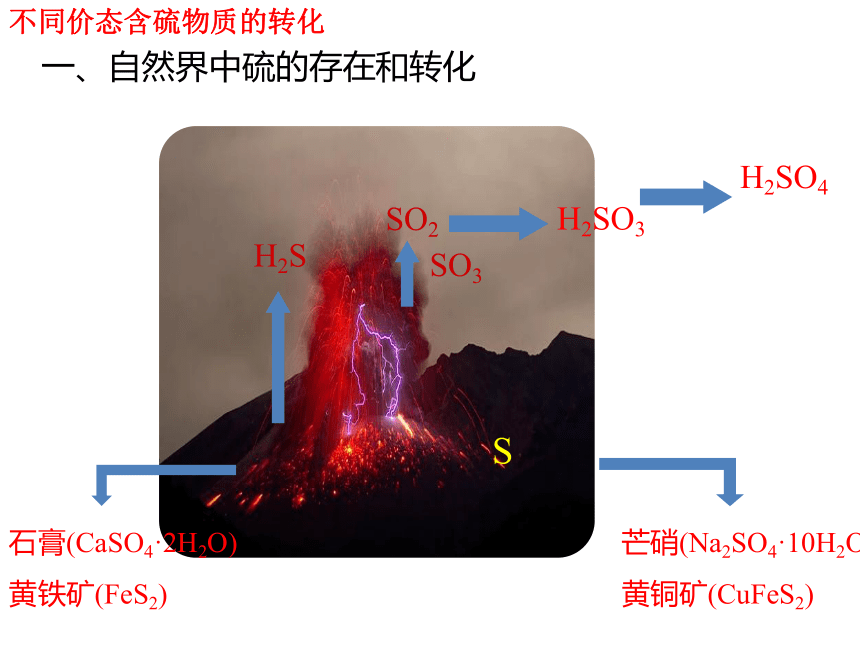
不同价态含硫物质的转化
石膏(CaSO4·2H2O)
黄铁矿(FeS2)
H2S
SO2
SO3
H2SO3
H2SO4
S
芒硝(Na2SO4·10H2O)
黄铜矿(CuFeS2)
一、自然界中硫的存在和转化
知识梳理
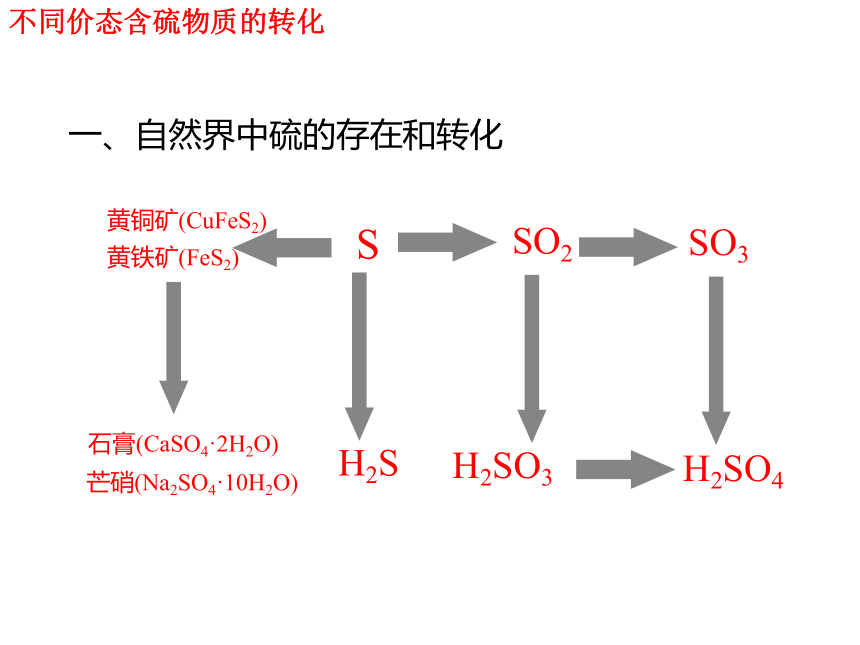
不同价态含硫物质的转化
SO2
SO3
H2S
H2SO3
H2SO4
S
一、自然界中硫的存在和转化
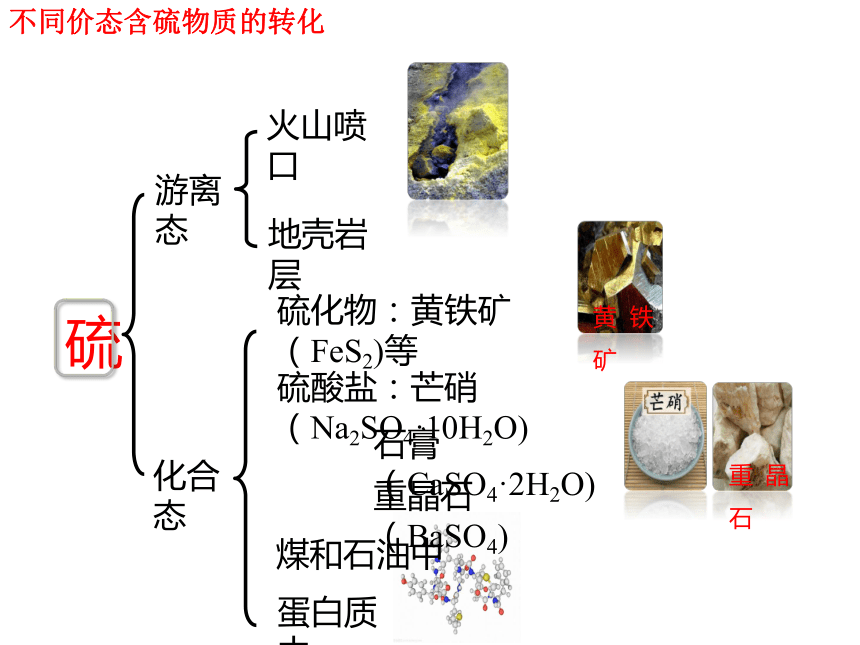
不同价态含硫物质的转化
硫化物:黄铁矿(FeS2)等
硫酸盐:芒硝(Na2SO4·10H2O)
石膏(CaSO4·2H2O)
煤和石油中
蛋白质中
游离态
化合态
火山喷口
地壳岩层
重晶石(BaSO4)
不同价态含硫物质的转化
二、不同价态含硫物质的转化
(1)尽可能多地列举每种价态的硫元素所对应的物质,并根据硫元素化合价的变化,分析各种物质在反应中表现的是氧化性还是还原性。
(2)从上述转化关系中设计实验实现其转化。
(3)综合考虑实验安全和环境保护,选择一种实验方案进行实验。
不同价态含硫物质的转化
化学实验设计
化学实验设计是指实验者在实施化学实验之前,根据一定的实验目的,运用化学知识与技能,按照一定的实验方法,对实验的原理、试剂、仪器与装置、步骤和方法等所进行的规划。
运用化学实验设计时,应遵循科学性、可行性、安全性和绿色化原则。化学实验设计一般以实验设计方案的形式呈现,通常包括实验课题、实验目的、实验原理、实验仪器与试剂、实验步骤及注意事项、实验数据及处理、实验结论与讨论等。
不同价态含硫物质的转化
化学实验设计
如何检验放置在空气中的亚硫酸钠固体已经变质?如何检验亚硫酸钠已经完全变质?
1. 把样品溶于水中,加入氯化钡溶液,再加入足量盐酸。
2. 把样品溶于水中,加入盐酸。
加入氯化钡溶液后有沉淀生成,再加入足量盐酸,若沉淀没有完全溶解说明亚硫酸钠已变质。
样品溶于水后,加入盐酸,有气泡产生则说明亚硫酸钠没有完全变质。
不同价态含硫物质的转化
1. 单质硫的综合运用
例1.常温下单质硫主要以S8形式存在。加热时,S8会转化为S6、S4、S2等。当温度达到750 ℃时,硫蒸气主要以S2形式存在(占92%)。下列说法中正确的是( )
A. S8转化为S6、S4、S2属于物理变化
B. 不论哪种硫分子,完全燃烧时都生成二氧化硫
C. S2、S4、S6、S8都是硫元素形成的单质,为同种物质
D. 把硫单质在空气中加热到750℃即得S2
B
不同价态含硫物质的转化
例2.FeS2的结构类似于Na2O2,是一种过硫化物,与酸反应时首先生成H2S2,H2S2类似于H2O2,易分解:H2S2===H2S+S↓。实验室制取H2S时,某学生误将FeS2当作了FeS,反应完后,不可能生成的物质为( )
A. H2S B. S
C. Fe2+ D. Fe3+
D
不同价态含硫物质的转化
例3.实验室用硫酸和硫化亚铁反应制取少量硫化氢气体,装置中可能涉及如图组件。关于这些组件的说明正确的是( )
A. ①能控制气体发生速度
B. 若气体不纯而万一发生爆炸,②具有 保护装置的作用
C. ③用于硫化氢的干燥和收集
D. ④用于硫化氢的尾气处理
B
2. 硫化物的性质与应用
3. 硫的氧化物及综合
例4.对于反应:
A. 该反应是可逆反应,在相同条件下,反应可同时向两个方向进行
B. 1 mol氧气与2 mol二氧化硫混合发生反应能生成2 mol 三氧化硫
C. 在该反应中二氧化硫作还原剂,氧气作氧化剂
D. 该反应有0.4 mol电子发生转移时,生成三氧化硫0.2 mol
叙述不正确的是 ( )
B
4. 浓硫酸性质的综合应用
例5.已知X为一种常见酸的浓溶液,能使蔗糖变黑。A与X反应的转化关系如图所示,其中反应条件及部分产物均已略去,则下列有关说法正确的是( )
A. X使蔗糖变黑的现象主要体现了X的强氧化性
B. 若A为铁,则足量A与X在室温下即可完全反应
C. 若A为碳单质,则将C通入少量的澄清石灰水中,一定
有白色沉淀产生
D. 工业上,B转化为D的反应条件为高温、常压、使用催化剂
D
例6.某校研究性学习小组,探究一定量的浓硫酸与足量锌充分反应产生的气体产物,进行如下实验:按图组装好实验装置,在A中加入
5 mL 98%的浓硫酸和足量的锌粒,微热试管A,观察到C、D、E中均有气泡产生;随后气泡量减少,品红溶液褪色,D中先出现浑浊后浑浊消失;反应较长时间后,C、D、E中的气泡量又会明显增加。
4. 浓硫酸性质的综合应用
(1)写出A中从反应开始到停止可能发生反应的化学方程式:________________________。
(2)从甲、乙中选择合适的装置填入B、C中,并进行正确连接,a接______、______接b,c接______、______接d;D、E两支试管中四氯化碳的作用是________________________。
防倒吸
3(或4)
4(或3)
2
1
Zn+2H2SO4(浓)===ZnSO4+SO2↑+2H2O
Zn+H2SO4===ZnSO4+H2↑
(3)能证明浓硫酸具有强氧化性的实验现象为______________________;反应较长时间后气泡量又会明显增加的原因是_________________________________________。
(4)D中浑浊消失的离子反应方程式为__________________________________________。
C中品红溶液褪色
浓硫酸变成稀硫酸后与锌反应放出氢气
课堂总结
不同价态含硫物质的转化
第五章 第一节 硫及其化合物
学习目标
核心素养
1.了解不同价态含硫物质之间的转化。
2.能利用氧化还原反应原理设计不同价态物质之间的相互转化。
通过对不同价态含硫物质之间相互转化的学习,培养学生论据推理与模型认知的化学核心素养;知道不同价态物质之间能相互转化,使学生形成变化观的素养。
不同价态含硫物质的转化
化工工程师
化工工程师是解决人类在生产、生活等领域面临的化工相关问题的专业技术人才,工作在石油炼制、化肥生产、医药开发和环境治理等了领域。主要工作是依据科学原理,统筹各方面的资源,设计化工生产的工艺流程,并监控生产过程,及时解决生产中遇到的技术问题。
化工工程师需要具有高度的社会责任感、团队精神、全局观念、风险管控意识和创新能力,并具备化学、化工、安全、经济、环境等方面的专业知识。
新课导入
不同价态含硫物质的转化
石膏(CaSO4·2H2O)
黄铁矿(FeS2)
H2S
SO2
SO3
H2SO3
H2SO4
S
芒硝(Na2SO4·10H2O)
黄铜矿(CuFeS2)
一、自然界中硫的存在和转化
知识梳理
不同价态含硫物质的转化
SO2
SO3
H2S
H2SO3
H2SO4
S
一、自然界中硫的存在和转化
不同价态含硫物质的转化
硫化物:黄铁矿(FeS2)等
硫酸盐:芒硝(Na2SO4·10H2O)
石膏(CaSO4·2H2O)
煤和石油中
蛋白质中
游离态
化合态
火山喷口
地壳岩层
重晶石(BaSO4)
不同价态含硫物质的转化
二、不同价态含硫物质的转化
(1)尽可能多地列举每种价态的硫元素所对应的物质,并根据硫元素化合价的变化,分析各种物质在反应中表现的是氧化性还是还原性。
(2)从上述转化关系中设计实验实现其转化。
(3)综合考虑实验安全和环境保护,选择一种实验方案进行实验。
不同价态含硫物质的转化
化学实验设计
化学实验设计是指实验者在实施化学实验之前,根据一定的实验目的,运用化学知识与技能,按照一定的实验方法,对实验的原理、试剂、仪器与装置、步骤和方法等所进行的规划。
运用化学实验设计时,应遵循科学性、可行性、安全性和绿色化原则。化学实验设计一般以实验设计方案的形式呈现,通常包括实验课题、实验目的、实验原理、实验仪器与试剂、实验步骤及注意事项、实验数据及处理、实验结论与讨论等。
不同价态含硫物质的转化
化学实验设计
如何检验放置在空气中的亚硫酸钠固体已经变质?如何检验亚硫酸钠已经完全变质?
1. 把样品溶于水中,加入氯化钡溶液,再加入足量盐酸。
2. 把样品溶于水中,加入盐酸。
加入氯化钡溶液后有沉淀生成,再加入足量盐酸,若沉淀没有完全溶解说明亚硫酸钠已变质。
样品溶于水后,加入盐酸,有气泡产生则说明亚硫酸钠没有完全变质。
不同价态含硫物质的转化
1. 单质硫的综合运用
例1.常温下单质硫主要以S8形式存在。加热时,S8会转化为S6、S4、S2等。当温度达到750 ℃时,硫蒸气主要以S2形式存在(占92%)。下列说法中正确的是( )
A. S8转化为S6、S4、S2属于物理变化
B. 不论哪种硫分子,完全燃烧时都生成二氧化硫
C. S2、S4、S6、S8都是硫元素形成的单质,为同种物质
D. 把硫单质在空气中加热到750℃即得S2
B
不同价态含硫物质的转化
例2.FeS2的结构类似于Na2O2,是一种过硫化物,与酸反应时首先生成H2S2,H2S2类似于H2O2,易分解:H2S2===H2S+S↓。实验室制取H2S时,某学生误将FeS2当作了FeS,反应完后,不可能生成的物质为( )
A. H2S B. S
C. Fe2+ D. Fe3+
D
不同价态含硫物质的转化
例3.实验室用硫酸和硫化亚铁反应制取少量硫化氢气体,装置中可能涉及如图组件。关于这些组件的说明正确的是( )
A. ①能控制气体发生速度
B. 若气体不纯而万一发生爆炸,②具有 保护装置的作用
C. ③用于硫化氢的干燥和收集
D. ④用于硫化氢的尾气处理
B
2. 硫化物的性质与应用
3. 硫的氧化物及综合
例4.对于反应:
A. 该反应是可逆反应,在相同条件下,反应可同时向两个方向进行
B. 1 mol氧气与2 mol二氧化硫混合发生反应能生成2 mol 三氧化硫
C. 在该反应中二氧化硫作还原剂,氧气作氧化剂
D. 该反应有0.4 mol电子发生转移时,生成三氧化硫0.2 mol
叙述不正确的是 ( )
B
4. 浓硫酸性质的综合应用
例5.已知X为一种常见酸的浓溶液,能使蔗糖变黑。A与X反应的转化关系如图所示,其中反应条件及部分产物均已略去,则下列有关说法正确的是( )
A. X使蔗糖变黑的现象主要体现了X的强氧化性
B. 若A为铁,则足量A与X在室温下即可完全反应
C. 若A为碳单质,则将C通入少量的澄清石灰水中,一定
有白色沉淀产生
D. 工业上,B转化为D的反应条件为高温、常压、使用催化剂
D
例6.某校研究性学习小组,探究一定量的浓硫酸与足量锌充分反应产生的气体产物,进行如下实验:按图组装好实验装置,在A中加入
5 mL 98%的浓硫酸和足量的锌粒,微热试管A,观察到C、D、E中均有气泡产生;随后气泡量减少,品红溶液褪色,D中先出现浑浊后浑浊消失;反应较长时间后,C、D、E中的气泡量又会明显增加。
4. 浓硫酸性质的综合应用
(1)写出A中从反应开始到停止可能发生反应的化学方程式:________________________。
(2)从甲、乙中选择合适的装置填入B、C中,并进行正确连接,a接______、______接b,c接______、______接d;D、E两支试管中四氯化碳的作用是________________________。
防倒吸
3(或4)
4(或3)
2
1
Zn+2H2SO4(浓)===ZnSO4+SO2↑+2H2O
Zn+H2SO4===ZnSO4+H2↑
(3)能证明浓硫酸具有强氧化性的实验现象为______________________;反应较长时间后气泡量又会明显增加的原因是_________________________________________。
(4)D中浑浊消失的离子反应方程式为__________________________________________。
C中品红溶液褪色
浓硫酸变成稀硫酸后与锌反应放出氢气
课堂总结
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
