鲁教版第一节酸及其性质(共22张PPT)
图片预览




文档简介
(共22张PPT)
第一节 酸及其性质
第七单元 常见的酸和碱
一、常见的酸
活动天地
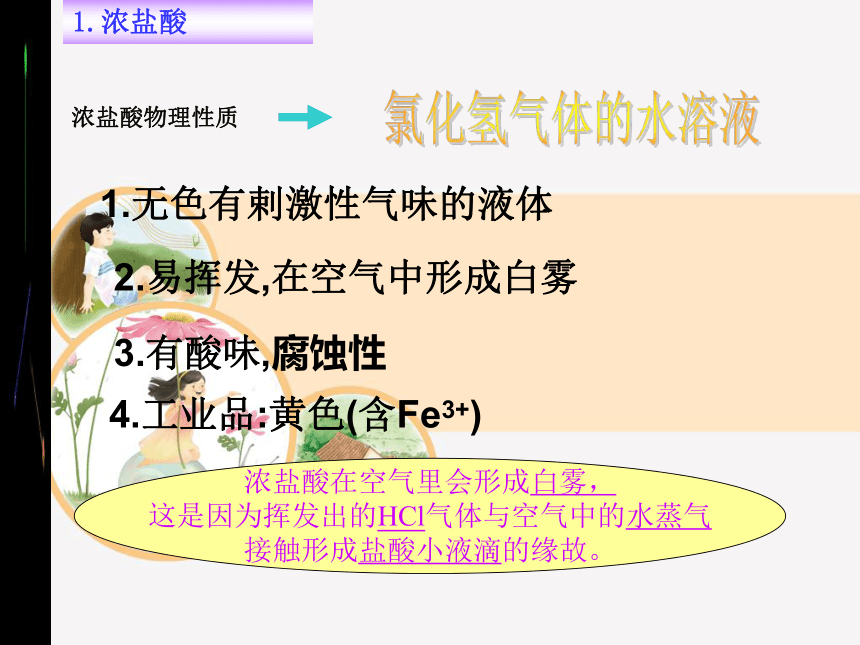
1.浓盐酸
浓盐酸在空气里会形成白雾,
这是因为挥发出的HCl气体与空气中的水蒸气
接触形成盐酸小液滴的缘故。
浓盐酸物理性质
氯化氢气体的水溶液
1.无色有剌激性气味的液体
2.易挥发,在空气中形成白雾
3.有酸味,腐蚀性
4.工业品:黄色(含Fe3+)
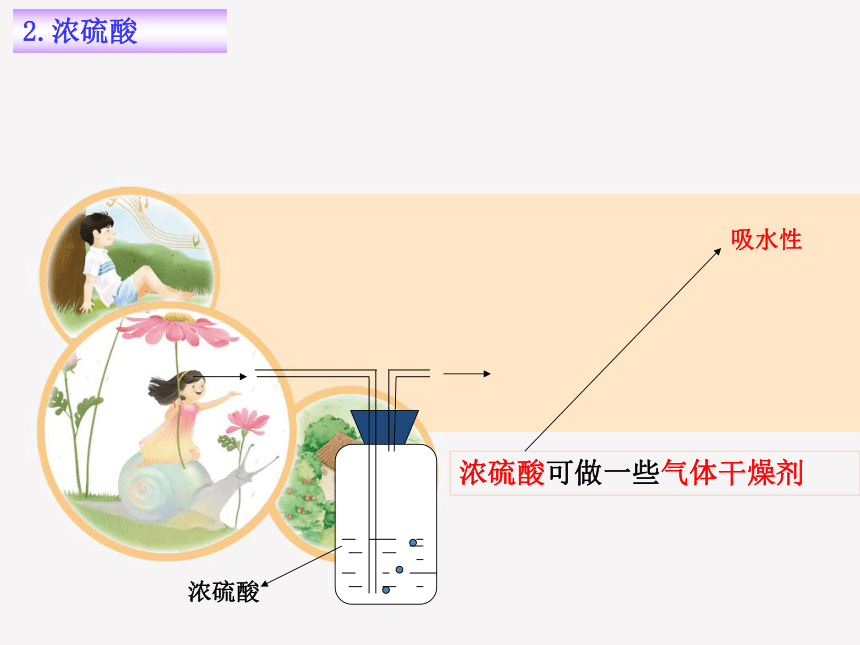
2.浓硫酸
吸水性
浓硫酸可做一些气体干燥剂
浓硫酸
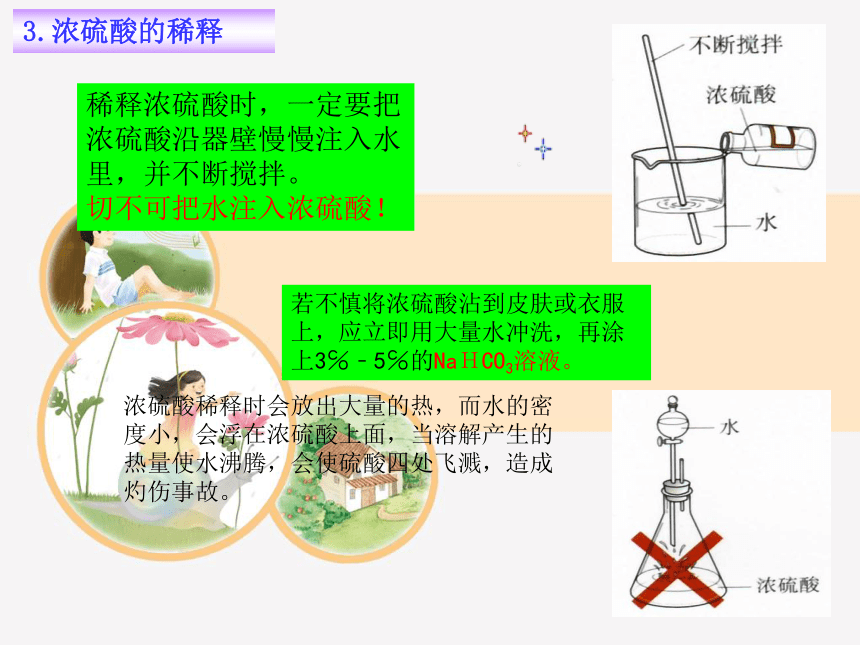
3.浓硫酸的稀释
浓硫酸稀释时会放出大量的热,而水的密度小,会浮在浓硫酸上面,当溶解产生的热量使水沸腾,会使硫酸四处飞溅,造成灼伤事故。
稀释浓硫酸时,一定要把浓硫酸沿器壁慢慢注入水里,并不断搅拌。
切不可把水注入浓硫酸!
若不慎将浓硫酸沾到皮肤或衣服上,应立即用大量水冲洗,再涂上3℅﹣5℅的NaHCO3溶液。
二、酸的化学性质
实验探究
变成红色
不变色
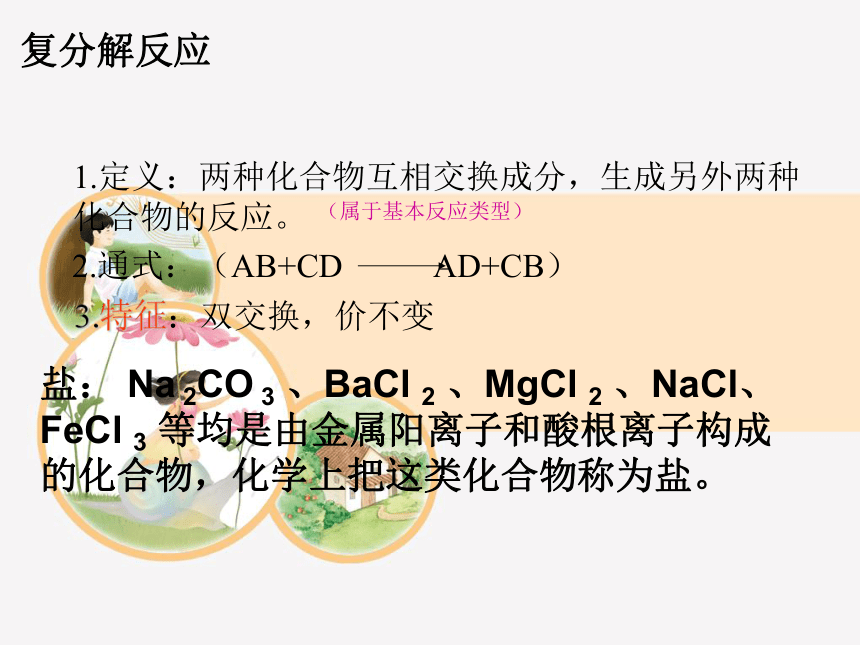
复分解反应
1.定义:两种化合物互相交换成分,生成另外两种化合物的反应。
2.通式:(AB+CD AD+CB)
(属于基本反应类型)
3.特征:双交换,价不变
盐: Na 2CO 3 、BaCl 2 、MgCl 2 、NaCl、FeCl 3 等均是由金属阳离子和酸根离子构成的化合物,化学上把这类化合物称为盐。
活动天地
注意:单质的铁和酸反应只能生成+2价的亚铁
化合物的铁和酸反应,反应前后铁元素的化合价不变
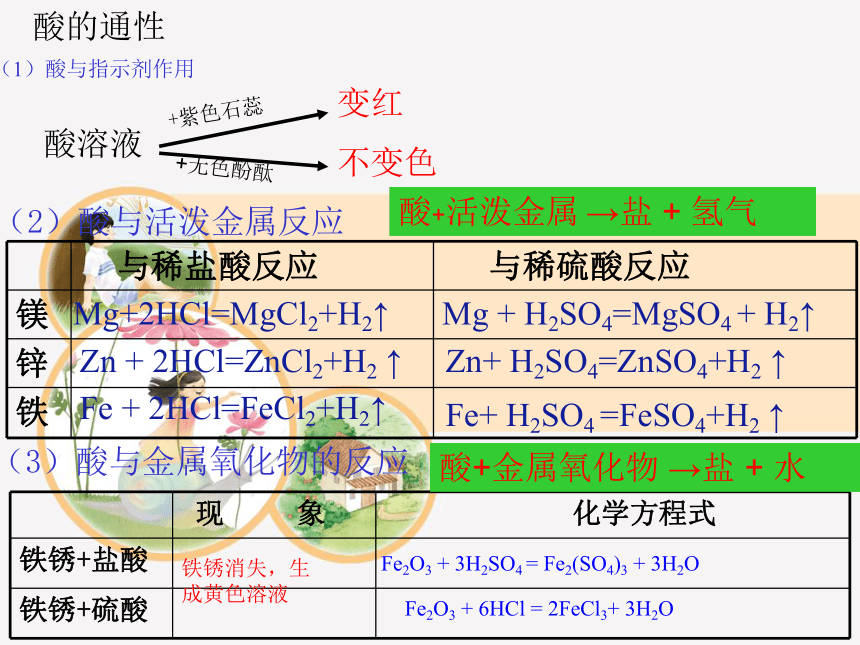
酸的通性
(1)酸与指示剂作用
+紫色石蕊
+无色酚酞
不变色
变红
酸溶液
(2)酸与活泼金属反应
Mg+2HCl=MgCl2+H2↑
Zn + 2HCl=ZnCl2+H2 ↑
Fe + 2HCl=FeCl2+H2↑
Fe+ H2SO4 =FeSO4+H2 ↑
Mg + H2SO4=MgSO4 + H2↑
Zn+ H2SO4=ZnSO4+H2 ↑
与稀盐酸反应 与稀硫酸反应
镁
锌
铁
酸+活泼金属 →盐 + 氢气
(3)酸与金属氧化物的反应
现 象 化学方程式
铁锈+盐酸
铁锈+硫酸
Fe2O3 + 6HCl = 2FeCl3+ 3H2O
Fe2O3 + 3H2SO4 = Fe2(SO4)3 + 3H2O
铁锈消失,生
成黄色溶液
酸+金属氧化物 →盐 + 水
H2SO4+Na2CO3=Na2SO4+H2O+CO2↑
2HCl+Na2CO3=2NaCl+H2O+CO2↑
酸+盐 →新酸 + 新盐
(4)酸与部分盐的反应
酸的通性
酸在水溶液中都能电离出氢离子(H+),即不同的酸溶液中都含有氢离子(H+),所以它们具有相似的化学性质。
想一想 酸为什么具有相似的化学性质?
用 途
盐 酸
HCl 重要化工产品。用于金属表面除锈、制造药物(如盐酸麻黄素、氯化锌)等;人体胃液中有盐酸,可帮助消化。
硫 酸
H2SO4 重要化工原料。用于生产化肥、农药、火药、染料以及冶炼金属、精炼石油和金属除锈等。
浓硫酸有吸水性,在实验室中常用它做干燥剂。
盐酸、硫酸的用途
课堂小结
盐 酸 硫 酸
颜色、状态 学.科.网
打开瓶盖后
气 味
无色、粘稠液体
无色、液体
有白雾
无白雾
有刺激性气味
无刺激性气味
现象
原因
有挥发性
无挥发性
敞口久置
现象
原因
质量减小,溶质
质量分数减小
质量增加,溶质
质量分数减小
有挥发性
有吸水性
课堂小结
一、酸能使酸碱指示剂显示不同的颜色;
二、酸能与多种活泼金属反应,生成氢气;
三、酸能与某些金属氧化物反应,生成水。
四、能与部分盐反应,生成新的酸和新的盐。
酸有一些相似的化学性质(通性):
方法
从个别推导到一般
从具体到抽象
课堂小结
挑战自我
1.浓盐酸、浓硫酸敞口放置一段时间后,共同变是?(???) A.溶质的质量减小 B.溶剂的质量减小 C.溶液的质量减小 D.溶质质量分数减小
D
挑战自我
null
2.白蚁分泌出蚁酸,蚁酸的化学性质与盐酸相似,能腐蚀很多物质,下列最不容易被蚁酸腐蚀的是( )
A. 镀锌水管 B. 铜制塑像
C. 大理石栏杆 D. 铝合金门窗
B
挑战自我
3.小明看见爸爸常常用稀盐酸给铁制器皿除锈,他自己想亲自试一试。于是,他找出一颗生锈铁钉出来,放入足量稀盐酸中,然后,美滋滋地去睡觉了……
可是,当他醒来之后,发现铁钉不见了,你知道为什么吗?用两个化学方程式表示出来。
生锈铁钉消失的原因:
Fe2O3+6HCl == 2FeCl3+ 3H2O
Fe + 2HCl ==FeCl2 + H2↑
挑战自我
4.某学生实验时,不小心将稀硫酸溅到衣服上,当时他认为不是浓硫酸没什么大问题。但不久,发现衣服上出现了几个小洞,这是因为 。
随着水分的蒸发,稀硫酸变成了浓硫酸
5.实验室里的一瓶蒸馏水和一瓶稀盐酸丢失了标签,你能帮老师把它们鉴别出来吗?你有哪些好方法?
用紫色石蕊试液
用镁条(或其它活泼金属)
用生锈铁钉
用碳酸钙
挑战自我
6.写出下列化学方程式:
(1)Fe2O3+ H2SO4== ;
(2)CuO+H2SO4== ;
(3) NaOH+H2SO4== ;
(4) HCl+Na2CO3== 。
Fe2(SO4)3 + 3H2O
3
CuSO4 + H2O
Na2SO4+ 2H2O
2
2
2NaCl + H2O+CO2↑
挑战自我
作业布置
实验室有两瓶失去标签的无色液体,体积都是500mL。老师告诉小明:其中一瓶是浓盐酸,一瓶是浓硫酸,并请小明帮忙为它们重新贴上标签,小明很快就完成了。你想,小明可能用什么方法区分开二者的?
再见!
第一节 酸及其性质
第七单元 常见的酸和碱
一、常见的酸
活动天地
1.浓盐酸
浓盐酸在空气里会形成白雾,
这是因为挥发出的HCl气体与空气中的水蒸气
接触形成盐酸小液滴的缘故。
浓盐酸物理性质
氯化氢气体的水溶液
1.无色有剌激性气味的液体
2.易挥发,在空气中形成白雾
3.有酸味,腐蚀性
4.工业品:黄色(含Fe3+)
2.浓硫酸
吸水性
浓硫酸可做一些气体干燥剂
浓硫酸
3.浓硫酸的稀释
浓硫酸稀释时会放出大量的热,而水的密度小,会浮在浓硫酸上面,当溶解产生的热量使水沸腾,会使硫酸四处飞溅,造成灼伤事故。
稀释浓硫酸时,一定要把浓硫酸沿器壁慢慢注入水里,并不断搅拌。
切不可把水注入浓硫酸!
若不慎将浓硫酸沾到皮肤或衣服上,应立即用大量水冲洗,再涂上3℅﹣5℅的NaHCO3溶液。
二、酸的化学性质
实验探究
变成红色
不变色
复分解反应
1.定义:两种化合物互相交换成分,生成另外两种化合物的反应。
2.通式:(AB+CD AD+CB)
(属于基本反应类型)
3.特征:双交换,价不变
盐: Na 2CO 3 、BaCl 2 、MgCl 2 、NaCl、FeCl 3 等均是由金属阳离子和酸根离子构成的化合物,化学上把这类化合物称为盐。
活动天地
注意:单质的铁和酸反应只能生成+2价的亚铁
化合物的铁和酸反应,反应前后铁元素的化合价不变
酸的通性
(1)酸与指示剂作用
+紫色石蕊
+无色酚酞
不变色
变红
酸溶液
(2)酸与活泼金属反应
Mg+2HCl=MgCl2+H2↑
Zn + 2HCl=ZnCl2+H2 ↑
Fe + 2HCl=FeCl2+H2↑
Fe+ H2SO4 =FeSO4+H2 ↑
Mg + H2SO4=MgSO4 + H2↑
Zn+ H2SO4=ZnSO4+H2 ↑
与稀盐酸反应 与稀硫酸反应
镁
锌
铁
酸+活泼金属 →盐 + 氢气
(3)酸与金属氧化物的反应
现 象 化学方程式
铁锈+盐酸
铁锈+硫酸
Fe2O3 + 6HCl = 2FeCl3+ 3H2O
Fe2O3 + 3H2SO4 = Fe2(SO4)3 + 3H2O
铁锈消失,生
成黄色溶液
酸+金属氧化物 →盐 + 水
H2SO4+Na2CO3=Na2SO4+H2O+CO2↑
2HCl+Na2CO3=2NaCl+H2O+CO2↑
酸+盐 →新酸 + 新盐
(4)酸与部分盐的反应
酸的通性
酸在水溶液中都能电离出氢离子(H+),即不同的酸溶液中都含有氢离子(H+),所以它们具有相似的化学性质。
想一想 酸为什么具有相似的化学性质?
用 途
盐 酸
HCl 重要化工产品。用于金属表面除锈、制造药物(如盐酸麻黄素、氯化锌)等;人体胃液中有盐酸,可帮助消化。
硫 酸
H2SO4 重要化工原料。用于生产化肥、农药、火药、染料以及冶炼金属、精炼石油和金属除锈等。
浓硫酸有吸水性,在实验室中常用它做干燥剂。
盐酸、硫酸的用途
课堂小结
盐 酸 硫 酸
颜色、状态 学.科.网
打开瓶盖后
气 味
无色、粘稠液体
无色、液体
有白雾
无白雾
有刺激性气味
无刺激性气味
现象
原因
有挥发性
无挥发性
敞口久置
现象
原因
质量减小,溶质
质量分数减小
质量增加,溶质
质量分数减小
有挥发性
有吸水性
课堂小结
一、酸能使酸碱指示剂显示不同的颜色;
二、酸能与多种活泼金属反应,生成氢气;
三、酸能与某些金属氧化物反应,生成水。
四、能与部分盐反应,生成新的酸和新的盐。
酸有一些相似的化学性质(通性):
方法
从个别推导到一般
从具体到抽象
课堂小结
挑战自我
1.浓盐酸、浓硫酸敞口放置一段时间后,共同变是?(???) A.溶质的质量减小 B.溶剂的质量减小 C.溶液的质量减小 D.溶质质量分数减小
D
挑战自我
null
2.白蚁分泌出蚁酸,蚁酸的化学性质与盐酸相似,能腐蚀很多物质,下列最不容易被蚁酸腐蚀的是( )
A. 镀锌水管 B. 铜制塑像
C. 大理石栏杆 D. 铝合金门窗
B
挑战自我
3.小明看见爸爸常常用稀盐酸给铁制器皿除锈,他自己想亲自试一试。于是,他找出一颗生锈铁钉出来,放入足量稀盐酸中,然后,美滋滋地去睡觉了……
可是,当他醒来之后,发现铁钉不见了,你知道为什么吗?用两个化学方程式表示出来。
生锈铁钉消失的原因:
Fe2O3+6HCl == 2FeCl3+ 3H2O
Fe + 2HCl ==FeCl2 + H2↑
挑战自我
4.某学生实验时,不小心将稀硫酸溅到衣服上,当时他认为不是浓硫酸没什么大问题。但不久,发现衣服上出现了几个小洞,这是因为 。
随着水分的蒸发,稀硫酸变成了浓硫酸
5.实验室里的一瓶蒸馏水和一瓶稀盐酸丢失了标签,你能帮老师把它们鉴别出来吗?你有哪些好方法?
用紫色石蕊试液
用镁条(或其它活泼金属)
用生锈铁钉
用碳酸钙
挑战自我
6.写出下列化学方程式:
(1)Fe2O3+ H2SO4== ;
(2)CuO+H2SO4== ;
(3) NaOH+H2SO4== ;
(4) HCl+Na2CO3== 。
Fe2(SO4)3 + 3H2O
3
CuSO4 + H2O
Na2SO4+ 2H2O
2
2
2NaCl + H2O+CO2↑
挑战自我
作业布置
实验室有两瓶失去标签的无色液体,体积都是500mL。老师告诉小明:其中一瓶是浓盐酸,一瓶是浓硫酸,并请小明帮忙为它们重新贴上标签,小明很快就完成了。你想,小明可能用什么方法区分开二者的?
再见!
同课章节目录
- 第七单元 常见的酸和碱
- 第一节 酸及其性质
- 第二节 碱及其性质
- 第三节 溶液的酸碱性
- 第四节 酸碱中和反应
- 到实验室去:探究酸和碱的化学性质
- 第八单元 海水中的化学
- 第一节 海洋化学资源
- 第二节 海水“晒盐“
- 第三节 海水“制碱“
- 到实验室去:粗盐中难溶性杂质的去除
- 第九单元 金属
- 第一节 常见的金属材料
- 第二节 金属的化学性质
- 第三节 钢铁的锈蚀与防护
- 到实验室去 探究金属的性质
- 第十单元 化学与健康
- 第一节 食物中的有机物
- 第二节 化学元素与人体健康
- 第三节 远离有毒物质
- 第十一单元 化学与社会发展
- 第一节 化学与能源开发
- 第二节 化学与材料研制
- 第三节 化学与农业生产
- 第四节 化学与环境保护
