苏教化学必修2专题1第一单元 原子核外电子排布与元素周期律(共17张PPT)
文档属性
| 名称 | 苏教化学必修2专题1第一单元 原子核外电子排布与元素周期律(共17张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 1.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-02-23 16:06:06 | ||
图片预览




文档简介
(共17张PPT)
专题1 微观结构与物质的多样性
第一单元 原子核外电子排布
与元素周期律
复习回顾:
原子由哪些微粒构成?
一:原子的结构
核电荷数=质子数=核外电子数
由上可见:整个原子呈
电中性
质量数(A)= 质子数(Z)+ 中子数(N)
检测反馈:
A
A:质量数
Z:质子数
n:原子个数
c:电荷数
d: 化合价
(2) 在原子中:核电荷数=质子数(Z)=电子数
小结:涉及的等式:
(1) 质量数(A)= 质子数(Z)+ 中子数(N)
(3)阳离子:
(4)阴离子:
核外电子数= 质子数 - 所带电荷数
核外电子数= 质子数 + 所带电荷数
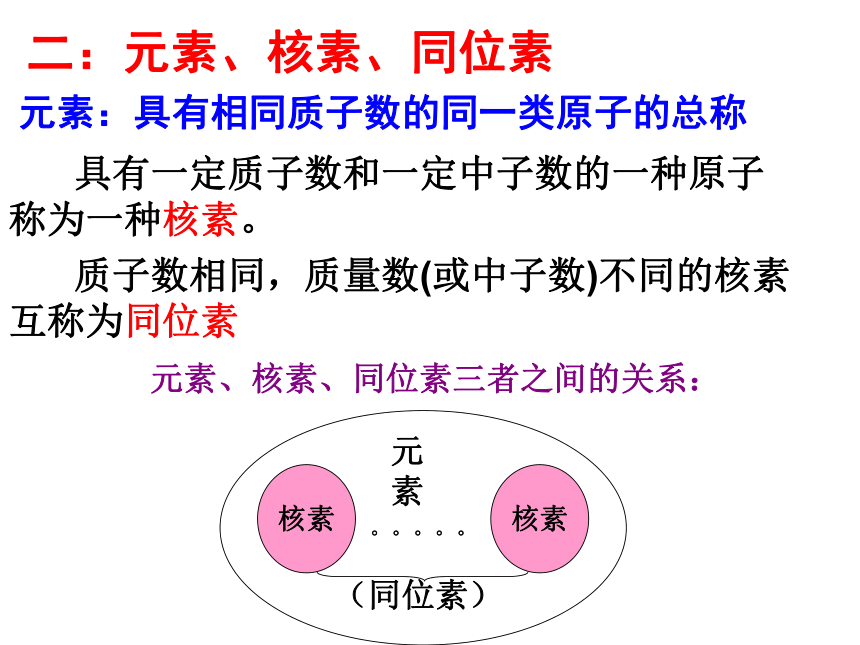
元素:具有相同质子数的同一类原子的总称
具有一定质子数和一定中子数的一种原子称为一种核素。
质子数相同,质量数(或中子数)不同的核素互称为同位素
二:元素、核素、同位素
元素、核素、同位素三者之间的关系:
K L M N O P Q
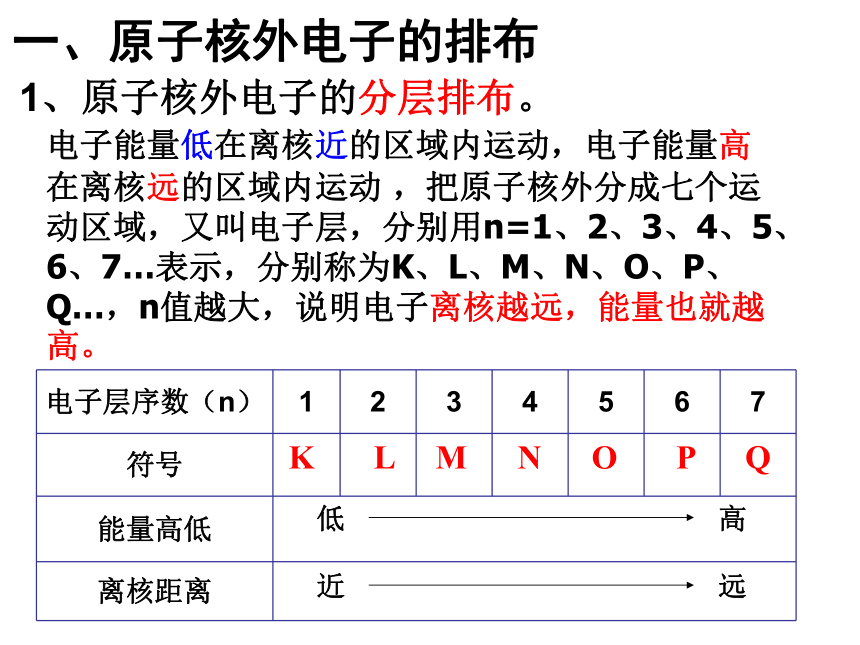
电子能量低在离核近的区域内运动,电子能量高在离核远的区域内运动?,把原子核外分成七个运动区域,又叫电子层,分别用n=1、2、3、4、5、6、7…表示,分别称为K、L、M、N、O、P、Q…,n值越大,说明电子离核越远,能量也就越高。
一、原子核外电子的排布
1、原子核外电子的分层排布。
电子层序数(n) 1 2 3 4 5 6 7
符号
能量高低
离核距离
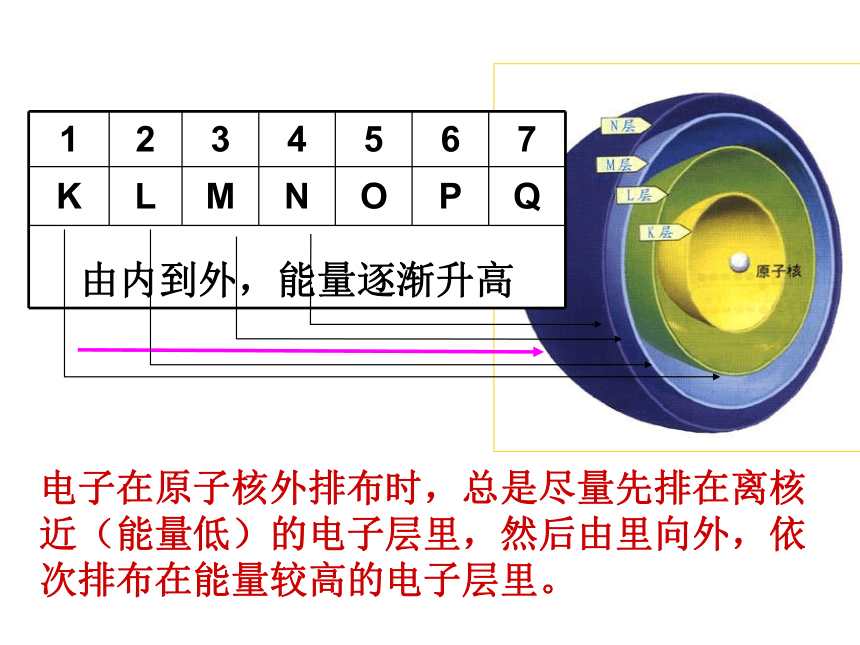
电子在原子核外排布时,总是尽量先排在离核近(能量低)的电子层里,然后由里向外,依次排布在能量较高的电子层里。
1 2 3 4 5 6 7
K L M N O P Q
由内到外,能量逐渐升高
表1—1 稀有气体元素原子核外电子排布
1.从稀有气体元素的原子核外电子排布可知,K、L、M、N电子层最多能容纳的电子数依次是多少?请由此推出原子核外各电子层最多能容纳的电子数和电子层序数n的关系.
2.各稀有气体元素原子中最外电子层最多能容纳的电子数是多少?次外电子层最多能容纳的电子数是多少?
2 8 18 32
2
8
8
8
8
8
2n2
核电荷数 元素名称 元素符号 各电子层的电子数
K L M N O P 最外层电子数
2 氦 He 2
10 氖 Ne 2 8
18 氩 Ar 2 8 8
36 氪 Kr 2 8 18 8
54 氙 Xe 2 8 18 18 8
86 氡 Rn 2 8 18 32 18 8
各层最多电子数
2、原子核外电子排布规律
①?能量最低原理:先排K层,排满K层后再排L层.
②每个电子层最多只能容纳2n2个电子。
③ 最外层最多容纳 8个电子(K为最外层为2个)
次外层最多容纳18个电子(K为次外层为2个
倒数第三层最多容纳32个电子)
注意:多条规律必须同时兼顾。
为了形象地表示原子的结构,人们就创造了“原子结构示意图”这种特殊的图形。
15
第1层
第2层
第3层
K层
L层
M层
2
8
5
二:原子结构示意图
+
电子离核越远,能量也就越高。
根据原子光谱和理论分析
核电荷数为1~18的元素原子核外电子层排布
思考:请你画出硫离子、钠离子的结构示意图
最外层电子数决定化学性质
原子核外电子的排布
分层的排布
排
布
的
规
律
由于电子能量的不同而分层排布,由近到远,由能量低到能量高。
1.能量由低到高;
2.每层最多容纳电子数目是2n2。
3.最外层电子数目不超过8个,K层为最外层时不超过2个。
4.次外层电子数目不超过18个,
[课堂小结]
课堂练习
1.下列原子结构示意图中,正确的是:
2.某元素原子的原子核外有三个电子层,最外层有4个电子,该原子核内的质子数为:
A.14 B.15 C.16 D.17
B
A
课堂练习
3.根据下列叙述,写出元素名称并画出原子结构示意图。
(1)A元素原子核外M层电子数是L层电子数的1/2;___________
(2)B元素原子的最外层电子数是次外层电子数的1.5倍;_____
(3)C元素的次外层电子数是最外层电子数的1/4;________
硅
硼
氖
课堂练习
4.A元素原子M层上有6个电子,B元素原子的核外电子总数比A元素原子的少5个,
(1)画出A元素的原子结构示意图;
(2)A、B两元素形成化合物的化学式。
Na2S
补充练习
有V、W、X、Y、Z五种元素,它们的核电荷数依次增大,且均小于20,其中X、Z是金属元素,V和Z元素原子的最外层都只有一个电子,W和Y元素原子的最外层电子数相等,且W元素原子L层电子数是K层电子数的3倍,X元素原子的最外层电子数是Y元素原子最外层电子数的一半。由此可推知(填元素符号):
V是____W是____X是_____Y是____Z是___
答案:H、O、Al、S、K
布置作业:
1.在作业本上默写1-20号元素的名称、元素符号以及原子结构示意图。
专题1 微观结构与物质的多样性
第一单元 原子核外电子排布
与元素周期律
复习回顾:
原子由哪些微粒构成?
一:原子的结构
核电荷数=质子数=核外电子数
由上可见:整个原子呈
电中性
质量数(A)= 质子数(Z)+ 中子数(N)
检测反馈:
A
A:质量数
Z:质子数
n:原子个数
c:电荷数
d: 化合价
(2) 在原子中:核电荷数=质子数(Z)=电子数
小结:涉及的等式:
(1) 质量数(A)= 质子数(Z)+ 中子数(N)
(3)阳离子:
(4)阴离子:
核外电子数= 质子数 - 所带电荷数
核外电子数= 质子数 + 所带电荷数
元素:具有相同质子数的同一类原子的总称
具有一定质子数和一定中子数的一种原子称为一种核素。
质子数相同,质量数(或中子数)不同的核素互称为同位素
二:元素、核素、同位素
元素、核素、同位素三者之间的关系:
K L M N O P Q
电子能量低在离核近的区域内运动,电子能量高在离核远的区域内运动?,把原子核外分成七个运动区域,又叫电子层,分别用n=1、2、3、4、5、6、7…表示,分别称为K、L、M、N、O、P、Q…,n值越大,说明电子离核越远,能量也就越高。
一、原子核外电子的排布
1、原子核外电子的分层排布。
电子层序数(n) 1 2 3 4 5 6 7
符号
能量高低
离核距离
电子在原子核外排布时,总是尽量先排在离核近(能量低)的电子层里,然后由里向外,依次排布在能量较高的电子层里。
1 2 3 4 5 6 7
K L M N O P Q
由内到外,能量逐渐升高
表1—1 稀有气体元素原子核外电子排布
1.从稀有气体元素的原子核外电子排布可知,K、L、M、N电子层最多能容纳的电子数依次是多少?请由此推出原子核外各电子层最多能容纳的电子数和电子层序数n的关系.
2.各稀有气体元素原子中最外电子层最多能容纳的电子数是多少?次外电子层最多能容纳的电子数是多少?
2 8 18 32
2
8
8
8
8
8
2n2
核电荷数 元素名称 元素符号 各电子层的电子数
K L M N O P 最外层电子数
2 氦 He 2
10 氖 Ne 2 8
18 氩 Ar 2 8 8
36 氪 Kr 2 8 18 8
54 氙 Xe 2 8 18 18 8
86 氡 Rn 2 8 18 32 18 8
各层最多电子数
2、原子核外电子排布规律
①?能量最低原理:先排K层,排满K层后再排L层.
②每个电子层最多只能容纳2n2个电子。
③ 最外层最多容纳 8个电子(K为最外层为2个)
次外层最多容纳18个电子(K为次外层为2个
倒数第三层最多容纳32个电子)
注意:多条规律必须同时兼顾。
为了形象地表示原子的结构,人们就创造了“原子结构示意图”这种特殊的图形。
15
第1层
第2层
第3层
K层
L层
M层
2
8
5
二:原子结构示意图
+
电子离核越远,能量也就越高。
根据原子光谱和理论分析
核电荷数为1~18的元素原子核外电子层排布
思考:请你画出硫离子、钠离子的结构示意图
最外层电子数决定化学性质
原子核外电子的排布
分层的排布
排
布
的
规
律
由于电子能量的不同而分层排布,由近到远,由能量低到能量高。
1.能量由低到高;
2.每层最多容纳电子数目是2n2。
3.最外层电子数目不超过8个,K层为最外层时不超过2个。
4.次外层电子数目不超过18个,
[课堂小结]
课堂练习
1.下列原子结构示意图中,正确的是:
2.某元素原子的原子核外有三个电子层,最外层有4个电子,该原子核内的质子数为:
A.14 B.15 C.16 D.17
B
A
课堂练习
3.根据下列叙述,写出元素名称并画出原子结构示意图。
(1)A元素原子核外M层电子数是L层电子数的1/2;___________
(2)B元素原子的最外层电子数是次外层电子数的1.5倍;_____
(3)C元素的次外层电子数是最外层电子数的1/4;________
硅
硼
氖
课堂练习
4.A元素原子M层上有6个电子,B元素原子的核外电子总数比A元素原子的少5个,
(1)画出A元素的原子结构示意图;
(2)A、B两元素形成化合物的化学式。
Na2S
补充练习
有V、W、X、Y、Z五种元素,它们的核电荷数依次增大,且均小于20,其中X、Z是金属元素,V和Z元素原子的最外层都只有一个电子,W和Y元素原子的最外层电子数相等,且W元素原子L层电子数是K层电子数的3倍,X元素原子的最外层电子数是Y元素原子最外层电子数的一半。由此可推知(填元素符号):
V是____W是____X是_____Y是____Z是___
答案:H、O、Al、S、K
布置作业:
1.在作业本上默写1-20号元素的名称、元素符号以及原子结构示意图。
