人教版选修5课件 第2章 第1节 脂肪烃 第2课时 炔烃 脂肪烃的来源及其应用(25张)
文档属性
| 名称 | 人教版选修5课件 第2章 第1节 脂肪烃 第2课时 炔烃 脂肪烃的来源及其应用(25张) |

|
|
| 格式 | zip | ||
| 文件大小 | 275.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-02-23 00:00:00 | ||
图片预览








文档简介
课件25张PPT。第 2 课时炔烃脂肪烃的来源及其应用一、炔烃碳碳三键CnH2n-2 1.炔烃的概念及通式
分子里含有_____________的一类脂肪烃称为炔烃。通式为
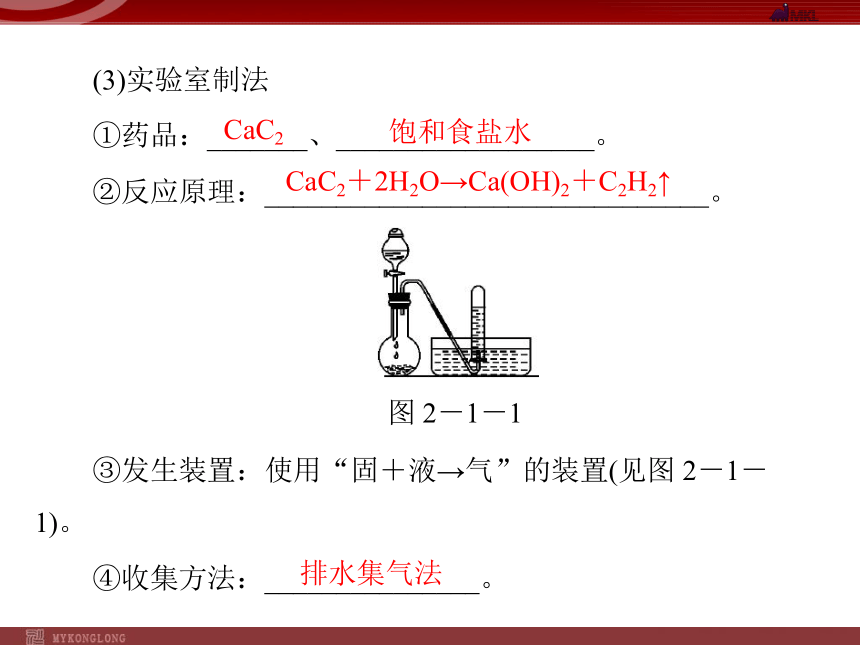
____________。2.乙炔H∶C??C∶HH—C≡C—H(1)分子组成和结构HC≡CH直线(2)物理性质无色无味微易(3)实验室制法CaC2饱和食盐水①药品:_______、__________________。
②反应原理:_______________________________。
图 2-1-1
③发生装置:使用“固+液→气”的装置(见图 2-1-1)。CaC2+2H2O→Ca(OH)2+C2H2↑④收集方法:_______________。排水集气法(4)化学性质明亮浓烟含碳量高 ①氧化反应
a.燃烧:乙炔燃烧时,火焰________并伴有_________,
这是由于乙炔___________________的缘故。燃烧的化学方程式为______________________________。b.乙炔易被氧化剂氧化,如使酸性 KMnO4 溶液褪色。②加成反应
a.使溴的 CCl4 溶液褪色CH≡CH+Br2→_______________;CHBrCHBrCHBr2CHBr2CH≡CH+2Br2→______________。
b.与 H2 加成CH≡CH+H2CH2CH2CH≡CH+2H2CH3—CH3c.与 HCl 加成CH≡CH+HClCH2CHCl_________________;_________________。__________________。二、脂肪烃的来源及其应用1.来源石油天然气 (1)脂肪烃的来源有________、__________、_____等。
(2)石油通过常压分馏可以得到石油气、汽油、________、
________等;而减压分馏可以得到滑润油、________等相对分
子质量较大的烷烃;通过石油的催化裂化及裂解可以得到较多
的轻质油和______________;催化重整是获得__________的主要途径。气态烯烃芳香烃2.应用:燃料、化工原料。煤煤油柴油石蜡乙烷、乙烯、乙炔的比较续表续表实验室制取乙炔的注意事项1.因电石与水反应很剧烈,应选用分液漏斗,以便控制水的流速。 2.为获得平稳的乙炔气流,常用饱和食盐水代替水。
3.不能用启普发生器制取乙炔。因该反应剧烈,放出大量
的热,会损坏启普发生器,且生成的 Ca(OH)2 是糊状物,会堵
塞反应容器,使水面难以升降。 4.由于电石制得的乙炔中往往含有 H2S、NH3 等杂质,使
混合气体通过盛有 CuSO4 溶液的洗气瓶可使杂质除去。 炔烃的性质
【例 1】下列有关乙炔性质的叙述中,既不同于乙烯又不同于乙烷的是()。A.能燃烧生成二氧化碳和水
B.能发生加成反应
C.能与酸性高锰酸钾溶液发生氧化反应
D.能与氯化氢反应生成氯乙烯 【解析】乙炔、乙烯、乙烷都能燃烧生成二氧化碳和水;
乙炔、乙烯都能与溴水发生加成反应;乙炔、乙烯都能与酸性
KMnO4 溶液发生氧化反应;只有乙炔可与 HCl 发生加成反应生
成氯乙烯。
【答案】D1.既可以鉴别乙烷和乙炔,又可以除去乙烷中含有的乙炔的方法是()。A.通入足量的溴的四氯化碳溶液
B.与足量的氢氧化钠溶液反应
C.点燃
D.在一定条件下与氢气加成 解析:A 项,乙烷不能与溴反应,乙炔能与溴反应生成
CHBr2CHBr2 而被吸收,A 正确;乙烷、乙炔都不能与 NaOH
溶液反应,二者点燃时都能燃烧,B、C 项均错误;D 项,乙炔
与氢气反应条件要求高,且会引入新的杂质氢气,D 项错误。答案:A2.用乙炔为原料制取 CH2Br—CHBrCl,可行的反应途径是()。DA.先加 Cl2,再加 Br2
B.先加 Cl2,再加 HBr
C.先加 HCl,再加 HBr
D.先加 HCl,再加 Br2乙炔的实验室制备 【例 2】用电石制备的乙炔气体中常混有少量 H2S 气体。
请用图 2-1-2 中的仪器和药品组成一套制备、净化、验证乙
炔性质的装置,并通过测定乙炔的量,从而计算电石的纯度。图 2-1-2 (1)进行实验时,所制气体从左向右的流向,仪器的正确连
接顺序是_________________________________(填接口字母)。
(2)为了使实验中气流平稳,甲中分液漏斗里的液体 X 通常用__________________。 (3)若在标准状况下溴水与乙炔完全反应生成 C2H2Br4,已
知称取电石 m g,测得量筒内液体体积为 V mL,则电石纯度可
表示为______________________。 (4) 若没有除 H2S 的装置,测定结果将会______( 填“偏
高”、“偏低”或“不变”),理由是______________________
_____________________________________________________。 【解析】电石与足量水反应生成乙炔,其中混有的 H2S 可
用 NaOH 溶液吸收,乙炔气体被溴水吸收后剩余部分通过排水
法测量体积。若无除 H2S 装置,则排出水的体积偏大,计算出
的结果偏高。设电石中 CaC2 的物质的量为 x。【答案】(1)A→G→H→E→F→D→C→B
(2)饱和 NaCl 溶液(3)
(4)偏高若没有除 H2S 的装置,其中的 H2S 会与 Br2 发生反应,消耗部分 Br2,使得排水法测得的乙炔体积增大,而在计
算中将与 H2S 反应掉的 Br2 忽略,使得计算结果偏高 A.为了加快反应速率可用饱和食盐水代替水反应
B.此反应是放热反应
C.为了除去杂质气体,除了用硫酸铜溶液外还可用氢氧
化钠溶液
D.反应中不需要加碎瓷片或沸石
解析:由于 CaC2 与 H2O 反应太剧烈,为减缓反应速率,
主要措施有:以饱和食盐水代替水;通过分液漏斗向反应器中
滴加饱和食盐水。A 4.在室温和大气压强下,用图 2-1-3 所示的装置进行实
验,测得 a g 含 CaC2 90%的样品与水完全反应产生的气体体积
为 b L。现欲在相同条件下,测定某电石试样中 CaC2 的质量分
数,请回答下列问题:图 2-1-3 (1)CaC2 与水反应的化学方程式是____________________。
(2)若反应刚结束时,观察到的实验现象如图 2-1-3 所示,
这时不能立即取出导气管,理由是________________________
_______________________________________________。
(3)本实验中测量气体体积时应注意到的事项有________
_______________________________________________。
(4)如果电石试样质量为 c g。测得气体体积为 d L,则电石
试样中 CaC2 的质量分数计算式 w(CaC2)=_______________。
(杂质所生成的气体体积忽略不计)b×c 答案:(1)CaC2+2H2O→Ca(OH)2+C2H2↑
(2)因为装置内气体的温度没有恢复到室温,气体压强还不
等于大气压强
(3)待装置内气体的温度恢复到室温后,调节量筒使其内外
液面持平 a×d
(4)×90%
分子里含有_____________的一类脂肪烃称为炔烃。通式为
____________。2.乙炔H∶C??C∶HH—C≡C—H(1)分子组成和结构HC≡CH直线(2)物理性质无色无味微易(3)实验室制法CaC2饱和食盐水①药品:_______、__________________。
②反应原理:_______________________________。
图 2-1-1
③发生装置:使用“固+液→气”的装置(见图 2-1-1)。CaC2+2H2O→Ca(OH)2+C2H2↑④收集方法:_______________。排水集气法(4)化学性质明亮浓烟含碳量高 ①氧化反应
a.燃烧:乙炔燃烧时,火焰________并伴有_________,
这是由于乙炔___________________的缘故。燃烧的化学方程式为______________________________。b.乙炔易被氧化剂氧化,如使酸性 KMnO4 溶液褪色。②加成反应
a.使溴的 CCl4 溶液褪色CH≡CH+Br2→_______________;CHBrCHBrCHBr2CHBr2CH≡CH+2Br2→______________。
b.与 H2 加成CH≡CH+H2CH2CH2CH≡CH+2H2CH3—CH3c.与 HCl 加成CH≡CH+HClCH2CHCl_________________;_________________。__________________。二、脂肪烃的来源及其应用1.来源石油天然气 (1)脂肪烃的来源有________、__________、_____等。
(2)石油通过常压分馏可以得到石油气、汽油、________、
________等;而减压分馏可以得到滑润油、________等相对分
子质量较大的烷烃;通过石油的催化裂化及裂解可以得到较多
的轻质油和______________;催化重整是获得__________的主要途径。气态烯烃芳香烃2.应用:燃料、化工原料。煤煤油柴油石蜡乙烷、乙烯、乙炔的比较续表续表实验室制取乙炔的注意事项1.因电石与水反应很剧烈,应选用分液漏斗,以便控制水的流速。 2.为获得平稳的乙炔气流,常用饱和食盐水代替水。
3.不能用启普发生器制取乙炔。因该反应剧烈,放出大量
的热,会损坏启普发生器,且生成的 Ca(OH)2 是糊状物,会堵
塞反应容器,使水面难以升降。 4.由于电石制得的乙炔中往往含有 H2S、NH3 等杂质,使
混合气体通过盛有 CuSO4 溶液的洗气瓶可使杂质除去。 炔烃的性质
【例 1】下列有关乙炔性质的叙述中,既不同于乙烯又不同于乙烷的是()。A.能燃烧生成二氧化碳和水
B.能发生加成反应
C.能与酸性高锰酸钾溶液发生氧化反应
D.能与氯化氢反应生成氯乙烯 【解析】乙炔、乙烯、乙烷都能燃烧生成二氧化碳和水;
乙炔、乙烯都能与溴水发生加成反应;乙炔、乙烯都能与酸性
KMnO4 溶液发生氧化反应;只有乙炔可与 HCl 发生加成反应生
成氯乙烯。
【答案】D1.既可以鉴别乙烷和乙炔,又可以除去乙烷中含有的乙炔的方法是()。A.通入足量的溴的四氯化碳溶液
B.与足量的氢氧化钠溶液反应
C.点燃
D.在一定条件下与氢气加成 解析:A 项,乙烷不能与溴反应,乙炔能与溴反应生成
CHBr2CHBr2 而被吸收,A 正确;乙烷、乙炔都不能与 NaOH
溶液反应,二者点燃时都能燃烧,B、C 项均错误;D 项,乙炔
与氢气反应条件要求高,且会引入新的杂质氢气,D 项错误。答案:A2.用乙炔为原料制取 CH2Br—CHBrCl,可行的反应途径是()。DA.先加 Cl2,再加 Br2
B.先加 Cl2,再加 HBr
C.先加 HCl,再加 HBr
D.先加 HCl,再加 Br2乙炔的实验室制备 【例 2】用电石制备的乙炔气体中常混有少量 H2S 气体。
请用图 2-1-2 中的仪器和药品组成一套制备、净化、验证乙
炔性质的装置,并通过测定乙炔的量,从而计算电石的纯度。图 2-1-2 (1)进行实验时,所制气体从左向右的流向,仪器的正确连
接顺序是_________________________________(填接口字母)。
(2)为了使实验中气流平稳,甲中分液漏斗里的液体 X 通常用__________________。 (3)若在标准状况下溴水与乙炔完全反应生成 C2H2Br4,已
知称取电石 m g,测得量筒内液体体积为 V mL,则电石纯度可
表示为______________________。 (4) 若没有除 H2S 的装置,测定结果将会______( 填“偏
高”、“偏低”或“不变”),理由是______________________
_____________________________________________________。 【解析】电石与足量水反应生成乙炔,其中混有的 H2S 可
用 NaOH 溶液吸收,乙炔气体被溴水吸收后剩余部分通过排水
法测量体积。若无除 H2S 装置,则排出水的体积偏大,计算出
的结果偏高。设电石中 CaC2 的物质的量为 x。【答案】(1)A→G→H→E→F→D→C→B
(2)饱和 NaCl 溶液(3)
(4)偏高若没有除 H2S 的装置,其中的 H2S 会与 Br2 发生反应,消耗部分 Br2,使得排水法测得的乙炔体积增大,而在计
算中将与 H2S 反应掉的 Br2 忽略,使得计算结果偏高 A.为了加快反应速率可用饱和食盐水代替水反应
B.此反应是放热反应
C.为了除去杂质气体,除了用硫酸铜溶液外还可用氢氧
化钠溶液
D.反应中不需要加碎瓷片或沸石
解析:由于 CaC2 与 H2O 反应太剧烈,为减缓反应速率,
主要措施有:以饱和食盐水代替水;通过分液漏斗向反应器中
滴加饱和食盐水。A 4.在室温和大气压强下,用图 2-1-3 所示的装置进行实
验,测得 a g 含 CaC2 90%的样品与水完全反应产生的气体体积
为 b L。现欲在相同条件下,测定某电石试样中 CaC2 的质量分
数,请回答下列问题:图 2-1-3 (1)CaC2 与水反应的化学方程式是____________________。
(2)若反应刚结束时,观察到的实验现象如图 2-1-3 所示,
这时不能立即取出导气管,理由是________________________
_______________________________________________。
(3)本实验中测量气体体积时应注意到的事项有________
_______________________________________________。
(4)如果电石试样质量为 c g。测得气体体积为 d L,则电石
试样中 CaC2 的质量分数计算式 w(CaC2)=_______________。
(杂质所生成的气体体积忽略不计)b×c 答案:(1)CaC2+2H2O→Ca(OH)2+C2H2↑
(2)因为装置内气体的温度没有恢复到室温,气体压强还不
等于大气压强
(3)待装置内气体的温度恢复到室温后,调节量筒使其内外
液面持平 a×d
(4)×90%
