单元2几种常见的酸和碱课件(19张PPT)
文档属性
| 名称 | 单元2几种常见的酸和碱课件(19张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 156.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 仁爱科普版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-02-23 00:00:00 | ||
图片预览



文档简介
(共19张PPT)
单元2 几种常见的酸和碱
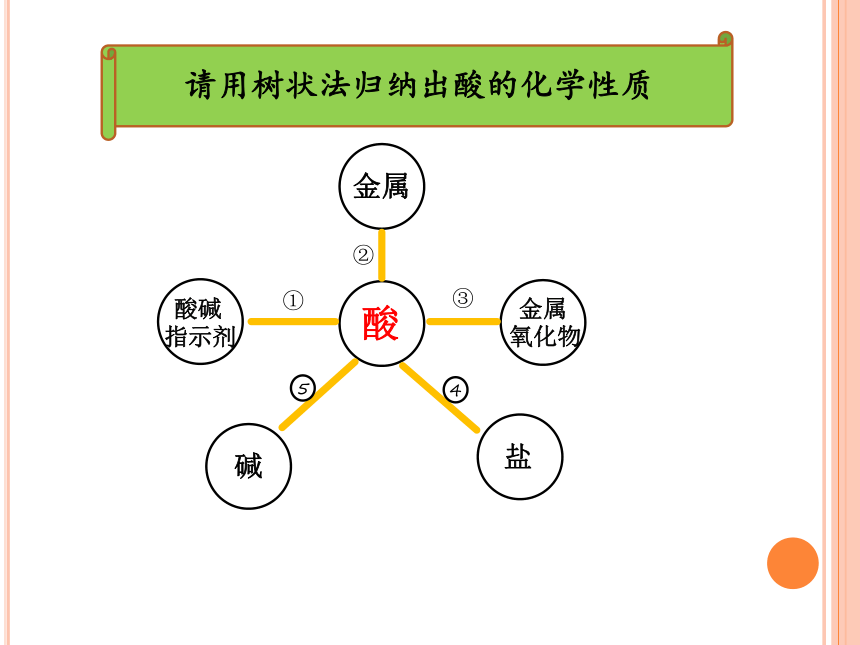
请用树状法归纳出酸的化学性质
酸
金属
酸碱
指示剂
金属
氧化物
盐
碱
①
②
③
4
5
学习目标
1、通过实验探究,掌握碱的化学性质,了解保存方法及其用途。
2、会运用碱的化学性质解释常见的现象。
交 流 展 示
题号 组号
展示一:
展示二:
展示三:
展示四:
展 板
碱的化学性质1
(1)实验探究1:用两只试管各取氢氧化钠溶液各3ml,分别向其中滴加2~3滴无色酚酞溶液和紫色石蕊溶液,记录实验现象。
现象:氢氧化钠溶液能使无色酚酞溶液变 色;使紫色石蕊溶液变 色;
碱的化学性1: 。
红
蓝
碱能使酸碱指示剂显示不同的颜色。
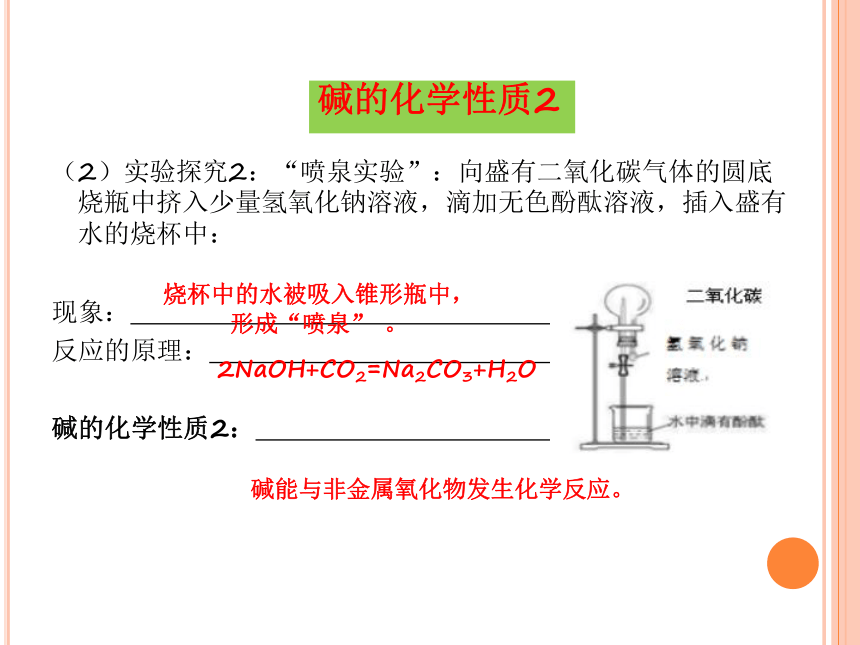
(2)实验探究2:“喷泉实验”:向盛有二氧化碳气体的圆底烧瓶中挤入少量氢氧化钠溶液,滴加无色酚酞溶液,插入盛有水的烧杯中:
现象: ;
反应的原理: ;
碱的化学性质2: 。
?
碱的化学性质2
烧杯中的水被吸入锥形瓶中,形成“喷泉” 。
2NaOH+CO2=Na2CO3+H2O
碱能与非金属氧化物发生化学反应。
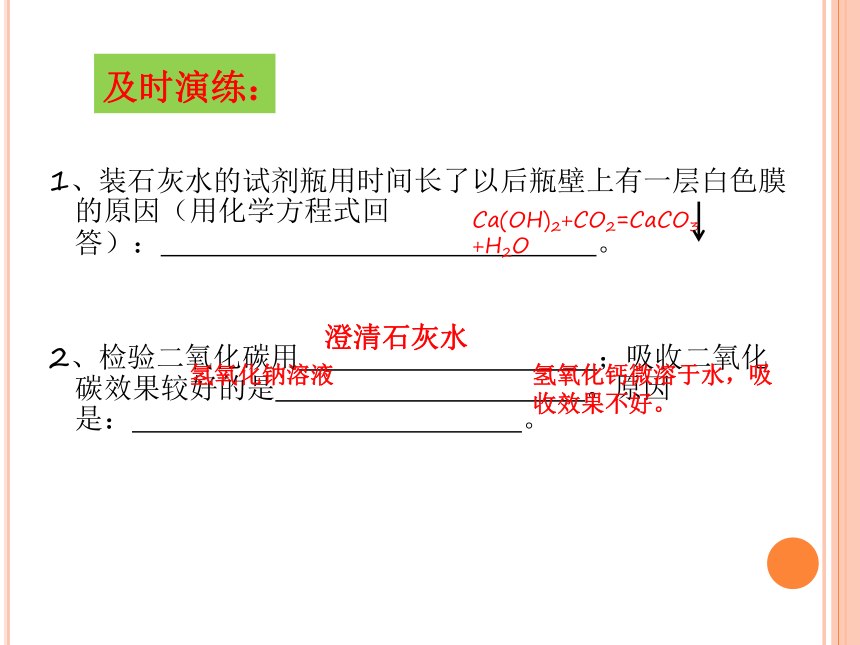
及时演练:
1、装石灰水的试剂瓶用时间长了以后瓶壁上有一层白色膜的原因(用化学方程式回答): 。
2、检验二氧化碳用 ;吸收二氧化碳效果较好的是 。原因是: 。
Ca(OH)2+CO2=CaCO3 +H2O
澄清石灰水
氢氧化钠溶液
氢氧化钙微溶于水,吸收效果不好。
(3)碱的化学性质3:碱能与酸反应(酸+碱=盐+水)例如:(写出相应的化学方程式)
; 。
碱的化学性质3
NaOH+HCl=NaCl+H2O
2KOH+H2SO4=K2SO4+2H2O
实验探究3:先用一支试管取3ml的氢氧化钠溶液,再向试管中滴加少量硫酸铜溶液,记录实验现象;实验探究4:另一支试管中取3ml的澄清石灰水,再向试管中滴加少量碳酸钠溶液,记录实验现象。
碱的化学性质4: 。
碱的化学性质4
实验 现象 化学方程式
实验探究3 2NaOH+CuSO4=Cu(OH)2↓+ ;
实验探究4 Ca(OH)2+Na2CO3= + 。
有蓝色沉淀生成,溶液由蓝色变为无色。
Na2SO4
有白色沉淀生成
2NaOH
CaCO3
碱与盐反应生成新碱与新盐
知识点二:碱的性质归纳及其应用
请用图形总结归纳碱的化学性质:
课堂检测
课堂练习:
1、下列各物质的名称、俗名和化学性质一致的是( )
A、银、水银、Ag
B、氧化钙、熟石灰、CaO
C、氢氧化钙、消石灰、Ca(OH)2
D、氢氧化钠、纯碱、NaOH
C
2、下列有关熟石灰的说法错误的是( )
A.熟石灰又称为消石灰
B.熟石灰由生石灰与水反应而制得
C.熟石灰的溶解度随温度的升高而增大
D.熟石灰可以用来改良酸性土壤
C
3、下列变化属于物理变化的是:( )
A、石灰浆抹墙后,墙壁发硬;
B、酚酞溶液遇碱性溶液变为红色;
C、用苛性钠干燥O2、N2等;
D、用生石灰制熟石灰。
C
4、(多项选择)下列物质在空气中敞口放置一段时间后,因发生化学变化而使质量增加的是( )
A、生石灰 B、浓盐酸
C、固体氢氧化钠 D、浓硫酸
AC
5、实验室干燥二氧化碳时应选用的干燥剂是( )
A、生石灰 B、氢氧化钠固体
C、浓硫酸 D、稀硫酸
C
4、酸、碱、盐在生活、生产中应用广泛,使用时必须十分小心,氢氧化钠具有强烈的________,实验时最好戴防护眼镜,为了便于理解和记忆,小丽同学总结了碱的化学性质如图,请你根据要求完成下列问题:
(1)小丽同学发现,以前取用氢氧化钠溶液时试剂瓶忘记盖瓶塞,依据反应③说明NaOH必须密封保存,否则在空气中要变质,如果该溶液变质,则发生反应的化学方程式为__ ________________________。
(3)为了验证反应④,小丽将无色酚酞试液分别滴入NaOH溶液和澄清石灰水中,溶液由无色变成红色,原因是它们在水溶液中能电离出________。
腐蚀性
2NaOH+CO2=H2O+Na2CO3
OH-
本节课,我收获了、、、、、、
谢谢观看!
单元2 几种常见的酸和碱
请用树状法归纳出酸的化学性质
酸
金属
酸碱
指示剂
金属
氧化物
盐
碱
①
②
③
4
5
学习目标
1、通过实验探究,掌握碱的化学性质,了解保存方法及其用途。
2、会运用碱的化学性质解释常见的现象。
交 流 展 示
题号 组号
展示一:
展示二:
展示三:
展示四:
展 板
碱的化学性质1
(1)实验探究1:用两只试管各取氢氧化钠溶液各3ml,分别向其中滴加2~3滴无色酚酞溶液和紫色石蕊溶液,记录实验现象。
现象:氢氧化钠溶液能使无色酚酞溶液变 色;使紫色石蕊溶液变 色;
碱的化学性1: 。
红
蓝
碱能使酸碱指示剂显示不同的颜色。
(2)实验探究2:“喷泉实验”:向盛有二氧化碳气体的圆底烧瓶中挤入少量氢氧化钠溶液,滴加无色酚酞溶液,插入盛有水的烧杯中:
现象: ;
反应的原理: ;
碱的化学性质2: 。
?
碱的化学性质2
烧杯中的水被吸入锥形瓶中,形成“喷泉” 。
2NaOH+CO2=Na2CO3+H2O
碱能与非金属氧化物发生化学反应。
及时演练:
1、装石灰水的试剂瓶用时间长了以后瓶壁上有一层白色膜的原因(用化学方程式回答): 。
2、检验二氧化碳用 ;吸收二氧化碳效果较好的是 。原因是: 。
Ca(OH)2+CO2=CaCO3 +H2O
澄清石灰水
氢氧化钠溶液
氢氧化钙微溶于水,吸收效果不好。
(3)碱的化学性质3:碱能与酸反应(酸+碱=盐+水)例如:(写出相应的化学方程式)
; 。
碱的化学性质3
NaOH+HCl=NaCl+H2O
2KOH+H2SO4=K2SO4+2H2O
实验探究3:先用一支试管取3ml的氢氧化钠溶液,再向试管中滴加少量硫酸铜溶液,记录实验现象;实验探究4:另一支试管中取3ml的澄清石灰水,再向试管中滴加少量碳酸钠溶液,记录实验现象。
碱的化学性质4: 。
碱的化学性质4
实验 现象 化学方程式
实验探究3 2NaOH+CuSO4=Cu(OH)2↓+ ;
实验探究4 Ca(OH)2+Na2CO3= + 。
有蓝色沉淀生成,溶液由蓝色变为无色。
Na2SO4
有白色沉淀生成
2NaOH
CaCO3
碱与盐反应生成新碱与新盐
知识点二:碱的性质归纳及其应用
请用图形总结归纳碱的化学性质:
课堂检测
课堂练习:
1、下列各物质的名称、俗名和化学性质一致的是( )
A、银、水银、Ag
B、氧化钙、熟石灰、CaO
C、氢氧化钙、消石灰、Ca(OH)2
D、氢氧化钠、纯碱、NaOH
C
2、下列有关熟石灰的说法错误的是( )
A.熟石灰又称为消石灰
B.熟石灰由生石灰与水反应而制得
C.熟石灰的溶解度随温度的升高而增大
D.熟石灰可以用来改良酸性土壤
C
3、下列变化属于物理变化的是:( )
A、石灰浆抹墙后,墙壁发硬;
B、酚酞溶液遇碱性溶液变为红色;
C、用苛性钠干燥O2、N2等;
D、用生石灰制熟石灰。
C
4、(多项选择)下列物质在空气中敞口放置一段时间后,因发生化学变化而使质量增加的是( )
A、生石灰 B、浓盐酸
C、固体氢氧化钠 D、浓硫酸
AC
5、实验室干燥二氧化碳时应选用的干燥剂是( )
A、生石灰 B、氢氧化钠固体
C、浓硫酸 D、稀硫酸
C
4、酸、碱、盐在生活、生产中应用广泛,使用时必须十分小心,氢氧化钠具有强烈的________,实验时最好戴防护眼镜,为了便于理解和记忆,小丽同学总结了碱的化学性质如图,请你根据要求完成下列问题:
(1)小丽同学发现,以前取用氢氧化钠溶液时试剂瓶忘记盖瓶塞,依据反应③说明NaOH必须密封保存,否则在空气中要变质,如果该溶液变质,则发生反应的化学方程式为__ ________________________。
(3)为了验证反应④,小丽将无色酚酞试液分别滴入NaOH溶液和澄清石灰水中,溶液由无色变成红色,原因是它们在水溶液中能电离出________。
腐蚀性
2NaOH+CO2=H2O+Na2CO3
OH-
本节课,我收获了、、、、、、
谢谢观看!
