第七单元 常见的酸和碱复习课件(21张PPT)
文档属性
| 名称 | 第七单元 常见的酸和碱复习课件(21张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 8.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-02-23 21:49:39 | ||
图片预览







文档简介
(共21张PPT)
酸碱盐(第一课时)
复习课
复习目标
了解常见酸、碱的物理性质。
掌握常见酸、碱的化学性质。
能运用酸、碱的性质解决化学问题。
1
2
3
知识网络梳理
知识梳理
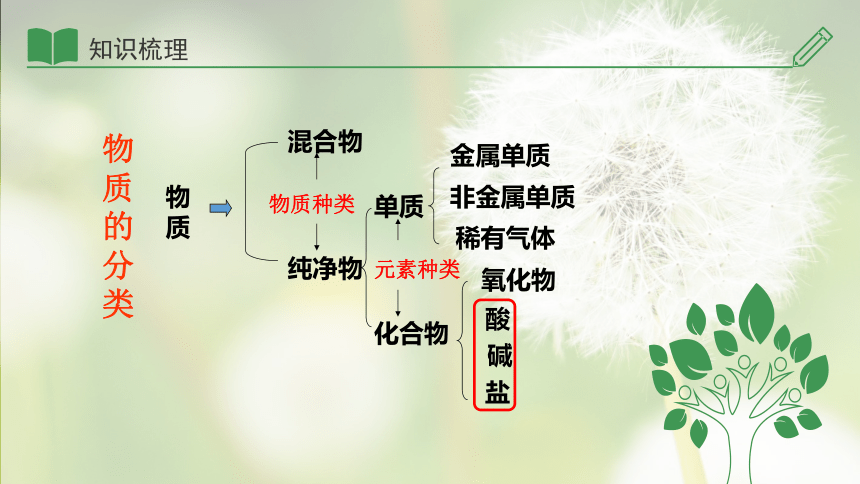
物质的分类
物质
混合物
纯净物
化合物
单质
金属单质
非金属单质
稀有气体
物质种类
元素种类
氧化物
酸
碱
盐
一、常见酸(浓盐酸、浓硫酸)
3、特性:浓盐酸 浓硫酸
1、酸的电离:
2、常见的酸
4、浓硫酸稀释
H++酸根离子
汽水(H2CO3)、胃液(HCl)
食醋(CH3COOH)
挥发性
酸入水
吸水性
知识梳理
知识梳理
二、常见的碱(氢氧化钠和氢氧化钙)
1、碱的电离:
2、氢氧化钠、氢氧化钙俗称
3、氢氧化钠、氢氧化钙溶于水:
4、可溶碱:
5、不溶碱:蓝色沉淀 红褐色沉淀
氢氧化钙溶解度随温度升高反而减小
Cu(OH)2 Fe(OH)3
金属离子(或铵根离子)+OH-
氢氧化钙:消石灰、熟石灰
氢氧化钠:烧碱、火碱、苛性钠
KOH、NaOH、Ba(OH)2、Ca(OH)2、NH3·H2O
氢氧化钠溶于水放热
思考:氢氧化钠、氢氧化钙的制备?
?
答
知识梳理
氢氧化钙:
CaCO3══CaO+CO2↑
CaO+H2O══Ca(OH)2
氢氧化钠:
Na2CO3+Ca(OH)2══CaCO3 ↓ +2NaOH
高温
知识梳理
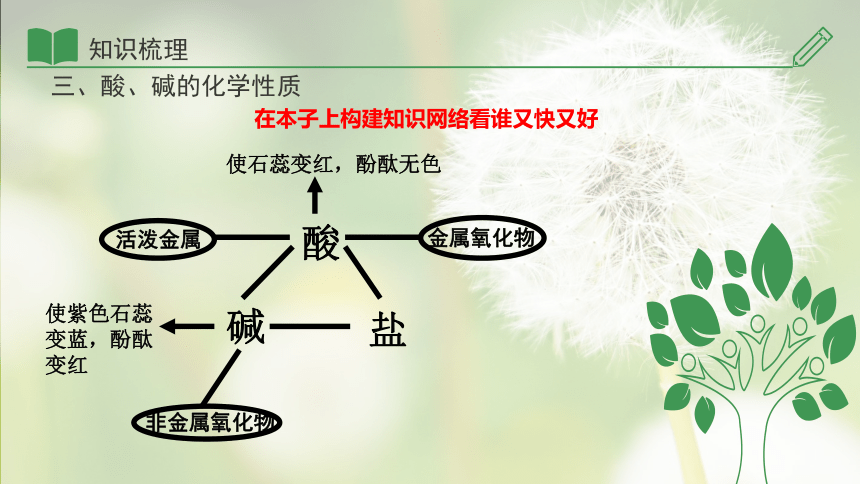
三、酸、碱的化学性质
在本子上构建知识网络看谁又快又好
使石蕊变红,酚酞无色
金属氧化物
活泼金属
使紫色石蕊变蓝,酚酞变红
非金属氧化物
酸
碱
盐
知识梳理
三、酸、碱、盐的化学性质
1、如何鉴别盐酸和硫酸
氯化钡溶液
2、如何鉴别石灰水和烧碱溶液
通入二氧化碳
加入碳酸钠溶液
重要常考考点分析
考点一 酸、碱、盐的性质
例1在盛有稀硫酸的烧杯中,分别加入下列物质,最终只存在无色液体的是( )
A.Na2CO3溶液、KCl溶液
B.BaCl2溶液、KOH溶液
C.FeSO4溶液、NaNO3溶液
D.CuO、Na2SO4溶液
A
盐酸进入迷宫遇见了很多障碍,即能与盐酸 发生反应的物质。 请帮助盐酸选择最短的安全路径走出迷宫。
H2SO4?
1 5 6
【又见迷宫】NaOH也想来穿越迷宫,请帮助NaOH选择最短的安全路径走出迷宫。
Ca(OH)2?
重要常考考点分析
考点二 碱的变质情况探究
需要掌握的知识要点:
1、变质原因
2、变质程度的三个猜想
3、对三个猜想的判定:选用的试剂,步骤、现象、结论
氢氧化钠与CO2发生了反应生成Na2CO3
2NaOH+CO2══Na2CO3+H2O
全部(Na2CO3)、部分(NaOH、Na2CO3)、没有(NaOH)
一般情况下:
先滴加过量氯化钙或氯化钡溶液 后滴加无色酚酞溶液
①白色沉淀 酚酞不变色 全部变质
②白色沉淀 酚酞变红色 部分变质
③没有明显现象 酚酞变红色 没有变质
重要常考考点分析
化学兴趣小组的同学发现,上个月做实验用的氢氧化钠溶液忘记了盖瓶盖。对于该溶液是否变质,小组内小明同学认为有两种可能:
猜想1:该溶液没有变质 猜想2:该溶液全部变质
(1)小组同学讨论后认为还有一种可能,请你补充出猜想3: 。
(2)为了验证猜想3,小红同学设计了如下实验方案,请你帮他完成实验报告的填写。
该溶液部分变质
实验步骤 实验现象 结论
取样 , 过滤 产生白色沉淀 猜想3成立
向上述滤液中滴加几滴无色酚酞溶液 .
向其中滴加过量的CaCl2(或BaCl2 )
变红
例2
重要常考考点分析
1、如何检验样品中否还有氧化钙
加水,放热,则有氧化钙
2、如何检验样品中否还有碳酸钙
加盐酸,有气泡,则有碳酸钙
3、如何检验样品中否有氢氧化钙
加水,不放热 ,加酚酞变红
考点三 氧化钙的变质情况探究
课堂练习
1.下列说法正确的是( )
A.盐酸能使紫色石蕊试液变蓝
B.浓硫酸露置于空气中,溶质质量分数变大
C.露置于空气中的固体氢氧化钠,其成分不会发生变化
D.打开浓盐酸的试剂瓶,瓶口会产生白雾
2.右图是表示在9.8g 10%的稀H2SO4中逐滴滴入10%的Ba(OH)2溶液的变化过程。下列说法正确的是( )
A.X是时间,Y是pH
B.X是水的总质量,Y是H2SO4的质量
C.X是加入Ba(OH)2溶液的质量,Y是沉淀物质的质量
D.X是加入Ba(OH)2溶液的质量,Y是溶液中溶质的质量
D
D
课堂练习
3.白蚁能分泌出蚁酸。蚁酸的化学性质与盐酸相似,能腐蚀很多物质。下列最不容易被蚁酸腐蚀的是( )
A.镀锌水管 B.铜制塑像
C.大理石栏杆 D.铝合金门窗
4.实验室许多药品都需密封保存,下列对药品密封保存原因的解释,错误的是( )
A.浓盐酸——防止挥发
B.NaOH溶液——防止与CO2反应
C.浓硫酸——防止吸水
D.生石灰——防止与氧气反应
D
B
课堂练习
5.柠檬酸(C6H8O7)是一种较强的有机酸,在水溶液中可以解离出H+,从而呈现酸性,主要用于香料或作为饮料的酸化剂。下列物质不能与柠檬酸反应的是( )
A. Mg B. Fe2O3
C. CO2 D. NaOH
6.下列实验中无明显现象的是( )
A.向H2SO4溶液中滴加Ba(OH)2溶液
B.向NaOH溶液中通入CO2
C.向滴有酚酞的NaOH溶液中滴加盐酸
D.将(NH4)2SO4和熟石灰混合研磨
B
C
课堂小结
思考:通过本节课,你学到了什么?
课后作业
请将酸、碱、盐的知识网络图补充完整
感谢聆听!
THANKS
【酸碱盐 复习公开课】
酸碱盐(第一课时)
复习课
复习目标
了解常见酸、碱的物理性质。
掌握常见酸、碱的化学性质。
能运用酸、碱的性质解决化学问题。
1
2
3
知识网络梳理
知识梳理
物质的分类
物质
混合物
纯净物
化合物
单质
金属单质
非金属单质
稀有气体
物质种类
元素种类
氧化物
酸
碱
盐
一、常见酸(浓盐酸、浓硫酸)
3、特性:浓盐酸 浓硫酸
1、酸的电离:
2、常见的酸
4、浓硫酸稀释
H++酸根离子
汽水(H2CO3)、胃液(HCl)
食醋(CH3COOH)
挥发性
酸入水
吸水性
知识梳理
知识梳理
二、常见的碱(氢氧化钠和氢氧化钙)
1、碱的电离:
2、氢氧化钠、氢氧化钙俗称
3、氢氧化钠、氢氧化钙溶于水:
4、可溶碱:
5、不溶碱:蓝色沉淀 红褐色沉淀
氢氧化钙溶解度随温度升高反而减小
Cu(OH)2 Fe(OH)3
金属离子(或铵根离子)+OH-
氢氧化钙:消石灰、熟石灰
氢氧化钠:烧碱、火碱、苛性钠
KOH、NaOH、Ba(OH)2、Ca(OH)2、NH3·H2O
氢氧化钠溶于水放热
思考:氢氧化钠、氢氧化钙的制备?
?
答
知识梳理
氢氧化钙:
CaCO3══CaO+CO2↑
CaO+H2O══Ca(OH)2
氢氧化钠:
Na2CO3+Ca(OH)2══CaCO3 ↓ +2NaOH
高温
知识梳理
三、酸、碱的化学性质
在本子上构建知识网络看谁又快又好
使石蕊变红,酚酞无色
金属氧化物
活泼金属
使紫色石蕊变蓝,酚酞变红
非金属氧化物
酸
碱
盐
知识梳理
三、酸、碱、盐的化学性质
1、如何鉴别盐酸和硫酸
氯化钡溶液
2、如何鉴别石灰水和烧碱溶液
通入二氧化碳
加入碳酸钠溶液
重要常考考点分析
考点一 酸、碱、盐的性质
例1在盛有稀硫酸的烧杯中,分别加入下列物质,最终只存在无色液体的是( )
A.Na2CO3溶液、KCl溶液
B.BaCl2溶液、KOH溶液
C.FeSO4溶液、NaNO3溶液
D.CuO、Na2SO4溶液
A
盐酸进入迷宫遇见了很多障碍,即能与盐酸 发生反应的物质。 请帮助盐酸选择最短的安全路径走出迷宫。
H2SO4?
1 5 6
【又见迷宫】NaOH也想来穿越迷宫,请帮助NaOH选择最短的安全路径走出迷宫。
Ca(OH)2?
重要常考考点分析
考点二 碱的变质情况探究
需要掌握的知识要点:
1、变质原因
2、变质程度的三个猜想
3、对三个猜想的判定:选用的试剂,步骤、现象、结论
氢氧化钠与CO2发生了反应生成Na2CO3
2NaOH+CO2══Na2CO3+H2O
全部(Na2CO3)、部分(NaOH、Na2CO3)、没有(NaOH)
一般情况下:
先滴加过量氯化钙或氯化钡溶液 后滴加无色酚酞溶液
①白色沉淀 酚酞不变色 全部变质
②白色沉淀 酚酞变红色 部分变质
③没有明显现象 酚酞变红色 没有变质
重要常考考点分析
化学兴趣小组的同学发现,上个月做实验用的氢氧化钠溶液忘记了盖瓶盖。对于该溶液是否变质,小组内小明同学认为有两种可能:
猜想1:该溶液没有变质 猜想2:该溶液全部变质
(1)小组同学讨论后认为还有一种可能,请你补充出猜想3: 。
(2)为了验证猜想3,小红同学设计了如下实验方案,请你帮他完成实验报告的填写。
该溶液部分变质
实验步骤 实验现象 结论
取样 , 过滤 产生白色沉淀 猜想3成立
向上述滤液中滴加几滴无色酚酞溶液 .
向其中滴加过量的CaCl2(或BaCl2 )
变红
例2
重要常考考点分析
1、如何检验样品中否还有氧化钙
加水,放热,则有氧化钙
2、如何检验样品中否还有碳酸钙
加盐酸,有气泡,则有碳酸钙
3、如何检验样品中否有氢氧化钙
加水,不放热 ,加酚酞变红
考点三 氧化钙的变质情况探究
课堂练习
1.下列说法正确的是( )
A.盐酸能使紫色石蕊试液变蓝
B.浓硫酸露置于空气中,溶质质量分数变大
C.露置于空气中的固体氢氧化钠,其成分不会发生变化
D.打开浓盐酸的试剂瓶,瓶口会产生白雾
2.右图是表示在9.8g 10%的稀H2SO4中逐滴滴入10%的Ba(OH)2溶液的变化过程。下列说法正确的是( )
A.X是时间,Y是pH
B.X是水的总质量,Y是H2SO4的质量
C.X是加入Ba(OH)2溶液的质量,Y是沉淀物质的质量
D.X是加入Ba(OH)2溶液的质量,Y是溶液中溶质的质量
D
D
课堂练习
3.白蚁能分泌出蚁酸。蚁酸的化学性质与盐酸相似,能腐蚀很多物质。下列最不容易被蚁酸腐蚀的是( )
A.镀锌水管 B.铜制塑像
C.大理石栏杆 D.铝合金门窗
4.实验室许多药品都需密封保存,下列对药品密封保存原因的解释,错误的是( )
A.浓盐酸——防止挥发
B.NaOH溶液——防止与CO2反应
C.浓硫酸——防止吸水
D.生石灰——防止与氧气反应
D
B
课堂练习
5.柠檬酸(C6H8O7)是一种较强的有机酸,在水溶液中可以解离出H+,从而呈现酸性,主要用于香料或作为饮料的酸化剂。下列物质不能与柠檬酸反应的是( )
A. Mg B. Fe2O3
C. CO2 D. NaOH
6.下列实验中无明显现象的是( )
A.向H2SO4溶液中滴加Ba(OH)2溶液
B.向NaOH溶液中通入CO2
C.向滴有酚酞的NaOH溶液中滴加盐酸
D.将(NH4)2SO4和熟石灰混合研磨
B
C
课堂小结
思考:通过本节课,你学到了什么?
课后作业
请将酸、碱、盐的知识网络图补充完整
感谢聆听!
THANKS
【酸碱盐 复习公开课】
同课章节目录
- 第七单元 常见的酸和碱
- 第一节 酸及其性质
- 第二节 碱及其性质
- 第三节 溶液的酸碱性
- 第四节 酸碱中和反应
- 到实验室去:探究酸和碱的化学性质
- 第八单元 海水中的化学
- 第一节 海洋化学资源
- 第二节 海水“晒盐“
- 第三节 海水“制碱“
- 到实验室去:粗盐中难溶性杂质的去除
- 第九单元 金属
- 第一节 常见的金属材料
- 第二节 金属的化学性质
- 第三节 钢铁的锈蚀与防护
- 到实验室去 探究金属的性质
- 第十单元 化学与健康
- 第一节 食物中的有机物
- 第二节 化学元素与人体健康
- 第三节 远离有毒物质
- 第十一单元 化学与社会发展
- 第一节 化学与能源开发
- 第二节 化学与材料研制
- 第三节 化学与农业生产
- 第四节 化学与环境保护
