人教版高一化学 必修二 第二章 第三节 化学反应速率与限度 课件 (共20张PPT)
文档属性
| 名称 | 人教版高一化学 必修二 第二章 第三节 化学反应速率与限度 课件 (共20张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 1.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-02-26 00:00:00 | ||
图片预览








文档简介
(共27张PPT)
必修2 化学反应速率与限度
(第一课时)
化学即来源于生活,化学必服务于生活
生活中的化学反应
反应发生过程不足0.1秒。
据统计,安全气囊在严重的碰撞事故当中能够保护约三分之一的人员生还。
10NaN3 + 2KNO3 = K2O+5Na2O + 16N2↑
生活中的化学反应
几个月
据统计一年全球因钢铁腐蚀而造成的直接经济损失,约达 7000 亿美元,远远超过自然灾害带来的损失。
生活中的化学反应
至少10亿年
在地表以下100多公里处富含碳元素的矿层,在5000MPa巨大的压力和大约1200摄氏度的环境下经过漫长的过程最终形成的钻石。广泛应用于制作首饰品,还可制成切割、钻孔、研磨等工具 。
说 说 感 想
不足0.1秒
几个月
至少10亿年
思考
如何描述化学反应的快慢?
思 考
如何改变化学反应的快慢?
哪些因素会影响化学反应的速率?
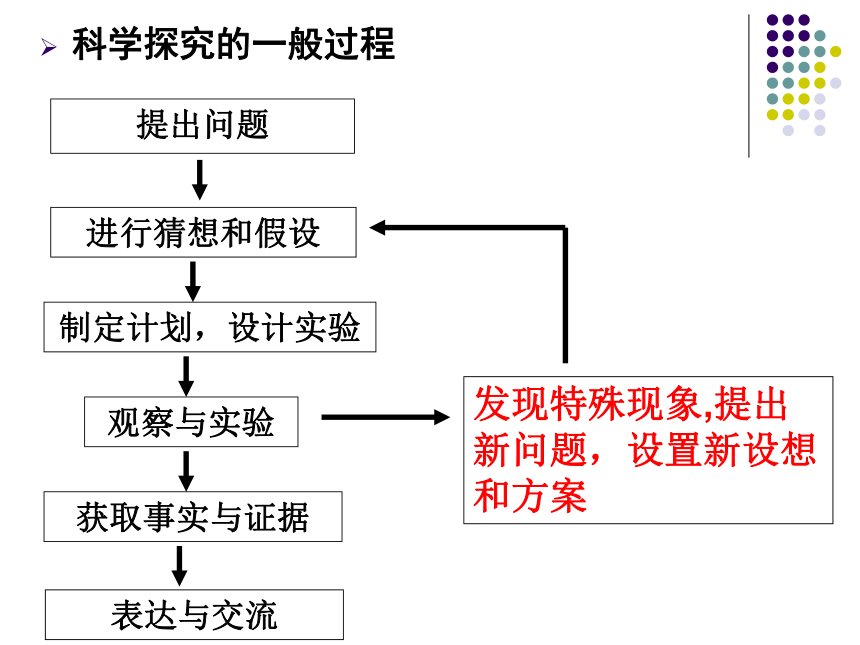
科学探究的一般过程
设计实验
实验药品:5%H2O2溶液、10%H2O2溶液、 MnO2 、
FeCl3、热水、冷水
实验仪器:试管、烧杯等
实验分组设置
分组 方 案
A组
浓度 5%H2O2溶液、10%H2O2溶液各2mL,分别滴加 3滴FeCl3溶液比较。
B组
温度 分别取2mL 5%H2O2溶液, 滴加 3滴FeCl3溶液,再分别置于冷水、热水比较。
C组
催化剂 分别取2mL 5%H2O2溶液,一份滴加3滴FeCl3溶液,另一份不滴加催化剂,对比观察。
实验注意事项
1、小组成员要明确分工:记录现象、操作、拍摄。
2、如需要使用FeCl3溶液做催化剂, 只需要3滴即可。
3、注意量取不同浓度的H2O2溶液用不同的吸管。
4、对比实验要注意操作的规范与统一性。
探 究 结 果
小组序号 调节变量(自变量) 无关变量 结 论
A 浓度 温度、催化剂 其他条件相同时,反应物浓度增加,化学反应速率加快。
B 温度 浓度、催化剂 其他条件相同时,反应物温度升高,化学反应速率加快。
C 催化剂 浓度、温度 催化剂可以改变化学反应速率。
还有哪些其他因素
接触面积
物质状态
压强
物质自身性质(内部因素)
思 考
运用知识,我们可以解决或解释生产、生活中的哪些问题?
1949年,我国年产量只有四万吨。
2003年,我国年产量已达3371.2万吨,超过美国,位居世界首位。
硫酸工业
硫酸的产量可视为一个国家工业发达水平的一种标志。
煅烧硫铁矿
硫铁矿
4FeS2+11O2 2Fe2O3+8SO2
高温
SO2转化为SO3
0.1 0.5 1 10
400 99.2 99.6 99.7 99.9
500 93.5 96.9 97.8 99.3
600 73.7 85.8 89.5 96.4
思 考 题
足量锌粒与2L 1mol/L稀硫酸反应,在不改变生成氢气总量的基础上,可采取哪些方法加快反应速率?
1、将锌粒改为锌粉
2、给稀硫酸加热
3、在不增加H+物质的量基础上,加大稀硫酸
浓度(蒸发水分)
4、使锌粒与铜片接触
5、滴加几滴硫酸铜溶液
收 获
认识了影响化学反应速率的因素;
运用科学探究的一般过程,研究我们关注的问题;
在进行研究中,如出现多个量变化时,注意控制变量法的运用;
通过金刚石的制备体会了化学反应速率在工业生产中的运用价值。
必修2 化学反应速率与限度
(第一课时)
化学即来源于生活,化学必服务于生活
生活中的化学反应
反应发生过程不足0.1秒。
据统计,安全气囊在严重的碰撞事故当中能够保护约三分之一的人员生还。
10NaN3 + 2KNO3 = K2O+5Na2O + 16N2↑
生活中的化学反应
几个月
据统计一年全球因钢铁腐蚀而造成的直接经济损失,约达 7000 亿美元,远远超过自然灾害带来的损失。
生活中的化学反应
至少10亿年
在地表以下100多公里处富含碳元素的矿层,在5000MPa巨大的压力和大约1200摄氏度的环境下经过漫长的过程最终形成的钻石。广泛应用于制作首饰品,还可制成切割、钻孔、研磨等工具 。
说 说 感 想
不足0.1秒
几个月
至少10亿年
思考
如何描述化学反应的快慢?
思 考
如何改变化学反应的快慢?
哪些因素会影响化学反应的速率?
科学探究的一般过程
设计实验
实验药品:5%H2O2溶液、10%H2O2溶液、 MnO2 、
FeCl3、热水、冷水
实验仪器:试管、烧杯等
实验分组设置
分组 方 案
A组
浓度 5%H2O2溶液、10%H2O2溶液各2mL,分别滴加 3滴FeCl3溶液比较。
B组
温度 分别取2mL 5%H2O2溶液, 滴加 3滴FeCl3溶液,再分别置于冷水、热水比较。
C组
催化剂 分别取2mL 5%H2O2溶液,一份滴加3滴FeCl3溶液,另一份不滴加催化剂,对比观察。
实验注意事项
1、小组成员要明确分工:记录现象、操作、拍摄。
2、如需要使用FeCl3溶液做催化剂, 只需要3滴即可。
3、注意量取不同浓度的H2O2溶液用不同的吸管。
4、对比实验要注意操作的规范与统一性。
探 究 结 果
小组序号 调节变量(自变量) 无关变量 结 论
A 浓度 温度、催化剂 其他条件相同时,反应物浓度增加,化学反应速率加快。
B 温度 浓度、催化剂 其他条件相同时,反应物温度升高,化学反应速率加快。
C 催化剂 浓度、温度 催化剂可以改变化学反应速率。
还有哪些其他因素
接触面积
物质状态
压强
物质自身性质(内部因素)
思 考
运用知识,我们可以解决或解释生产、生活中的哪些问题?
1949年,我国年产量只有四万吨。
2003年,我国年产量已达3371.2万吨,超过美国,位居世界首位。
硫酸工业
硫酸的产量可视为一个国家工业发达水平的一种标志。
煅烧硫铁矿
硫铁矿
4FeS2+11O2 2Fe2O3+8SO2
高温
SO2转化为SO3
0.1 0.5 1 10
400 99.2 99.6 99.7 99.9
500 93.5 96.9 97.8 99.3
600 73.7 85.8 89.5 96.4
思 考 题
足量锌粒与2L 1mol/L稀硫酸反应,在不改变生成氢气总量的基础上,可采取哪些方法加快反应速率?
1、将锌粒改为锌粉
2、给稀硫酸加热
3、在不增加H+物质的量基础上,加大稀硫酸
浓度(蒸发水分)
4、使锌粒与铜片接触
5、滴加几滴硫酸铜溶液
收 获
认识了影响化学反应速率的因素;
运用科学探究的一般过程,研究我们关注的问题;
在进行研究中,如出现多个量变化时,注意控制变量法的运用;
通过金刚石的制备体会了化学反应速率在工业生产中的运用价值。
