人教生物选修1专题3课题课题2月季的花药培养(共37张PPT)
文档属性
| 名称 | 人教生物选修1专题3课题课题2月季的花药培养(共37张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 4.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 生物学 | ||
| 更新时间 | 2020-02-24 00:00:00 | ||
图片预览










文档简介
(共37张PPT)
植物组织培养技术
主要内容
一、植物组织培养发展过程
(1)探索阶段和萌芽阶段(20世纪初至30年代中期)
1902年德国植物生理学家Haberlandt提出了细胞全能性的设想。之后人们通过对植物组织培养各方面进行研究,一些植物幼胚培养获得成功,离体器官培养也有了一定的进展。
一、植物组织培养发展过程
(2)奠基阶段(20世纪30年代末至50年代末期)
通过对培养基成分和培养条件的研究,特别是细胞生长素和分裂素的研究,实现了对离体细胞生长和分化的控制,促进了植物组织培养的发展。
(3)迅速发展阶段(20世纪60年代至今)
植物组织培养已经变成了一种常规的实验技术,广泛应用于植物的脱毒、快繁、基因工程、细胞工程、遗传研究、次生代谢物质的生产、工厂化育苗等多个方面,植物组培和细胞培养逐渐走向了工厂化合商品化阶段。
二、植物组织培养的应用
1、快速无性繁殖大量苗木(花卉)
运用组织培养的途径,一个单株一年可以繁殖几万到几百万个植株。例如一个兰花球茎一年繁殖到400万个。
二、植物组织培养的应用
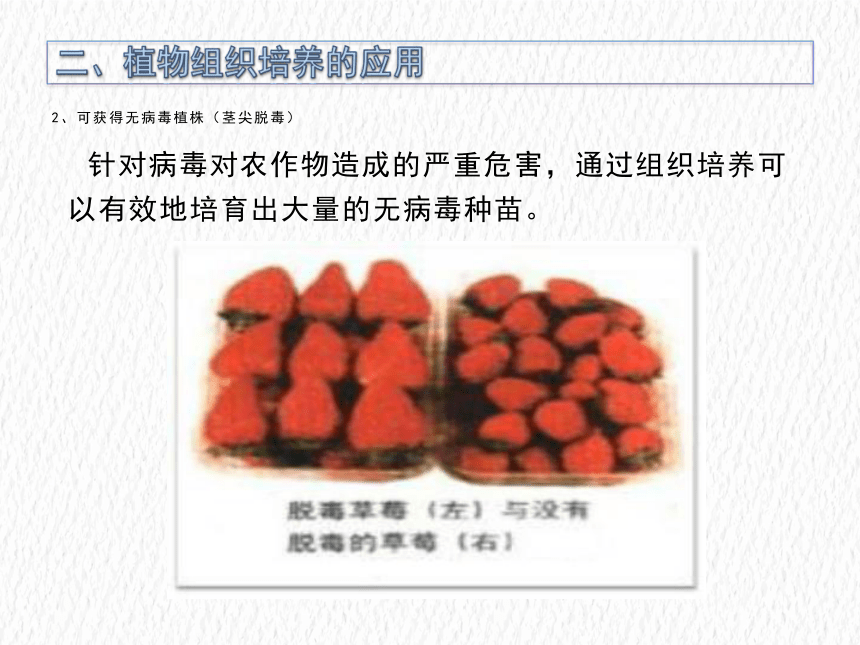
2、可获得无病毒植株(茎尖脱毒)
针对病毒对农作物造成的严重危害,通过组织培养可以有效地培育出大量的无病毒种苗。
二、植物组织培养的应用
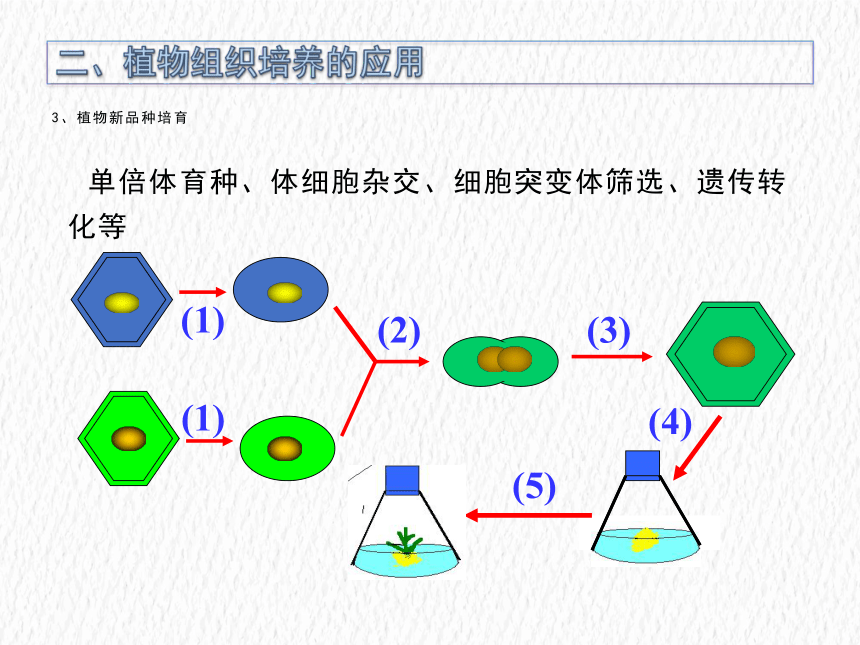
3、植物新品种培育
单倍体育种、体细胞杂交、细胞突变体筛选、遗传转化等
(1)
(1)
(2)
(3)
(4)
(5)
二、植物组织培养的应用
二、植物组织培养的应用
4、物质资源的离体保存
利用植物组织培养进行离体低温或冷冻保存种质资源,大大节约人力、物力和土地,挽救濒危物种,还可以避免病虫害侵染和外界不利气候及其他栽培因素的影响,可长期保存,并有利于物种资源的远距离交换。
二、植物组织培养的应用
5、生产人工种子(体细胞胚)
用人工种皮包被体细胞胚,可以制造人工种子,解决有些植物结子困难、发芽率低、繁殖困难等问题。
三、植物组织培养概念
(1) 植物组织培养:
在无菌培养的条件下,将离体的植物器官(根,茎,叶,花,果实等)、组织(形成层,花药组织等)、细胞(体细胞,生殖细胞等)以及原生质体等培养在人工配制的培养基上,并给予适当的培养条件,使其长成完整植株的过程。
(2) 理论依据:
植物细胞的全能性,即指植物机体的每个细胞都含有该物种全套的基因组,具有发育成完整个体的潜力。
三、植物组织培养概念
(3) 外植体:
从活体植株上切下的,用于组织培养的细胞、组织和器官。一般包括茎尖、根、茎、叶、花、种子等器官以及他们形成的体细胞胚等材料。
三、植物组织培养概念
(4) 脱分化:
已经高度分化的植物器官、组织或细胞,在切割损伤和培养物内外因素的共同作用下,逐渐丧失原来的分化结构和功能,最后形成无组织的细胞团或愈伤组织的过程。
三、植物组织培养概念
(4) 脱分化:
已经高度分化的植物器官、组织或细胞,在切割损伤和培养物内外因素的共同作用下,逐渐丧失原来的分化结构和功能,最后形成无组织的细胞团或愈伤组织的过程。
(5)愈伤组织:
在人工培养基上由外植体脱分化形成的一团无序生长的薄壁细胞。(具有细胞分裂能力)
三、植物组织培养概念
(6)再分化:
已经脱分化的细胞在一定条件下,又可经过愈伤组织或胚状体,再分化出根和芽,形成完整植株 ,这一过程叫作再分化。
三、植物组织培养概念
(7) 不定芽:
凡从叶、根、或茎节间等通常不形成芽的部位生出的芽,则统称为不定芽
(8) 胚状体:
在离体植物细胞、组织或器官培养过程中,由一个或一些体细胞,经过胚胎发生和发育过程,形成的与合子胚相类似的结构。
四、植物组织培养过程
脱分化
再分化
移栽
组织培养实验过程简图
四、植物组织培养过程
植物组织培养过程
四、植物组织培养过程
MS培养基的配制操作步骤
方法一:传统母液配制法
(1)MS培养基母液的配制:
MS培养基含有十几种化合物,配制不方便也难称量准确,可将培养基中的各种成分扩大一定倍数分别称量,配成浓缩液,这种浓缩液叫做培养基母液。(母液配制见下表)
四、植物组织培养过程
四、植物组织培养过程
( 2)MS(1000mL)培养基的配制:
按比例分别取适量各种成分的母液,加入烧杯,称取蔗糖30g,琼脂7g,加水并加热使琼脂溶解,按照需要的浓度分别加入激素,用1mol/L NaOH和1mol/L HCl溶液调节pH至5.8~6.0。将配好的培养基迅速分装至组培瓶中,拧上盖子,放入灭菌锅121℃,灭菌20min。
方法二:培养基干粉配制法
称取培养基干粉42g加水加热煮沸溶解后定溶至1L,按照需要的浓度分别加入激素。用1mol/L NaOH和1mol/L HCl调节pH至6.0。将配好的培养基迅速分装至150ml组培瓶中,拧上盖子,放入灭菌锅121℃,灭菌20min。
四、植物组织培养过程
植物组培具体操作步骤
(1)取材:
取菊花生长旺盛的嫩枝(外植体不能太小,否则会影响愈伤组织的形成)。
(2)消毒与修剪外植体:
①流水冲洗后,加少许洗衣粉刷洗,流水冲20分钟;
②放入75﹪酒精中摇动2~3次,持续30秒,无菌水冲洗2~3次,用无菌吸水纸吸干;
③在2﹪~10%的次氯酸钠溶液中消毒8~10分钟,无菌水冲洗2~3次,无菌吸水纸吸干。
(3)接种
四、植物组织培养过程
常用灭菌剂使用浓度及效果比较表
四、植物组织培养过程
植物组织培养消毒与接种示意图
四、植物组织培养过程
无菌苗培养
(1)愈伤组织与不定芽的诱导培养
选用合适的培养基分别对植物材料进行愈伤组织和不定芽的诱导。
(2)继代培养
继代培养是继初代培养之后的连续数代的扩繁培养过程。目的是繁殖出相当数量的无菌苗。
四、植物组织培养过程
(3) 生根培养
选用生根培养基对无菌苗进行生根培养。
(4)材料的移栽及温室培养:
炼苗:先在外界环境闭瓶锻炼3天,再开瓶锻炼3天(以培养基上开始长出菌为宜)。
移栽:去净培养基,可先在灭过菌的珍珠岩或蛭石上培养使根系发达再转移到土壤中。
五、组织培养影响因素
影响植物组织培养的几个因素
植物的材料
培养基
植物激素
PH值
外界因素(温度,光照,通气状况,材料处理等)
注意事项
1、实验所使用的器材必须要严格灭菌,注意无菌操作,避免因染菌导致实验失败;
2、配制贮存母液时,要算好各种成分逐次加入,等第一种成分完全溶解后再加入第二种成分,切忌“一锅煮”。有机物质和铁盐溶液配好以后要装入棕色瓶放入电冰箱内保存,其它两种种母液可在常温下保存但最多不能超过一个月;
注意事项
3、pH值对培养基的硬度有影响,pH过高培养基变硬,pH过低培养基不能凝固,所以要调整好培养基的pH值;
4、材料脱毒时不要在酒精中停留过长时间,以免材料被杀死。
5、所有制备好的溶液和试剂瓶上都要有标签,注上名称、浓度、消毒与否和制备日期。
六、组培实验室及设备
(1)实验室设置
组织培养实验室设置简图
六、组培实验室及设备
(2)组培相关设备仪器介绍
电子天平
纯水机
六、组培实验室及设备
高压灭菌锅
酸度计
六、组培实验室及设备
干燥箱
摇床
六、组培实验室及设备
超净工作台
数码显微镜
六、组培实验室及设备
恒温光照培养箱
培养架
Thank You !
植物组织培养技术
主要内容
一、植物组织培养发展过程
(1)探索阶段和萌芽阶段(20世纪初至30年代中期)
1902年德国植物生理学家Haberlandt提出了细胞全能性的设想。之后人们通过对植物组织培养各方面进行研究,一些植物幼胚培养获得成功,离体器官培养也有了一定的进展。
一、植物组织培养发展过程
(2)奠基阶段(20世纪30年代末至50年代末期)
通过对培养基成分和培养条件的研究,特别是细胞生长素和分裂素的研究,实现了对离体细胞生长和分化的控制,促进了植物组织培养的发展。
(3)迅速发展阶段(20世纪60年代至今)
植物组织培养已经变成了一种常规的实验技术,广泛应用于植物的脱毒、快繁、基因工程、细胞工程、遗传研究、次生代谢物质的生产、工厂化育苗等多个方面,植物组培和细胞培养逐渐走向了工厂化合商品化阶段。
二、植物组织培养的应用
1、快速无性繁殖大量苗木(花卉)
运用组织培养的途径,一个单株一年可以繁殖几万到几百万个植株。例如一个兰花球茎一年繁殖到400万个。
二、植物组织培养的应用
2、可获得无病毒植株(茎尖脱毒)
针对病毒对农作物造成的严重危害,通过组织培养可以有效地培育出大量的无病毒种苗。
二、植物组织培养的应用
3、植物新品种培育
单倍体育种、体细胞杂交、细胞突变体筛选、遗传转化等
(1)
(1)
(2)
(3)
(4)
(5)
二、植物组织培养的应用
二、植物组织培养的应用
4、物质资源的离体保存
利用植物组织培养进行离体低温或冷冻保存种质资源,大大节约人力、物力和土地,挽救濒危物种,还可以避免病虫害侵染和外界不利气候及其他栽培因素的影响,可长期保存,并有利于物种资源的远距离交换。
二、植物组织培养的应用
5、生产人工种子(体细胞胚)
用人工种皮包被体细胞胚,可以制造人工种子,解决有些植物结子困难、发芽率低、繁殖困难等问题。
三、植物组织培养概念
(1) 植物组织培养:
在无菌培养的条件下,将离体的植物器官(根,茎,叶,花,果实等)、组织(形成层,花药组织等)、细胞(体细胞,生殖细胞等)以及原生质体等培养在人工配制的培养基上,并给予适当的培养条件,使其长成完整植株的过程。
(2) 理论依据:
植物细胞的全能性,即指植物机体的每个细胞都含有该物种全套的基因组,具有发育成完整个体的潜力。
三、植物组织培养概念
(3) 外植体:
从活体植株上切下的,用于组织培养的细胞、组织和器官。一般包括茎尖、根、茎、叶、花、种子等器官以及他们形成的体细胞胚等材料。
三、植物组织培养概念
(4) 脱分化:
已经高度分化的植物器官、组织或细胞,在切割损伤和培养物内外因素的共同作用下,逐渐丧失原来的分化结构和功能,最后形成无组织的细胞团或愈伤组织的过程。
三、植物组织培养概念
(4) 脱分化:
已经高度分化的植物器官、组织或细胞,在切割损伤和培养物内外因素的共同作用下,逐渐丧失原来的分化结构和功能,最后形成无组织的细胞团或愈伤组织的过程。
(5)愈伤组织:
在人工培养基上由外植体脱分化形成的一团无序生长的薄壁细胞。(具有细胞分裂能力)
三、植物组织培养概念
(6)再分化:
已经脱分化的细胞在一定条件下,又可经过愈伤组织或胚状体,再分化出根和芽,形成完整植株 ,这一过程叫作再分化。
三、植物组织培养概念
(7) 不定芽:
凡从叶、根、或茎节间等通常不形成芽的部位生出的芽,则统称为不定芽
(8) 胚状体:
在离体植物细胞、组织或器官培养过程中,由一个或一些体细胞,经过胚胎发生和发育过程,形成的与合子胚相类似的结构。
四、植物组织培养过程
脱分化
再分化
移栽
组织培养实验过程简图
四、植物组织培养过程
植物组织培养过程
四、植物组织培养过程
MS培养基的配制操作步骤
方法一:传统母液配制法
(1)MS培养基母液的配制:
MS培养基含有十几种化合物,配制不方便也难称量准确,可将培养基中的各种成分扩大一定倍数分别称量,配成浓缩液,这种浓缩液叫做培养基母液。(母液配制见下表)
四、植物组织培养过程
四、植物组织培养过程
( 2)MS(1000mL)培养基的配制:
按比例分别取适量各种成分的母液,加入烧杯,称取蔗糖30g,琼脂7g,加水并加热使琼脂溶解,按照需要的浓度分别加入激素,用1mol/L NaOH和1mol/L HCl溶液调节pH至5.8~6.0。将配好的培养基迅速分装至组培瓶中,拧上盖子,放入灭菌锅121℃,灭菌20min。
方法二:培养基干粉配制法
称取培养基干粉42g加水加热煮沸溶解后定溶至1L,按照需要的浓度分别加入激素。用1mol/L NaOH和1mol/L HCl调节pH至6.0。将配好的培养基迅速分装至150ml组培瓶中,拧上盖子,放入灭菌锅121℃,灭菌20min。
四、植物组织培养过程
植物组培具体操作步骤
(1)取材:
取菊花生长旺盛的嫩枝(外植体不能太小,否则会影响愈伤组织的形成)。
(2)消毒与修剪外植体:
①流水冲洗后,加少许洗衣粉刷洗,流水冲20分钟;
②放入75﹪酒精中摇动2~3次,持续30秒,无菌水冲洗2~3次,用无菌吸水纸吸干;
③在2﹪~10%的次氯酸钠溶液中消毒8~10分钟,无菌水冲洗2~3次,无菌吸水纸吸干。
(3)接种
四、植物组织培养过程
常用灭菌剂使用浓度及效果比较表
四、植物组织培养过程
植物组织培养消毒与接种示意图
四、植物组织培养过程
无菌苗培养
(1)愈伤组织与不定芽的诱导培养
选用合适的培养基分别对植物材料进行愈伤组织和不定芽的诱导。
(2)继代培养
继代培养是继初代培养之后的连续数代的扩繁培养过程。目的是繁殖出相当数量的无菌苗。
四、植物组织培养过程
(3) 生根培养
选用生根培养基对无菌苗进行生根培养。
(4)材料的移栽及温室培养:
炼苗:先在外界环境闭瓶锻炼3天,再开瓶锻炼3天(以培养基上开始长出菌为宜)。
移栽:去净培养基,可先在灭过菌的珍珠岩或蛭石上培养使根系发达再转移到土壤中。
五、组织培养影响因素
影响植物组织培养的几个因素
植物的材料
培养基
植物激素
PH值
外界因素(温度,光照,通气状况,材料处理等)
注意事项
1、实验所使用的器材必须要严格灭菌,注意无菌操作,避免因染菌导致实验失败;
2、配制贮存母液时,要算好各种成分逐次加入,等第一种成分完全溶解后再加入第二种成分,切忌“一锅煮”。有机物质和铁盐溶液配好以后要装入棕色瓶放入电冰箱内保存,其它两种种母液可在常温下保存但最多不能超过一个月;
注意事项
3、pH值对培养基的硬度有影响,pH过高培养基变硬,pH过低培养基不能凝固,所以要调整好培养基的pH值;
4、材料脱毒时不要在酒精中停留过长时间,以免材料被杀死。
5、所有制备好的溶液和试剂瓶上都要有标签,注上名称、浓度、消毒与否和制备日期。
六、组培实验室及设备
(1)实验室设置
组织培养实验室设置简图
六、组培实验室及设备
(2)组培相关设备仪器介绍
电子天平
纯水机
六、组培实验室及设备
高压灭菌锅
酸度计
六、组培实验室及设备
干燥箱
摇床
六、组培实验室及设备
超净工作台
数码显微镜
六、组培实验室及设备
恒温光照培养箱
培养架
Thank You !
同课章节目录
- 专题1 传统发酵技术的应用
- 课题1 果酒和果醋的制作
- 课题2 腐乳的制作
- 课题3 制作泡菜并检测亚硝酸盐含量
- 专题2 微生物的培养与应用
- 课题1 微生物的实验室培养
- 课题2 土壤中分解尿素的细菌的分离与计数
- 课题3 分解纤维素的微生物的分离
- 专题3 植物的组织培养技术
- 课题1 菊花的组织培养
- 课题2 月季的花药培养
- 专题4 酶的研究与应用
- 课题1 果胶酶在果汁生产中的作用
- 课题2 探讨加酶洗衣粉的洗涤效果
- 课题3 酵母细胞的固定化
- 专题5 DNA和蛋白质技术
- 课题1 DNA的粗提取与鉴定
- 课题2 多聚酶链式反应扩增DNA片段
- 课题3 血红蛋白的提取和分离
- 专题6 植物有效成分的提取
- 课题1 植物芳香油的提取
- 课题2 胡萝卜素的提取
