第一节酸及其性质课件(19张PPT)
图片预览






文档简介
(共19张PPT)
第七单元 第一节
酸及其性质
(第一课时)
学习目标
1、 通过观察,记住浓盐酸和浓硫酸的物理性质;通过实验认识浓硫酸的特性:吸水性和强腐蚀性,初步学会浓硫酸的稀释。
2、 通过实验探究盐酸的化学性质,认识复分解反应。
3、通过实验探究增进对科学探究的理解,发展科学探究能力 。
酸溶于水都能解离出相同的阳离子
----H+
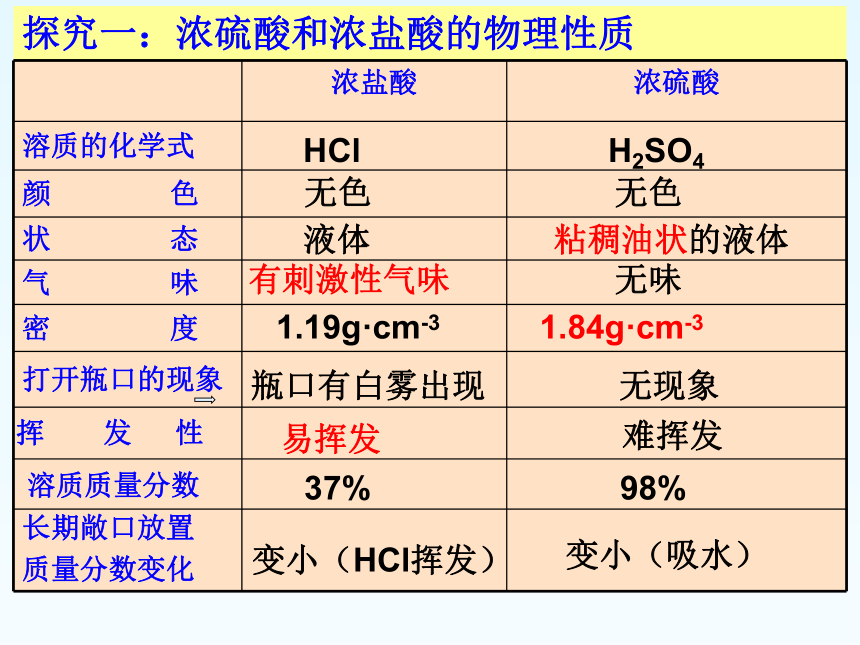
活动一:探究浓硫酸和浓盐酸的物理性质
仔细观察浓硫酸和浓盐酸,阅读试剂瓶标签,完成表格一。
探究一:浓硫酸和浓盐酸的物理性质
H2SO4
HCl
无色
无色
液体
粘稠油状的液体
有刺激性气味
1.84g·cm-3
瓶口有白雾出现
无现象
无味
易挥发
难挥发
1.19g·cm-3
溶质质量分数
98%
37%
挥 发 性
变小(HCl挥发)
变小(吸水)
长期敞口放置
质量分数变化
浓盐酸 浓硫酸
溶质的化学式
颜 色
状 态
气 味
密 度
打开瓶口的现象
浓硫酸的特性
1、吸水性——可以作干燥剂
CO2(H2O)
CO2
洗气瓶
(长进短出)
2、强腐蚀性
浓硫酸的稀释
不断搅拌
浓硫酸
水
注意:切不可把水倒进浓硫酸里。
拓展应用:
你有哪些方法区分浓盐酸和浓硫酸?
1、打开瓶塞看现象
2、打开瓶塞闻气味
3、相同体积称重量
4 ……
利用物质性质的差异,用物理方法或化学方法进行区分
活动二、探究稀盐酸的化学性质
请利用下列物质,探究盐酸能与哪些
物质发生反应?完成表格二。
1、紫色石蕊试液 2、无色酚酞试液
3、镁条 4、碳酸钠 5、生锈的铁钉
6、硝酸银溶液 7、氯化钡溶液
温馨提示:1、节约药品;
2、仔细观察,及时记录实验现象;
3、注意实验安全。
一段时间后,铁钉表面有气泡冒出
镁条溶解,有气泡产生,放出热量
铁锈溶解,溶液变成黄色
产生白色沉淀
碳酸钠粉末溶解,产生大量气泡
无明显现象
二、稀盐酸的化学性质
BaCl2+ HCl ==
Fe
盐:有金属阳离子和酸根离子构成的化合物
紫色石蕊试液变红
无色酚酞试液不变色
复分解反应:
A + C
AB+CD
B
D
1、盐酸能使酸碱指示剂变色
实验内容 现象与结论
盐酸 紫色石蕊试液
无色酚酞试液
Mg
Na2CO3
Fe2O3
AgNO3
BaCl2
?
?
2、老者生来脾气燥,每逢喝水必高烧,
高寿虽已九十八,性情依旧不可交。
(打一物质)
?
1、 我入水中较安全;水入我中真危险。
我遇水时多放热;实验牢记保平安。
(打一实验操作)
猜谜语
2、下列物质中属于酸的是( )
A.H2CO3 B.NaHCO3 C.P2O5 D.Ba(OH)2
A
1、 下列各变化属于物理变化的是( )
用稀盐酸除去金属表面的铁锈
盐酸使指示剂变色
C. 用小木棍蘸少量浓硫酸,小木棍逐渐变为黑色
D. 浓盐酸在空气里敞口放置瓶口有白雾生成
D
3、下列物质与HCl溶液发生的反应不属于复分解反应的是( )
A.Zn B.Al2O3
C.Ba(OH)2 D.Na2CO3
A
4、如图所示的实验中,小烧杯①盛的是紫色石蕊试液,②盛的是浓盐酸。片刻后,可以观察到烧杯①中液体的颜色是( )
A.紫色 B.红色
C.无色 D.蓝色
B
5、若将浓盐酸和浓硫酸敞口放置在空气中,一段时间后,可以肯定的是( )
A.溶质质量都减少??B.溶剂质量都增大
C.溶液质量都增大??
D.溶质的质量分数都减小
D
A ? B ?C ? D
6、装有浓硫酸的试剂瓶应贴有的图标是 ( )
A
浓盐酸、浓硫酸的物理性质及浓硫酸的特性
区分物质的方法
物质性质与用途的关系
酸及其性质
我的收获
化学源于生活更服务于生活!
作业:
1、《同步学习》第84页:1、2、
3、4题;
2、尝试在家里制作柠檬味汽水。
一段时间后,铁钉表面有气泡冒出
镁条溶解,有气泡产生,放出热量
铁锈溶解,溶液变成黄色
产生白色沉淀
碳酸钠粉末溶解,产生大量气泡
无明显现象
二、稀盐酸的化学性质
BaCl2+ HCl ==
Fe
盐:有金属阳离子和酸根离子构成的化合物
紫色石蕊试液变红
无色酚酞试液不变色
复分解反应:
A + C
AB+CD
B
D
实验内容 现象与结论
盐酸 紫色石蕊试液
无色酚酞试液
Mg
Na2CO3
Fe2O3
AgNO3
BaCl2
3、把一定质量的浓盐酸和浓硫酸分别敞口放置于空气中一段时间(忽略水分的蒸发)变化的结果是:填“增大”“减少”或“不变”
减少
减少
不变
增大
减少
增大
减少
减少
溶质的质量 溶剂的质量 溶液的质量 溶质质量分数
浓盐酸
浓硫酸
第七单元 第一节
酸及其性质
(第一课时)
学习目标
1、 通过观察,记住浓盐酸和浓硫酸的物理性质;通过实验认识浓硫酸的特性:吸水性和强腐蚀性,初步学会浓硫酸的稀释。
2、 通过实验探究盐酸的化学性质,认识复分解反应。
3、通过实验探究增进对科学探究的理解,发展科学探究能力 。
酸溶于水都能解离出相同的阳离子
----H+
活动一:探究浓硫酸和浓盐酸的物理性质
仔细观察浓硫酸和浓盐酸,阅读试剂瓶标签,完成表格一。
探究一:浓硫酸和浓盐酸的物理性质
H2SO4
HCl
无色
无色
液体
粘稠油状的液体
有刺激性气味
1.84g·cm-3
瓶口有白雾出现
无现象
无味
易挥发
难挥发
1.19g·cm-3
溶质质量分数
98%
37%
挥 发 性
变小(HCl挥发)
变小(吸水)
长期敞口放置
质量分数变化
浓盐酸 浓硫酸
溶质的化学式
颜 色
状 态
气 味
密 度
打开瓶口的现象
浓硫酸的特性
1、吸水性——可以作干燥剂
CO2(H2O)
CO2
洗气瓶
(长进短出)
2、强腐蚀性
浓硫酸的稀释
不断搅拌
浓硫酸
水
注意:切不可把水倒进浓硫酸里。
拓展应用:
你有哪些方法区分浓盐酸和浓硫酸?
1、打开瓶塞看现象
2、打开瓶塞闻气味
3、相同体积称重量
4 ……
利用物质性质的差异,用物理方法或化学方法进行区分
活动二、探究稀盐酸的化学性质
请利用下列物质,探究盐酸能与哪些
物质发生反应?完成表格二。
1、紫色石蕊试液 2、无色酚酞试液
3、镁条 4、碳酸钠 5、生锈的铁钉
6、硝酸银溶液 7、氯化钡溶液
温馨提示:1、节约药品;
2、仔细观察,及时记录实验现象;
3、注意实验安全。
一段时间后,铁钉表面有气泡冒出
镁条溶解,有气泡产生,放出热量
铁锈溶解,溶液变成黄色
产生白色沉淀
碳酸钠粉末溶解,产生大量气泡
无明显现象
二、稀盐酸的化学性质
BaCl2+ HCl ==
Fe
盐:有金属阳离子和酸根离子构成的化合物
紫色石蕊试液变红
无色酚酞试液不变色
复分解反应:
A + C
AB+CD
B
D
1、盐酸能使酸碱指示剂变色
实验内容 现象与结论
盐酸 紫色石蕊试液
无色酚酞试液
Mg
Na2CO3
Fe2O3
AgNO3
BaCl2
?
?
2、老者生来脾气燥,每逢喝水必高烧,
高寿虽已九十八,性情依旧不可交。
(打一物质)
?
1、 我入水中较安全;水入我中真危险。
我遇水时多放热;实验牢记保平安。
(打一实验操作)
猜谜语
2、下列物质中属于酸的是( )
A.H2CO3 B.NaHCO3 C.P2O5 D.Ba(OH)2
A
1、 下列各变化属于物理变化的是( )
用稀盐酸除去金属表面的铁锈
盐酸使指示剂变色
C. 用小木棍蘸少量浓硫酸,小木棍逐渐变为黑色
D. 浓盐酸在空气里敞口放置瓶口有白雾生成
D
3、下列物质与HCl溶液发生的反应不属于复分解反应的是( )
A.Zn B.Al2O3
C.Ba(OH)2 D.Na2CO3
A
4、如图所示的实验中,小烧杯①盛的是紫色石蕊试液,②盛的是浓盐酸。片刻后,可以观察到烧杯①中液体的颜色是( )
A.紫色 B.红色
C.无色 D.蓝色
B
5、若将浓盐酸和浓硫酸敞口放置在空气中,一段时间后,可以肯定的是( )
A.溶质质量都减少??B.溶剂质量都增大
C.溶液质量都增大??
D.溶质的质量分数都减小
D
A ? B ?C ? D
6、装有浓硫酸的试剂瓶应贴有的图标是 ( )
A
浓盐酸、浓硫酸的物理性质及浓硫酸的特性
区分物质的方法
物质性质与用途的关系
酸及其性质
我的收获
化学源于生活更服务于生活!
作业:
1、《同步学习》第84页:1、2、
3、4题;
2、尝试在家里制作柠檬味汽水。
一段时间后,铁钉表面有气泡冒出
镁条溶解,有气泡产生,放出热量
铁锈溶解,溶液变成黄色
产生白色沉淀
碳酸钠粉末溶解,产生大量气泡
无明显现象
二、稀盐酸的化学性质
BaCl2+ HCl ==
Fe
盐:有金属阳离子和酸根离子构成的化合物
紫色石蕊试液变红
无色酚酞试液不变色
复分解反应:
A + C
AB+CD
B
D
实验内容 现象与结论
盐酸 紫色石蕊试液
无色酚酞试液
Mg
Na2CO3
Fe2O3
AgNO3
BaCl2
3、把一定质量的浓盐酸和浓硫酸分别敞口放置于空气中一段时间(忽略水分的蒸发)变化的结果是:填“增大”“减少”或“不变”
减少
减少
不变
增大
减少
增大
减少
减少
溶质的质量 溶剂的质量 溶液的质量 溶质质量分数
浓盐酸
浓硫酸
同课章节目录
- 第七单元 常见的酸和碱
- 第一节 酸及其性质
- 第二节 碱及其性质
- 第三节 溶液的酸碱性
- 第四节 酸碱中和反应
- 到实验室去:探究酸和碱的化学性质
- 第八单元 海水中的化学
- 第一节 海洋化学资源
- 第二节 海水“晒盐“
- 第三节 海水“制碱“
- 到实验室去:粗盐中难溶性杂质的去除
- 第九单元 金属
- 第一节 常见的金属材料
- 第二节 金属的化学性质
- 第三节 钢铁的锈蚀与防护
- 到实验室去 探究金属的性质
- 第十单元 化学与健康
- 第一节 食物中的有机物
- 第二节 化学元素与人体健康
- 第三节 远离有毒物质
- 第十一单元 化学与社会发展
- 第一节 化学与能源开发
- 第二节 化学与材料研制
- 第三节 化学与农业生产
- 第四节 化学与环境保护
