人教版高中化学 必修二 第二章 第二节 化学能与电能 上课课件(共48张ppt)
文档属性
| 名称 | 人教版高中化学 必修二 第二章 第二节 化学能与电能 上课课件(共48张ppt) | 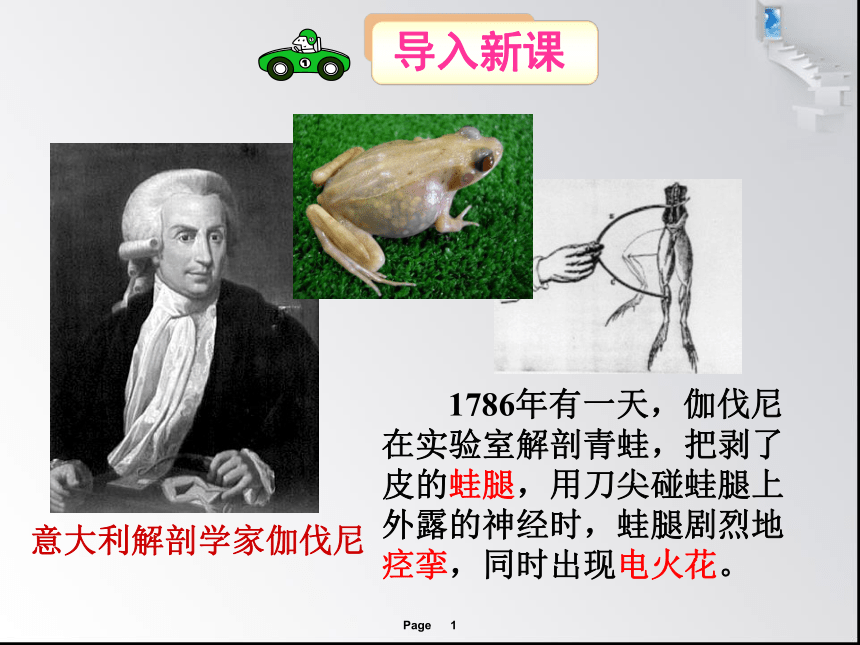 | |
| 格式 | zip | ||
| 文件大小 | 2.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-02-26 20:17:46 | ||
图片预览








文档简介
(共48张PPT)
意大利解剖学家伽伐尼
1786年有一天,伽伐尼在实验室解剖青蛙,把剥了皮的蛙腿,用刀尖碰蛙腿上外露的神经时,蛙腿剧烈地痉挛,同时出现电火花。
导入新课
蛙腿
经过反复实验,他认为痉挛起因于动物体上本来就存在的电,他还把这种电叫做“生物电”。
伽伐尼的一个偶然发现,引出伏打电池的发明和电生理学的建立。
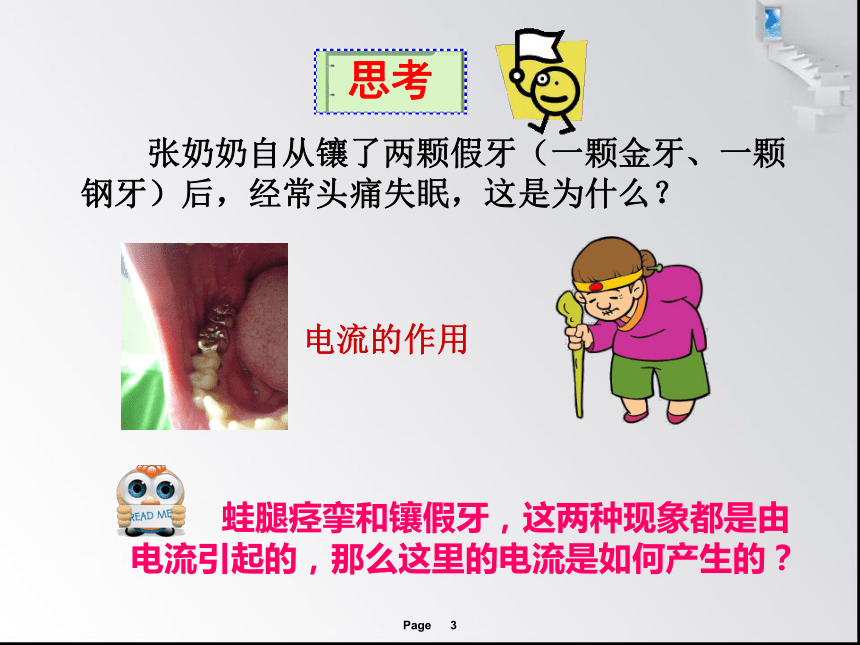
张奶奶自从镶了两颗假牙(一颗金牙、一颗钢牙)后,经常头痛失眠,这是为什么?
思考
电流的作用
蛙腿痉挛和镶假牙,这两种现象都是由电流引起的,那么这里的电流是如何产生的?
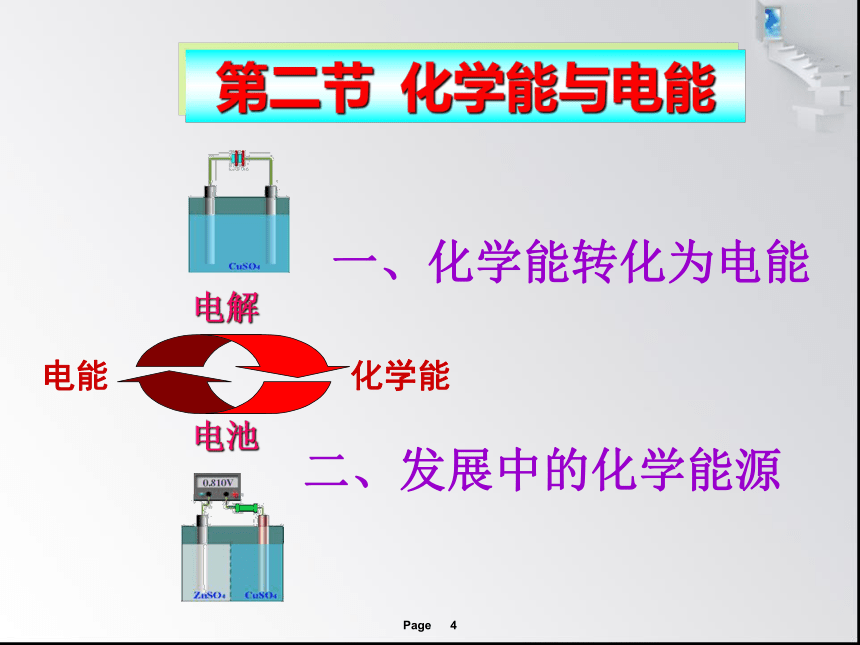
电能 化学能
电解
电池
一、化学能转化为电能
二、发展中的化学能源
第二节 化学能与电能
知识目标:
能力目标:
通过实验和科学探究形成原电池概念,初步了解原电池的组成,理解其工作原理。
(1)分析火力发电的原理及利弊,建立“将化学能直接转化为电能”的新思路,通过对氧化还原反应的本质的分析,提出实现新思路的各种推测和猜想等,培养创新思维能力。
教学目标
(2)通过实验和科学探究,对比、归纳,培养学生科学探究精神和分析、归纳的能力。
科学探究和实验中的良好态度和合作学习。
情感目标:
重点:
初步认识原电池概念、反应原理、构成及应用。认识化学能转化为电能对现代化的重大意义。
通过对原电池实验的探究,引导学生从电子转移角度理解化学能向电能转化的本质。
难点:
教学重难点
如何将化学能直接转化为电能,进而提高资源的利用率呢?
思考
一、化学能转化为电能
火力发电中,燃烧是化学能转变为电能的关键。燃烧作为氧化还原反应,本质是氧化剂与还原剂之间电子的转移。
能不能使氧化还原反应中的电子转移在不同区域内进行,从而形成电流,将化学能直接转化为电能呢?
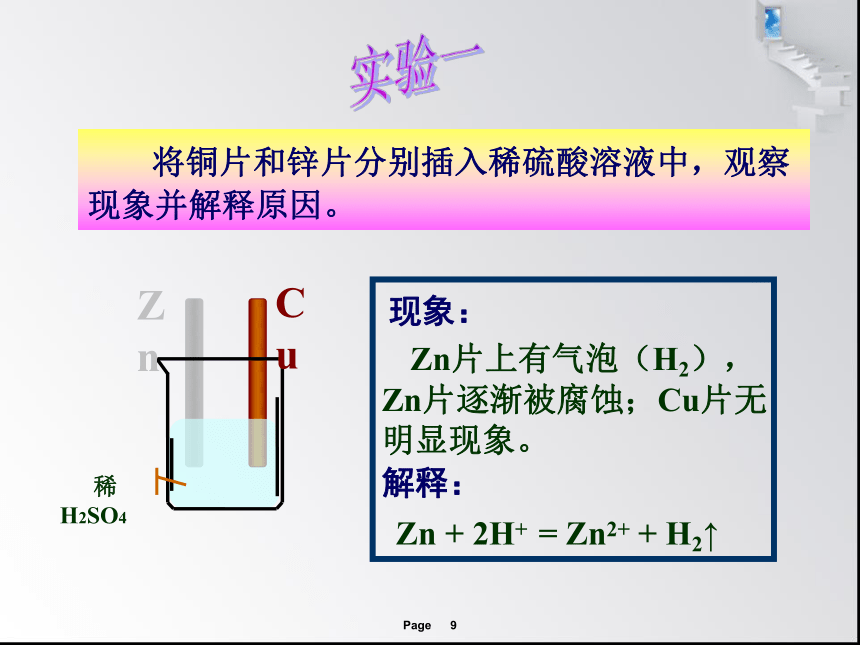
将铜片和锌片分别插入稀硫酸溶液中,观察现象并解释原因。
稀H2SO4
Zn
Cu
现象:
解释:
Zn片上有气泡(H2), Zn片逐渐被腐蚀;Cu片无明显现象。
Zn + 2H+ = Zn2+ + H2↑
实验一
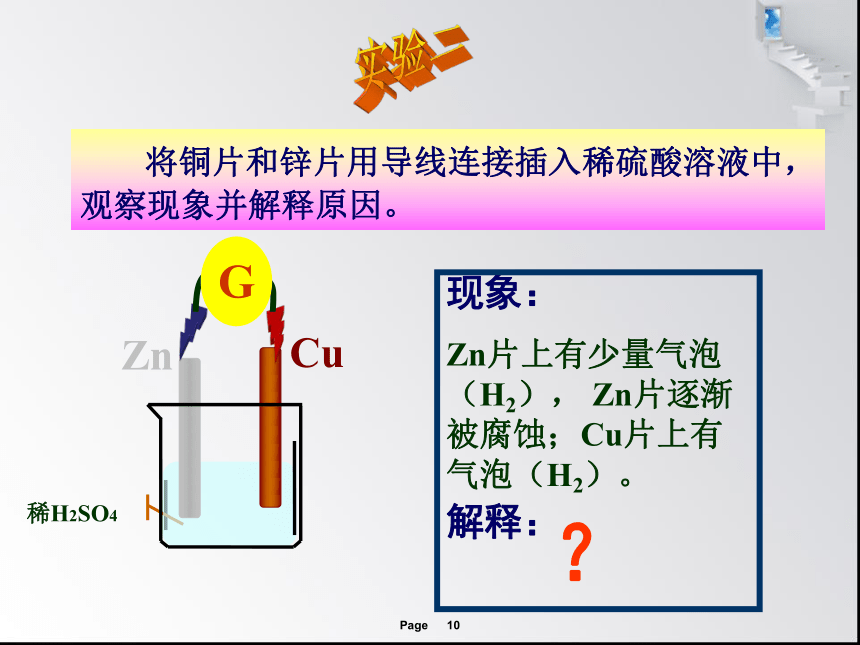
将铜片和锌片用导线连接插入稀硫酸溶液中,观察现象并解释原因。
现象:
解释:
Zn片上有少量气泡(H2), Zn片逐渐被腐蚀;Cu片上有气泡(H2)。
?
稀H2SO4
Zn
Cu
G
实验二
指针偏转,说明电路中有电流通过,说明发生了电子定向移动。
Zn片失去的电子经导线转移到Cu片上, Cu片周围的H+得电子。
把这种将化学能直接转变成电能的装置,称为原电池,例如:Cu-Zn原电池。
分析与讨论
Zn-2e- = Zn2+
2H++2e- = H2 ↑
Cu-Zn原电池的正负极?
Zn片(负极):
Cu片(正极):
Zn-2e- = Zn2+
2H+2e- = H2 ↑
总反应: Zn + 2H+ = Zn2+ + H2↑
表示下列原电池的放电过程:
稀H2SO4
Fe
Cu
稀HCl
Zn
Cu
1
2
随堂练
表示下列原电池的放电过程:
稀H2SO4
Mg
C
CuSO4溶液
Zn
C
3
4
化学能
热能
机械能
电能
火电站工作原理示意图
2017年 2018年
水电 14.70% 14.95%
火电 83.17% 82.86%
核电 1.92% 1.92%
其他 0.22% 0.26%
1. 燃烧反应是否是氧化还原反应?氧化还原反应的本质又是什么?
燃烧反应是氧化还原反应,氧化还原反应的本质是氧化剂与还原剂之间发生电子转移,引起化学键的重新结合,伴随体系能量的变化。
知识拓展
2.原电池的工作原理是什么?
原电池的工作原理是将氧化、还原两反应分割在正负两极同时不同地进行,电子从负极定向流入正极,从而产生了道路电流。
3.构成原电池的条件是什么?
(1)有活泼性,不同的两种金属或者一种金属与一种非金属导体(如石墨)或者一种金属与一种氧化物等作电极,并用导线连接或直接接触。
(2)两电极都插入电解质溶液(酸、碱、盐)中构成闭合回路。
(3)在电极表面上发生有电子转移的化学反应,即氧化—还原反应。
正负两极上进出电子总数相等,椐此电子守恒原理可进行两极上物质变化的计算。
利用原电池原理 可制作各种电池,如干电池、铅蓄电池、银锌电池、锂电池、氢氧燃料电池…。
4.如何计算原电池物质量的变化?
5.原电池原理还有哪些应用?
负极: 较活泼的金属
正极: 较不活泼的金属或非金属导体
Zn
Cu
A
-
+
稀硫酸
Zn
Fe
A
稀硫酸
C
Zn
Fe
C
A
稀硫酸
-
+
-
+
-
+
A
请根据下列原电池正负构造特点,总结出如何判断原电池的正负极
思考与交流
稀硫酸
动脑动手
有下列材料:Zn片(2片)、Cu片(2片)、导线、水果 (西红柿、苹果等)、电流计,请设计一个装置使电流计指针发生偏转,并画出设计草图。
二、发展中的化学电源
广泛用于卡式录音机、闪光灯、电动玩具、
袖珍电视机等。
1.干电池
Zn Zn2+ + 2e-
2NH4++ 2e- 2NH3 + H2
锌锰电池:使用最早的化学电池,属于一次性电池
正极反应为
其负极反应为
①铅蓄电池:最早使用的充电电池,它是用硬橡胶或透明塑料制成长方形外壳,在正极板上有一层棕褐色的PbO2,负极板是海绵状的金属铅,两极均浸入硫酸溶液中。
铅蓄电池电极反应:
负极:Pb + SO42-—2e-=PbSO4
正极:PbO2 + 4H+ + SO42- + 2e-=PbSO4 + 2H2O
铅蓄电池充电和放电的总化学方程式:
PbO2 + Pb + 2H2SO4 2PbSO4 + 2H2O
放电
充电
2.充电电池
充电电池又称二次电池,能够重复使用至一定的周期
②镍镉充电电池:它是一种体积少,具有残留性记忆的充电电池,可重复使用500次以上。它以Cd为负极,NiO(OH)为正极,KOH为电解液。广泛用于收录机、无线对讲机、电子闪光灯、电动剃须刀等,但有毒。
③锂离子电池:它是新一代可充电的绿色电,现已成为笔记本电脑、移动电话、摄像等低功耗电器的主流。
它是一种高效、环境友好的发电装置。它的电极材料一般为活性电极,具有很强的催化活性,如铂电极,活性炭电极等。电极反应为
负极:2H2 + 4OH- - 4e- 4H2O
正极:O2 + 2H2O + 4e- 4OH-
总反应:2H2 + O2=2H2O
该电池用金属铂片插入KOH溶液中作电极,又在两极上分别通甲烷和氧气。电极反应:
负极:CH4 + 10OH- - 8e-=CO32- + 7H2O
正极:2O2 + 4H2O + 8e-=8OH-
总反应:CH4 + 2O2 + 2KOH=K2CO3 + 3H2O
3.氢氧燃料电池
4.新型燃料电池
电化学研究对象
电化学主要是研究电能和化学能之间的相互转化及转化过程中有关规律的科学
知识拓展
电化学的用途
⒈电解 精炼和冶炼有色金属和稀有金属;电解法制备化工原料;电镀法保护和美化金属;还有氧化着色等。
⒉电池 汽车、宇宙飞船、照明、通讯、
生化和医学等方面都要用不同类型的化学电源。
⒊电分析 ⒋生物电化学
两类导体
A.自由电子作定向移动而导电
B.导电过程中导体本身不发生变化
C.温度升高,电阻也升高
D.导电总量全部由电子承担
1. 第一类导体:又称电子导体,如金属、石墨等。
A.正、负离子作反向移动而导电
B.导电过程中有化学反应发生
C.温度升高,电阻下降
D.导电总量分别由正、负离子分担
⒉ 第二类导体:又称离子导体,如电解质溶液、
熔融电解质等。
固体电解质,如 等,也属于离子导体,但它导电的机理比较复杂,导电能力不高,本章以讨论电解质水溶液为主。
正极、负极
电势低的极称为负极,电子从负极流向正极。在原电池中负极是阳极;在电解池中负极是阴极。
负极:
电势高的极称为正极,电流从正极流向负极。在原电池中正极是阴极;在电解池中正极是阳极。
正极:
阴极、阳极
发生还原作用的极称为阴极,在原电池中,阴极是正极;在电解池中,阴极是负极。
阴极:
(Cathode)
发生氧化作用的极称为阳极,在原电池中,阳极是负极;在电解池中,阳极是正极。
阳极:
(Anode)
原电池(galvanic cell)
Cu2+ + 2e-→ Cu(S)
发生还原作用,是阴极。电流由Cu极流向Zn极,Cu极电势高,是正极。
Cu电极:
Zn(S)→Zn2+ + 2e-
发生氧化作用,是阳极。电子由Zn极流向Cu极,Zn极电势低,是负极。
Zn电极:
电解池(electrolytic cell)
与外电源正极相接,是正极。发生氧化反应,是阳极。Cu(S)→ Cu2+ + 2e-
电极②:
与外电源负极相接,是负极。发生还原反应,是阴极。Cu2+ + 2e-→Cu(S)
电极①:
①
②
1. 做原电池的正极,即与较之活泼的金属镶嵌在一起。
3. 在铁的表面镀保护层。
2. 与电源的负极相连,即做电解池的阴极。
铁的防腐
1.我国煤炭资源丰富,廉价方便.
2.电能清洁安全,又快捷方便.
1.排出大量的温室效应气体.
2.有废气可能导致酸雨
3.废料
4.废水
5.能量转换效率低
火力发电的优势
火力发电的缺点
练习:下列哪些装置可以形成原电池:
硫酸铜溶液
Zn
Cu
(B)
稀硫酸
Zn
Cu
(E)
Zn
硫酸铜溶液
Zn
(A)
酒精
Zn
C
(C)
稀硫酸
稀硫酸
Cu
Zn
(F)
1. 原电池:把化学能转化为电能的装置
2. 原电池原理
原电池
负极(较活泼金属)
正极(较不活泼金属或非金属导体)
3. 构成原电池的条件
课堂小结
6. 两电极材料均为惰性电极,电极本身不发
生反应,而是由引入到两电极上的物质发生
反应,如燃料电池。
4. 活泼金属作负极,被腐蚀或消耗,发生氧
化反应,如:Cu-Zn原电池。
5. 两极都参加反应的原电池,如蓄电池,锂
电池和银锌电池等。
碱性电池具有容量大、放电电流大的特点,因而得到广泛应用。锌—锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为:
Zn(s)+2MnO2(s)+H2O( l )=Zn(OH)2(s)+Mn2O3(s)
下列说法错误的是( )
A. 电池工作时,锌失去电子
B. 电池正极的电极反应式为:
2MnO2(s)+H2O(1)+2e- =Mn2O3(s)+2OH- (aq)
C. 电池工作时,电子由正极通过外电路流向负极
D. 外电路中每通过O.2mol电子,锌的质量理论上
减小6.5g
课堂练习
C
2.银锌电池广泛用作各种电子仪器的电源,它的充电和放电过程可以表示为:
在此电池放电时,负极上发生反应的物质是( )???
A. Ag B. Zn(OH)2 C. Ag2O D. Zn
充电
放电
2Ag + Zn(OH)2 Ag2O + Zn + H2O
C
3.氢镍电池是近年开发出来的可充电电池,它可以取代会产生污染的铜镍电池。氢镍电池的总反应式是:
根据此反应式判断,下列叙述中正确的是( )
A.电池放电时,H2是负极
B.电池放电时,氢元素被氧化
C.电池充电时,镍元素被还原
D.电池充电时,化学能转化为电能
充电
放电
H2+NiO(OH)2 Ni(OH)2+H2O
C
4.判断下列哪些装置构成了原电池?若不是,请说明理由;若是,请指出正负极名称,并写出电极反应式.
①
②
③
(×)
(×)
(∨)
2H++2e-=H2↑
负极:
总反应:
正极:
Zn-2e-=Zn2+
Zn+2H+=Zn2++H2↑
⑤
④
(∨)
(∨)
负极:
正极:
总反应:
正极:
负极:
总反应:
Zn-2e-=Zn2+
2H++2e-=H2↑
Zn+2H+=Zn2++H2↑
Fe-2e-=Fe2+
Cu2++2e-=Cu
Fe+Cu2+=Fe2++Cu
Fe+CuSO4=Cu+FeSO4
⑦
⑥
(×)
(∨)
负极:
正极:
总反应:
Zn-2e-=Zn2+
Cu2++2e-=Cu
Zn+Cu2+=Zn2++Cu
或 Zn+CuSO4=ZnSO4+Cu
⑧
⑨
(×)
(∨)
负极:
正极:
总反应:
Fe-2e-=Fe2+
2H++2e-=H2↑
Fe+2H+= Fe2++H2↑
或 Fe+H2SO4=FeSO4+H2↑
5.如图所示,在铁圈和银圈的焊接处,用一根棉线将其悬在盛水的烧杯中,使之平衡;小心的向烧杯中央滴入CuSO4溶液,片刻后可观察到的现象是( )
D
A. 铁圈和银圈左右摇摆不定;
B. 保持平衡状态;
C. 铁圈向下倾斜;
D. 银圈向下倾斜;
6. X、Y、Z都是金属,把X浸入Z的硝酸盐溶液中,X的表面有Z析出,X与Y组成原电池时,Y是电池的负极。X、Y、Z三种金属的活动性顺序为( )
A.X>Y>Z B.X>Z>Y
C.Y>X>Z D.Y>Z>X
C
因为X置换出Z,所以金属性X>Z
负极的金属较活泼,所以Y>X
7.把 a、b、c、d四块金属片浸入稀硫酸中,用导线两两相连组成原电池。若a、b相连时,a为负极;c、d相连时,电流由d到c;a、c相连时,c极上产生大量气泡,b、d相连时,b上有大量气泡产生,则四种金属的活动性顺序由强到弱的为:( )
A.a > b > c > d B.a > c > d > b
C.c > a > b .> d D.b > d > c > a
B
8.下列装置中能组成原电池形成电流的是( )
C
Zn
Cu
H2SO4
A
Zn
Cu
CuSO4
A
Zn
Cu
酒精
A
Zn
H2SO4
A
Cu
H2SO4
C
酒精不是电解质
没有形成闭合回路
B
D
没有形成闭合回路
意大利解剖学家伽伐尼
1786年有一天,伽伐尼在实验室解剖青蛙,把剥了皮的蛙腿,用刀尖碰蛙腿上外露的神经时,蛙腿剧烈地痉挛,同时出现电火花。
导入新课
蛙腿
经过反复实验,他认为痉挛起因于动物体上本来就存在的电,他还把这种电叫做“生物电”。
伽伐尼的一个偶然发现,引出伏打电池的发明和电生理学的建立。
张奶奶自从镶了两颗假牙(一颗金牙、一颗钢牙)后,经常头痛失眠,这是为什么?
思考
电流的作用
蛙腿痉挛和镶假牙,这两种现象都是由电流引起的,那么这里的电流是如何产生的?
电能 化学能
电解
电池
一、化学能转化为电能
二、发展中的化学能源
第二节 化学能与电能
知识目标:
能力目标:
通过实验和科学探究形成原电池概念,初步了解原电池的组成,理解其工作原理。
(1)分析火力发电的原理及利弊,建立“将化学能直接转化为电能”的新思路,通过对氧化还原反应的本质的分析,提出实现新思路的各种推测和猜想等,培养创新思维能力。
教学目标
(2)通过实验和科学探究,对比、归纳,培养学生科学探究精神和分析、归纳的能力。
科学探究和实验中的良好态度和合作学习。
情感目标:
重点:
初步认识原电池概念、反应原理、构成及应用。认识化学能转化为电能对现代化的重大意义。
通过对原电池实验的探究,引导学生从电子转移角度理解化学能向电能转化的本质。
难点:
教学重难点
如何将化学能直接转化为电能,进而提高资源的利用率呢?
思考
一、化学能转化为电能
火力发电中,燃烧是化学能转变为电能的关键。燃烧作为氧化还原反应,本质是氧化剂与还原剂之间电子的转移。
能不能使氧化还原反应中的电子转移在不同区域内进行,从而形成电流,将化学能直接转化为电能呢?
将铜片和锌片分别插入稀硫酸溶液中,观察现象并解释原因。
稀H2SO4
Zn
Cu
现象:
解释:
Zn片上有气泡(H2), Zn片逐渐被腐蚀;Cu片无明显现象。
Zn + 2H+ = Zn2+ + H2↑
实验一
将铜片和锌片用导线连接插入稀硫酸溶液中,观察现象并解释原因。
现象:
解释:
Zn片上有少量气泡(H2), Zn片逐渐被腐蚀;Cu片上有气泡(H2)。
?
稀H2SO4
Zn
Cu
G
实验二
指针偏转,说明电路中有电流通过,说明发生了电子定向移动。
Zn片失去的电子经导线转移到Cu片上, Cu片周围的H+得电子。
把这种将化学能直接转变成电能的装置,称为原电池,例如:Cu-Zn原电池。
分析与讨论
Zn-2e- = Zn2+
2H++2e- = H2 ↑
Cu-Zn原电池的正负极?
Zn片(负极):
Cu片(正极):
Zn-2e- = Zn2+
2H+2e- = H2 ↑
总反应: Zn + 2H+ = Zn2+ + H2↑
表示下列原电池的放电过程:
稀H2SO4
Fe
Cu
稀HCl
Zn
Cu
1
2
随堂练
表示下列原电池的放电过程:
稀H2SO4
Mg
C
CuSO4溶液
Zn
C
3
4
化学能
热能
机械能
电能
火电站工作原理示意图
2017年 2018年
水电 14.70% 14.95%
火电 83.17% 82.86%
核电 1.92% 1.92%
其他 0.22% 0.26%
1. 燃烧反应是否是氧化还原反应?氧化还原反应的本质又是什么?
燃烧反应是氧化还原反应,氧化还原反应的本质是氧化剂与还原剂之间发生电子转移,引起化学键的重新结合,伴随体系能量的变化。
知识拓展
2.原电池的工作原理是什么?
原电池的工作原理是将氧化、还原两反应分割在正负两极同时不同地进行,电子从负极定向流入正极,从而产生了道路电流。
3.构成原电池的条件是什么?
(1)有活泼性,不同的两种金属或者一种金属与一种非金属导体(如石墨)或者一种金属与一种氧化物等作电极,并用导线连接或直接接触。
(2)两电极都插入电解质溶液(酸、碱、盐)中构成闭合回路。
(3)在电极表面上发生有电子转移的化学反应,即氧化—还原反应。
正负两极上进出电子总数相等,椐此电子守恒原理可进行两极上物质变化的计算。
利用原电池原理 可制作各种电池,如干电池、铅蓄电池、银锌电池、锂电池、氢氧燃料电池…。
4.如何计算原电池物质量的变化?
5.原电池原理还有哪些应用?
负极: 较活泼的金属
正极: 较不活泼的金属或非金属导体
Zn
Cu
A
-
+
稀硫酸
Zn
Fe
A
稀硫酸
C
Zn
Fe
C
A
稀硫酸
-
+
-
+
-
+
A
请根据下列原电池正负构造特点,总结出如何判断原电池的正负极
思考与交流
稀硫酸
动脑动手
有下列材料:Zn片(2片)、Cu片(2片)、导线、水果 (西红柿、苹果等)、电流计,请设计一个装置使电流计指针发生偏转,并画出设计草图。
二、发展中的化学电源
广泛用于卡式录音机、闪光灯、电动玩具、
袖珍电视机等。
1.干电池
Zn Zn2+ + 2e-
2NH4++ 2e- 2NH3 + H2
锌锰电池:使用最早的化学电池,属于一次性电池
正极反应为
其负极反应为
①铅蓄电池:最早使用的充电电池,它是用硬橡胶或透明塑料制成长方形外壳,在正极板上有一层棕褐色的PbO2,负极板是海绵状的金属铅,两极均浸入硫酸溶液中。
铅蓄电池电极反应:
负极:Pb + SO42-—2e-=PbSO4
正极:PbO2 + 4H+ + SO42- + 2e-=PbSO4 + 2H2O
铅蓄电池充电和放电的总化学方程式:
PbO2 + Pb + 2H2SO4 2PbSO4 + 2H2O
放电
充电
2.充电电池
充电电池又称二次电池,能够重复使用至一定的周期
②镍镉充电电池:它是一种体积少,具有残留性记忆的充电电池,可重复使用500次以上。它以Cd为负极,NiO(OH)为正极,KOH为电解液。广泛用于收录机、无线对讲机、电子闪光灯、电动剃须刀等,但有毒。
③锂离子电池:它是新一代可充电的绿色电,现已成为笔记本电脑、移动电话、摄像等低功耗电器的主流。
它是一种高效、环境友好的发电装置。它的电极材料一般为活性电极,具有很强的催化活性,如铂电极,活性炭电极等。电极反应为
负极:2H2 + 4OH- - 4e- 4H2O
正极:O2 + 2H2O + 4e- 4OH-
总反应:2H2 + O2=2H2O
该电池用金属铂片插入KOH溶液中作电极,又在两极上分别通甲烷和氧气。电极反应:
负极:CH4 + 10OH- - 8e-=CO32- + 7H2O
正极:2O2 + 4H2O + 8e-=8OH-
总反应:CH4 + 2O2 + 2KOH=K2CO3 + 3H2O
3.氢氧燃料电池
4.新型燃料电池
电化学研究对象
电化学主要是研究电能和化学能之间的相互转化及转化过程中有关规律的科学
知识拓展
电化学的用途
⒈电解 精炼和冶炼有色金属和稀有金属;电解法制备化工原料;电镀法保护和美化金属;还有氧化着色等。
⒉电池 汽车、宇宙飞船、照明、通讯、
生化和医学等方面都要用不同类型的化学电源。
⒊电分析 ⒋生物电化学
两类导体
A.自由电子作定向移动而导电
B.导电过程中导体本身不发生变化
C.温度升高,电阻也升高
D.导电总量全部由电子承担
1. 第一类导体:又称电子导体,如金属、石墨等。
A.正、负离子作反向移动而导电
B.导电过程中有化学反应发生
C.温度升高,电阻下降
D.导电总量分别由正、负离子分担
⒉ 第二类导体:又称离子导体,如电解质溶液、
熔融电解质等。
固体电解质,如 等,也属于离子导体,但它导电的机理比较复杂,导电能力不高,本章以讨论电解质水溶液为主。
正极、负极
电势低的极称为负极,电子从负极流向正极。在原电池中负极是阳极;在电解池中负极是阴极。
负极:
电势高的极称为正极,电流从正极流向负极。在原电池中正极是阴极;在电解池中正极是阳极。
正极:
阴极、阳极
发生还原作用的极称为阴极,在原电池中,阴极是正极;在电解池中,阴极是负极。
阴极:
(Cathode)
发生氧化作用的极称为阳极,在原电池中,阳极是负极;在电解池中,阳极是正极。
阳极:
(Anode)
原电池(galvanic cell)
Cu2+ + 2e-→ Cu(S)
发生还原作用,是阴极。电流由Cu极流向Zn极,Cu极电势高,是正极。
Cu电极:
Zn(S)→Zn2+ + 2e-
发生氧化作用,是阳极。电子由Zn极流向Cu极,Zn极电势低,是负极。
Zn电极:
电解池(electrolytic cell)
与外电源正极相接,是正极。发生氧化反应,是阳极。Cu(S)→ Cu2+ + 2e-
电极②:
与外电源负极相接,是负极。发生还原反应,是阴极。Cu2+ + 2e-→Cu(S)
电极①:
①
②
1. 做原电池的正极,即与较之活泼的金属镶嵌在一起。
3. 在铁的表面镀保护层。
2. 与电源的负极相连,即做电解池的阴极。
铁的防腐
1.我国煤炭资源丰富,廉价方便.
2.电能清洁安全,又快捷方便.
1.排出大量的温室效应气体.
2.有废气可能导致酸雨
3.废料
4.废水
5.能量转换效率低
火力发电的优势
火力发电的缺点
练习:下列哪些装置可以形成原电池:
硫酸铜溶液
Zn
Cu
(B)
稀硫酸
Zn
Cu
(E)
Zn
硫酸铜溶液
Zn
(A)
酒精
Zn
C
(C)
稀硫酸
稀硫酸
Cu
Zn
(F)
1. 原电池:把化学能转化为电能的装置
2. 原电池原理
原电池
负极(较活泼金属)
正极(较不活泼金属或非金属导体)
3. 构成原电池的条件
课堂小结
6. 两电极材料均为惰性电极,电极本身不发
生反应,而是由引入到两电极上的物质发生
反应,如燃料电池。
4. 活泼金属作负极,被腐蚀或消耗,发生氧
化反应,如:Cu-Zn原电池。
5. 两极都参加反应的原电池,如蓄电池,锂
电池和银锌电池等。
碱性电池具有容量大、放电电流大的特点,因而得到广泛应用。锌—锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为:
Zn(s)+2MnO2(s)+H2O( l )=Zn(OH)2(s)+Mn2O3(s)
下列说法错误的是( )
A. 电池工作时,锌失去电子
B. 电池正极的电极反应式为:
2MnO2(s)+H2O(1)+2e- =Mn2O3(s)+2OH- (aq)
C. 电池工作时,电子由正极通过外电路流向负极
D. 外电路中每通过O.2mol电子,锌的质量理论上
减小6.5g
课堂练习
C
2.银锌电池广泛用作各种电子仪器的电源,它的充电和放电过程可以表示为:
在此电池放电时,负极上发生反应的物质是( )???
A. Ag B. Zn(OH)2 C. Ag2O D. Zn
充电
放电
2Ag + Zn(OH)2 Ag2O + Zn + H2O
C
3.氢镍电池是近年开发出来的可充电电池,它可以取代会产生污染的铜镍电池。氢镍电池的总反应式是:
根据此反应式判断,下列叙述中正确的是( )
A.电池放电时,H2是负极
B.电池放电时,氢元素被氧化
C.电池充电时,镍元素被还原
D.电池充电时,化学能转化为电能
充电
放电
H2+NiO(OH)2 Ni(OH)2+H2O
C
4.判断下列哪些装置构成了原电池?若不是,请说明理由;若是,请指出正负极名称,并写出电极反应式.
①
②
③
(×)
(×)
(∨)
2H++2e-=H2↑
负极:
总反应:
正极:
Zn-2e-=Zn2+
Zn+2H+=Zn2++H2↑
⑤
④
(∨)
(∨)
负极:
正极:
总反应:
正极:
负极:
总反应:
Zn-2e-=Zn2+
2H++2e-=H2↑
Zn+2H+=Zn2++H2↑
Fe-2e-=Fe2+
Cu2++2e-=Cu
Fe+Cu2+=Fe2++Cu
Fe+CuSO4=Cu+FeSO4
⑦
⑥
(×)
(∨)
负极:
正极:
总反应:
Zn-2e-=Zn2+
Cu2++2e-=Cu
Zn+Cu2+=Zn2++Cu
或 Zn+CuSO4=ZnSO4+Cu
⑧
⑨
(×)
(∨)
负极:
正极:
总反应:
Fe-2e-=Fe2+
2H++2e-=H2↑
Fe+2H+= Fe2++H2↑
或 Fe+H2SO4=FeSO4+H2↑
5.如图所示,在铁圈和银圈的焊接处,用一根棉线将其悬在盛水的烧杯中,使之平衡;小心的向烧杯中央滴入CuSO4溶液,片刻后可观察到的现象是( )
D
A. 铁圈和银圈左右摇摆不定;
B. 保持平衡状态;
C. 铁圈向下倾斜;
D. 银圈向下倾斜;
6. X、Y、Z都是金属,把X浸入Z的硝酸盐溶液中,X的表面有Z析出,X与Y组成原电池时,Y是电池的负极。X、Y、Z三种金属的活动性顺序为( )
A.X>Y>Z B.X>Z>Y
C.Y>X>Z D.Y>Z>X
C
因为X置换出Z,所以金属性X>Z
负极的金属较活泼,所以Y>X
7.把 a、b、c、d四块金属片浸入稀硫酸中,用导线两两相连组成原电池。若a、b相连时,a为负极;c、d相连时,电流由d到c;a、c相连时,c极上产生大量气泡,b、d相连时,b上有大量气泡产生,则四种金属的活动性顺序由强到弱的为:( )
A.a > b > c > d B.a > c > d > b
C.c > a > b .> d D.b > d > c > a
B
8.下列装置中能组成原电池形成电流的是( )
C
Zn
Cu
H2SO4
A
Zn
Cu
CuSO4
A
Zn
Cu
酒精
A
Zn
H2SO4
A
Cu
H2SO4
C
酒精不是电解质
没有形成闭合回路
B
D
没有形成闭合回路
