人教化学必修2第2章第二节 化学能与电能(共32张PPT)
文档属性
| 名称 | 人教化学必修2第2章第二节 化学能与电能(共32张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 3.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-02-26 00:00:00 | ||
图片预览







文档简介
(共32张PPT)
电能是现代社会中应用最广泛、使用最方便、污染最小的一种二次能源,又称为电力。
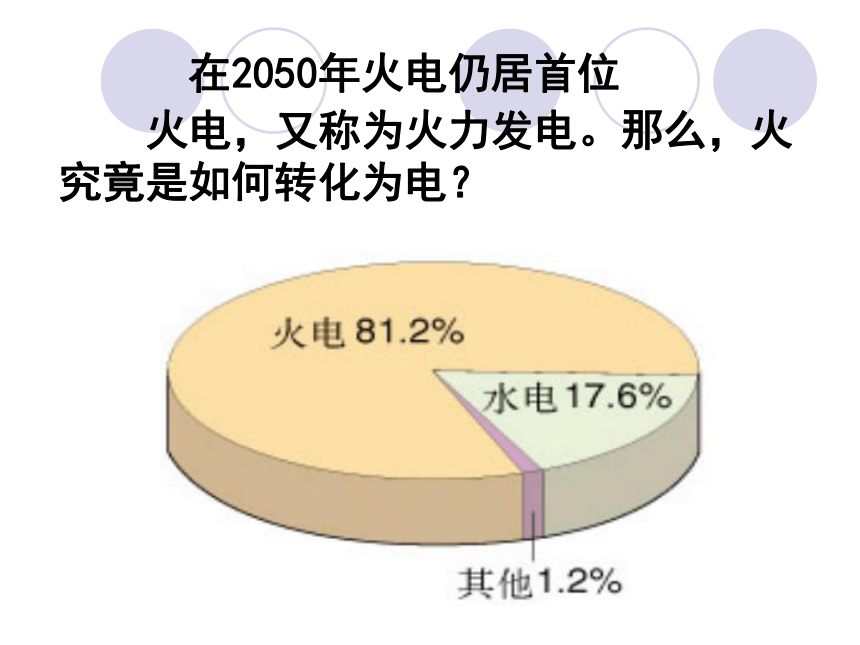
估计在2050年火电仍居首位
火电,又称为火力发电。那么,火究竟是如何转化为电?
火力发电工作原理示意图
火电站从开始到结束能量是如何转化的?
化石燃料
化学能
燃烧
热能
蒸汽
机械能
电能
发电机
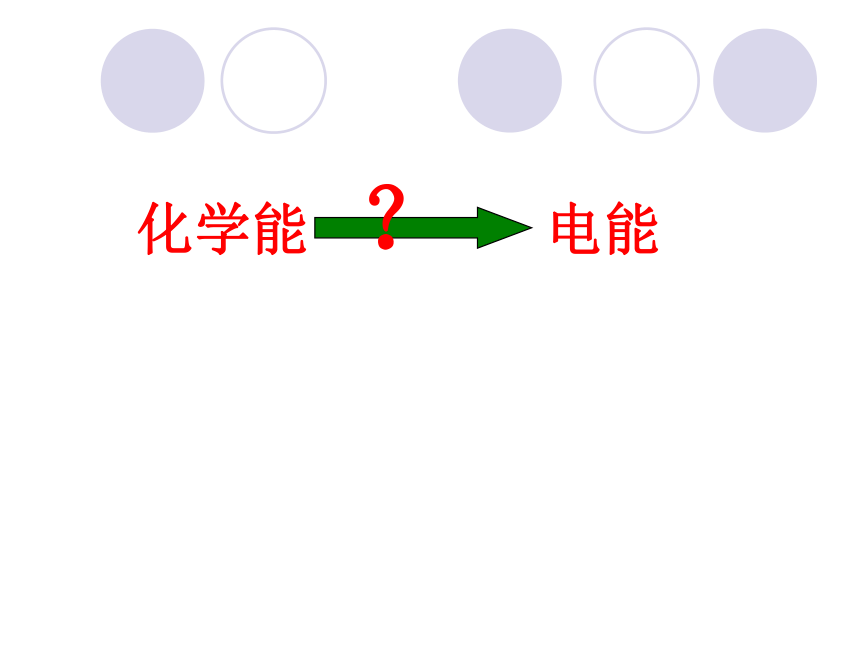
化学能 电能
?
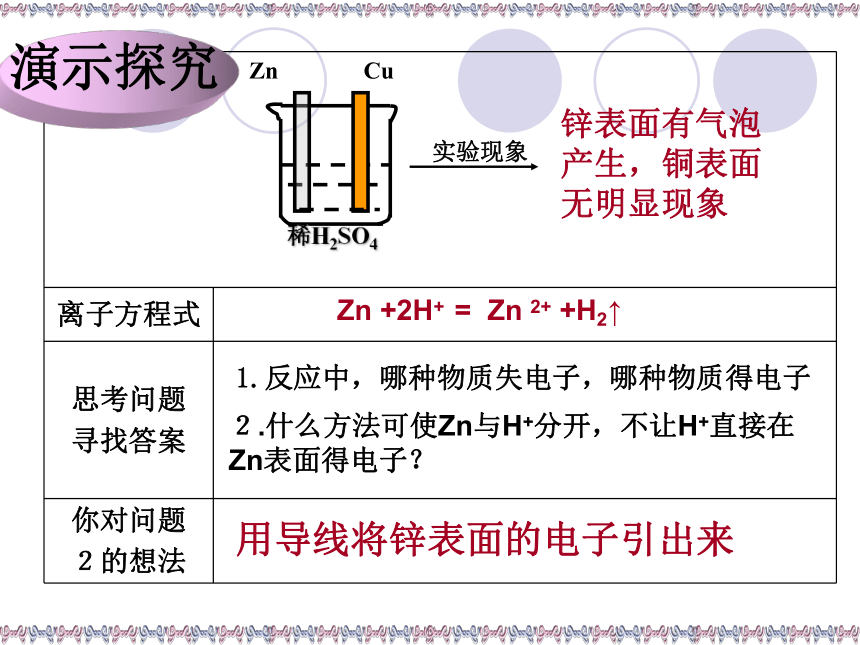
锌表面有气泡产生,铜表面无明显现象
1.反应中,哪种物质失电子,哪种物质得电子
用导线将锌表面的电子引出来
Zn +2H+ = Zn 2+ +H2↑
2.什么方法可使Zn与H+分开,不让H+直接在Zn表面得电子?
离子方程式
思考问题
寻找答案
你对问题
2的想法
演示探究
Cu起传导电子的作用。
Zn + 2H+ = Zn 2+ +H2↑
大量气泡从铜片逸出,锌片部分溶解
1.H+得到的电子是Cu失去的吗?
2.在这个过程中Cu起什么作用?
3.你怎样才能知道导线中有电子通过?
可用电流表测电流及方向。
离子方程式
思考问题
寻找答案
组内交流 列出想法
演示探究
化学能直接转化为电能
1.电子从Zn到H+经历了哪些途径?
2.你认为这个过程能量是如何转化的?
锌表面无气泡,
铜表面有气泡,
电流表发生偏转。
解释实验现象
思考问题
寻找答案
组内交流
列出想法
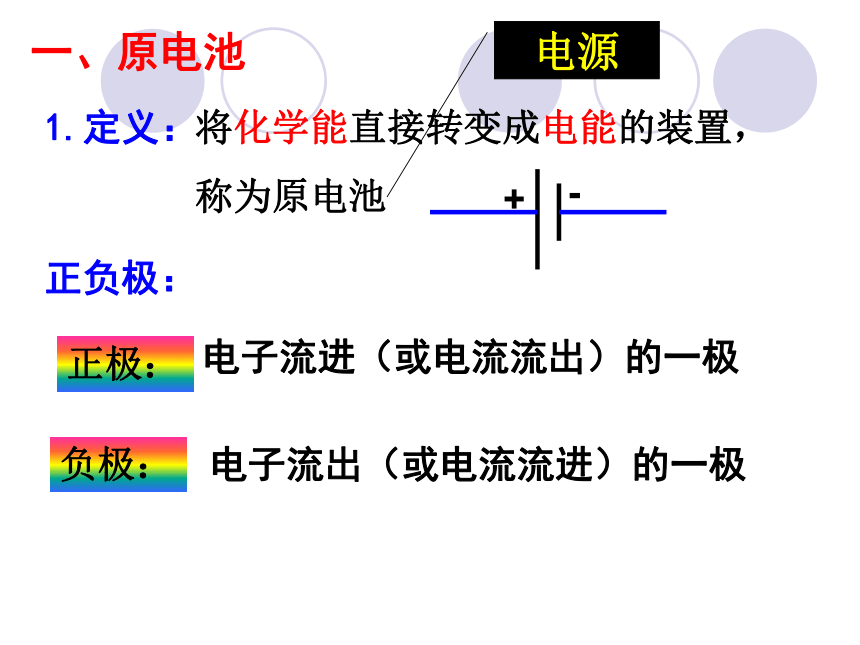
一、原电池
1.定义:
将化学能直接转变成电能的装置,
称为原电池
电源
正负极:
负极:
电子流进(或电流流出)的一极
正极:
电子流出(或电流流进)的一极
Zn-2e-=Zn2+
2H++2e-=H2↑
Zn+2H+=Zn2++H2↑
负极
正极
还原反应
氧化反应
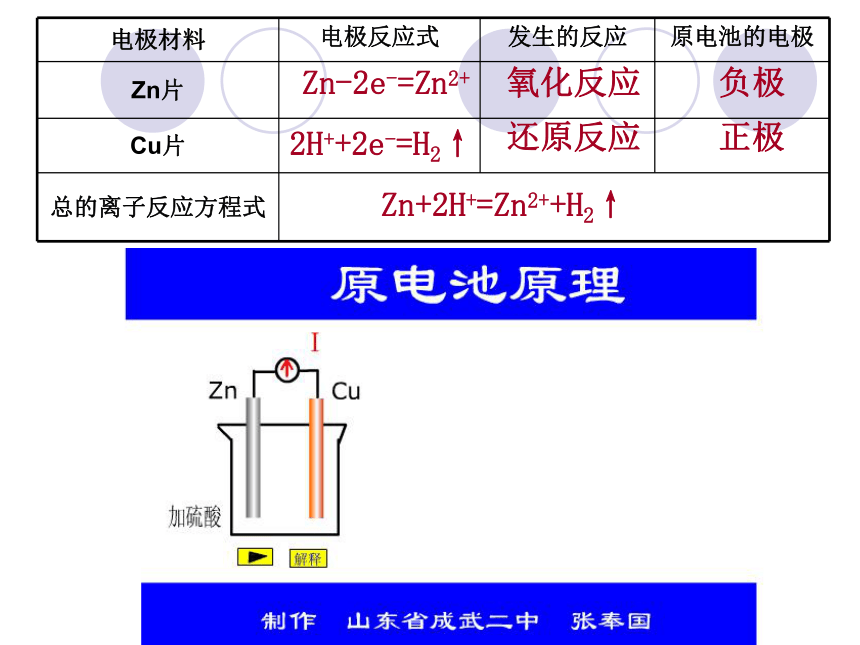
电极材料 电极反应式 发生的反应 原电池的电极
Zn片
Cu片
总的离子反应方程式
课堂小结1:
负极
正极
氧化反应
还原反应
溶解
有气泡冒出
电子流出
电子流入
活泼性较强
的金属
活泼性较弱
的金属
阴离子移向
阳离子移向
电极名称
电极材料
电子流向
反应类型
实验现象
离子流向
2、原电池反应原理
①粒子流向
电子:负极→正极
电流:正极→负极
溶液中阴离子→负极
溶液中阳离子→正极
②电极
反应
负极:氧化反应
活泼金属失电子变阳离子
正极:还原反应
溶液中离子得电子
总反应:负极金属与电解质溶液的离子反应
3、原电池的正负极的判断方法
微观判断
(根据电子流动方向)
电子流出的极
电子流入的极
——负极
——正极
较活泼的电极材料
较不活泼的电极材料
质量增加的电极
工作后
质量减少的电极
——负极
——正极
——正极
——负极
工作后,有气泡冒出的电极为正极
发生氧化反应的极
发生还原反应的极
宏观判断:
①根据电极材料
②根据原电池电极
发生的反应
③根据电极质量的变
化
④根据电极有气泡冒出:
——负极
——正极
H2SO4 (aq)
CuSO4 (aq)
负极( ): .
正极( ): .
总反应式: .
负极( ): .
正极( ): .
总反应式: .
课堂练习:请在图上标出电子的流动方向和电流方向,并判断正负极,写出电极反应式和总反应式.
Ag
Fe
Fe
Ag
Fe-2e - = Fe 2+
2H++2e - = H2↑
Fe+2H+ = Fe 2+ +H2↑
Zn
Cu
Zn-2e - = Zn2+
Cu2+ +2e - = Cu
Zn+Cu2+ = Zn2 ++ Cu
试着说说原电池的构成有什么条件?
*************************************************************************************
*************************************************************************************
① ② ③ ④ ⑤
⑥
实验探究
偏转
两极材料不同
有两种活泼性不同的金
属(或非金属)作电极
不偏转
①
②
原电池 ① ②
电流表指针 偏转
区别
结论
实验探究
不偏转
溶液不同
电极材料均插入
电解质溶液中
偏转
③
④
原电池 ③ ④
电流表指针 偏转
区别
结论
实验探究
⑤
不偏转
电极材料不同
能自发地发生氧化还原反应
原电池 ⑤
电流表指针 偏转
区别
结论
不偏转
容器不同
两极相连形成闭合回路
实验探究
⑥
电流表指针 原电池 ⑥组
偏转
区别
结论
1.有两种活泼性不同的金属(或非金属)
作电极
3.能自发地发生氧化还原反应
四.原电池的构成条件
4.两极相连形成闭合回路
2.电极材料均插入电解质溶液中
3.如何书写电极反应方程式
负极(锌片): Zn -2e - = Zn 2+
负极(锌片): Zn -2e - = Zn 2+
正极(石墨): 2H++2e - = H2 ↑
正极(铜片): Cu2+ + 2e - = Cu
总反应: Zn + 2H+ = Zn 2+ + H2 ↑
总反应: Zn + Cu2+ = Zn 2+ + Cu
①制作化学电源
②加快反应速率:
例如,实验室制H2时,由于锌太纯,反应一般较慢,可加入少量CuSO4以加快反应速率。
③判断金属活动性的强弱
④揭示钢铁腐蚀的原因及防止钢铁的腐蚀。
钢铁中含有碳,可与Fe组成原电池,发生原电池反应而使钢铁遭到腐蚀
一、原电池
6.原电池原理的应用:
1.下列装置中能组成原电池形成电流的是( )
C
2.某金属能跟稀盐酸作用放出氢气,该金属与锌组成原电池时,锌为负极,此金属是( )
A.Mg B.Fe C.Al D.Cu
B
3.由铜锌和稀硫酸组成的原电池工作时,电解质溶液的 PH( )
A.不 B先变大后变小
C逐渐变大 D.逐渐变小
C
5.一个电池反应的离子方程式是 Zn+Cu2+=Zn2+ +Cu,
该反应的的原电池正确组合是( )
C
A B C D
正极 Zn Cu Cu Fe
负极 Cu Zn Zn Zn
电解质溶液 CuCl2 H2SO4 CuSO4 HCl
4.把a、b、c、d四块金属片浸入稀硫酸中,用导线两两相连组成原电池。若a、b相连时,a为负极;c、d相连时,电流由d到c;a、c相连时,c极上产生大量气泡,b、d相连时,b上有大量气泡产生,则四种金属的活动性顺序由强到弱的为( )
A.a > b > c > d B.a > c > d > b
C.c > a > b > d D.b > d > c > a
B
二、发展中的化学电源
干
电
池
上图是锌-锰干电池
负极:Zn-- 2e- ==Zn2+
正极(C):2NH4++ 2e- ==2NH3↑+2H2 ↑
铅蓄电池
锂电池
锂是密度最小的金属,用锂作为电池的负极,跟用相同质量的其他金属作负极相比较,使用寿命大大延长。
新型燃料电池
燃料电池不是把还原剂、氧化剂物质全部贮藏在电池内,而是在工作时,不断从外界输入,同时将电极反应产物不断排出电池
负极:2H2-4e- +4OH- ==4H2O
正极:O2+2H2O+4e- ==4OH-
总反应:2H2+O2==2H2O
电极:多孔镍 电解质:KOH
电能是现代社会中应用最广泛、使用最方便、污染最小的一种二次能源,又称为电力。
估计在2050年火电仍居首位
火电,又称为火力发电。那么,火究竟是如何转化为电?
火力发电工作原理示意图
火电站从开始到结束能量是如何转化的?
化石燃料
化学能
燃烧
热能
蒸汽
机械能
电能
发电机
化学能 电能
?
锌表面有气泡产生,铜表面无明显现象
1.反应中,哪种物质失电子,哪种物质得电子
用导线将锌表面的电子引出来
Zn +2H+ = Zn 2+ +H2↑
2.什么方法可使Zn与H+分开,不让H+直接在Zn表面得电子?
离子方程式
思考问题
寻找答案
你对问题
2的想法
演示探究
Cu起传导电子的作用。
Zn + 2H+ = Zn 2+ +H2↑
大量气泡从铜片逸出,锌片部分溶解
1.H+得到的电子是Cu失去的吗?
2.在这个过程中Cu起什么作用?
3.你怎样才能知道导线中有电子通过?
可用电流表测电流及方向。
离子方程式
思考问题
寻找答案
组内交流 列出想法
演示探究
化学能直接转化为电能
1.电子从Zn到H+经历了哪些途径?
2.你认为这个过程能量是如何转化的?
锌表面无气泡,
铜表面有气泡,
电流表发生偏转。
解释实验现象
思考问题
寻找答案
组内交流
列出想法
一、原电池
1.定义:
将化学能直接转变成电能的装置,
称为原电池
电源
正负极:
负极:
电子流进(或电流流出)的一极
正极:
电子流出(或电流流进)的一极
Zn-2e-=Zn2+
2H++2e-=H2↑
Zn+2H+=Zn2++H2↑
负极
正极
还原反应
氧化反应
电极材料 电极反应式 发生的反应 原电池的电极
Zn片
Cu片
总的离子反应方程式
课堂小结1:
负极
正极
氧化反应
还原反应
溶解
有气泡冒出
电子流出
电子流入
活泼性较强
的金属
活泼性较弱
的金属
阴离子移向
阳离子移向
电极名称
电极材料
电子流向
反应类型
实验现象
离子流向
2、原电池反应原理
①粒子流向
电子:负极→正极
电流:正极→负极
溶液中阴离子→负极
溶液中阳离子→正极
②电极
反应
负极:氧化反应
活泼金属失电子变阳离子
正极:还原反应
溶液中离子得电子
总反应:负极金属与电解质溶液的离子反应
3、原电池的正负极的判断方法
微观判断
(根据电子流动方向)
电子流出的极
电子流入的极
——负极
——正极
较活泼的电极材料
较不活泼的电极材料
质量增加的电极
工作后
质量减少的电极
——负极
——正极
——正极
——负极
工作后,有气泡冒出的电极为正极
发生氧化反应的极
发生还原反应的极
宏观判断:
①根据电极材料
②根据原电池电极
发生的反应
③根据电极质量的变
化
④根据电极有气泡冒出:
——负极
——正极
H2SO4 (aq)
CuSO4 (aq)
负极( ): .
正极( ): .
总反应式: .
负极( ): .
正极( ): .
总反应式: .
课堂练习:请在图上标出电子的流动方向和电流方向,并判断正负极,写出电极反应式和总反应式.
Ag
Fe
Fe
Ag
Fe-2e - = Fe 2+
2H++2e - = H2↑
Fe+2H+ = Fe 2+ +H2↑
Zn
Cu
Zn-2e - = Zn2+
Cu2+ +2e - = Cu
Zn+Cu2+ = Zn2 ++ Cu
试着说说原电池的构成有什么条件?
*************************************************************************************
*************************************************************************************
① ② ③ ④ ⑤
⑥
实验探究
偏转
两极材料不同
有两种活泼性不同的金
属(或非金属)作电极
不偏转
①
②
原电池 ① ②
电流表指针 偏转
区别
结论
实验探究
不偏转
溶液不同
电极材料均插入
电解质溶液中
偏转
③
④
原电池 ③ ④
电流表指针 偏转
区别
结论
实验探究
⑤
不偏转
电极材料不同
能自发地发生氧化还原反应
原电池 ⑤
电流表指针 偏转
区别
结论
不偏转
容器不同
两极相连形成闭合回路
实验探究
⑥
电流表指针 原电池 ⑥组
偏转
区别
结论
1.有两种活泼性不同的金属(或非金属)
作电极
3.能自发地发生氧化还原反应
四.原电池的构成条件
4.两极相连形成闭合回路
2.电极材料均插入电解质溶液中
3.如何书写电极反应方程式
负极(锌片): Zn -2e - = Zn 2+
负极(锌片): Zn -2e - = Zn 2+
正极(石墨): 2H++2e - = H2 ↑
正极(铜片): Cu2+ + 2e - = Cu
总反应: Zn + 2H+ = Zn 2+ + H2 ↑
总反应: Zn + Cu2+ = Zn 2+ + Cu
①制作化学电源
②加快反应速率:
例如,实验室制H2时,由于锌太纯,反应一般较慢,可加入少量CuSO4以加快反应速率。
③判断金属活动性的强弱
④揭示钢铁腐蚀的原因及防止钢铁的腐蚀。
钢铁中含有碳,可与Fe组成原电池,发生原电池反应而使钢铁遭到腐蚀
一、原电池
6.原电池原理的应用:
1.下列装置中能组成原电池形成电流的是( )
C
2.某金属能跟稀盐酸作用放出氢气,该金属与锌组成原电池时,锌为负极,此金属是( )
A.Mg B.Fe C.Al D.Cu
B
3.由铜锌和稀硫酸组成的原电池工作时,电解质溶液的 PH( )
A.不 B先变大后变小
C逐渐变大 D.逐渐变小
C
5.一个电池反应的离子方程式是 Zn+Cu2+=Zn2+ +Cu,
该反应的的原电池正确组合是( )
C
A B C D
正极 Zn Cu Cu Fe
负极 Cu Zn Zn Zn
电解质溶液 CuCl2 H2SO4 CuSO4 HCl
4.把a、b、c、d四块金属片浸入稀硫酸中,用导线两两相连组成原电池。若a、b相连时,a为负极;c、d相连时,电流由d到c;a、c相连时,c极上产生大量气泡,b、d相连时,b上有大量气泡产生,则四种金属的活动性顺序由强到弱的为( )
A.a > b > c > d B.a > c > d > b
C.c > a > b > d D.b > d > c > a
B
二、发展中的化学电源
干
电
池
上图是锌-锰干电池
负极:Zn-- 2e- ==Zn2+
正极(C):2NH4++ 2e- ==2NH3↑+2H2 ↑
铅蓄电池
锂电池
锂是密度最小的金属,用锂作为电池的负极,跟用相同质量的其他金属作负极相比较,使用寿命大大延长。
新型燃料电池
燃料电池不是把还原剂、氧化剂物质全部贮藏在电池内,而是在工作时,不断从外界输入,同时将电极反应产物不断排出电池
负极:2H2-4e- +4OH- ==4H2O
正极:O2+2H2O+4e- ==4OH-
总反应:2H2+O2==2H2O
电极:多孔镍 电解质:KOH
