人教版高一化学必修2:2.2.2 《发展中的化学电源》课件(45张ppt)
文档属性
| 名称 | 人教版高一化学必修2:2.2.2 《发展中的化学电源》课件(45张ppt) |

|
|
| 格式 | zip | ||
| 文件大小 | 2.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-02-27 00:00:00 | ||
图片预览









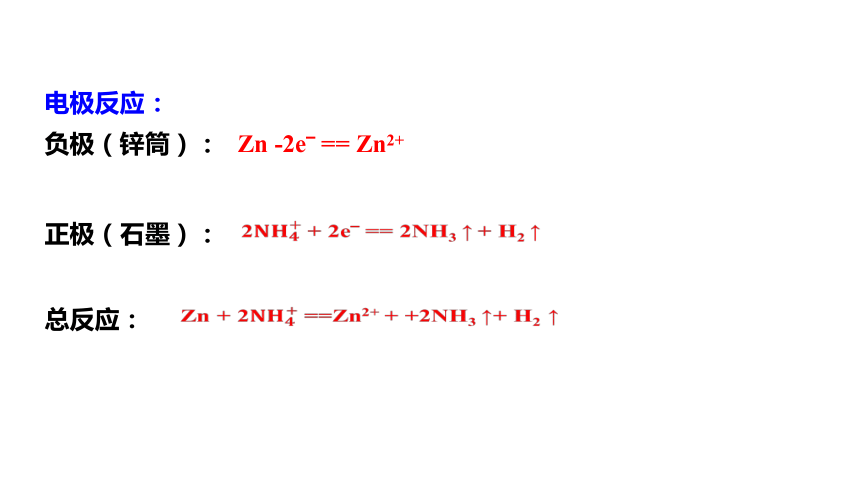
文档简介
(共45张PPT)
组织建设
发展中的化学电源
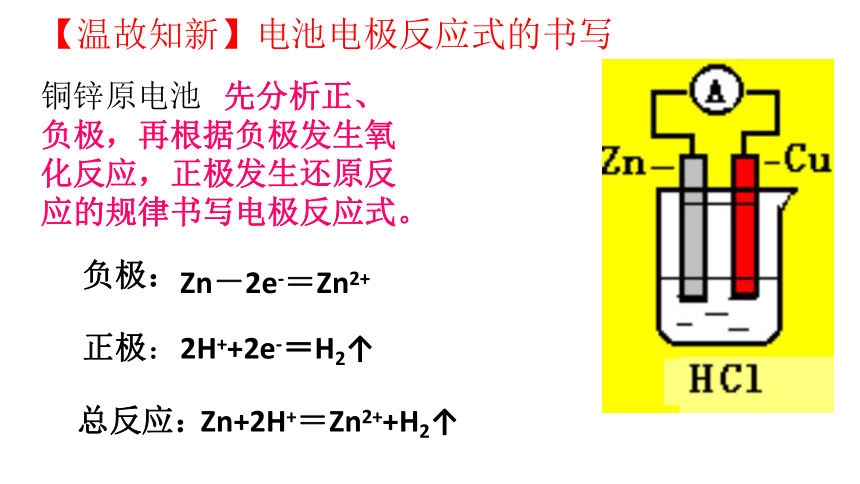
【温故知新】电池电极反应式的书写
铜锌原电池 先分析正、负极,再根据负极发生氧化反应,正极发生还原反应的规律书写电极反应式。
2H++2e-=H2↑
负极:
总反应:
正极:
Zn-2e-=Zn2+
Zn+2H+=Zn2++H2↑
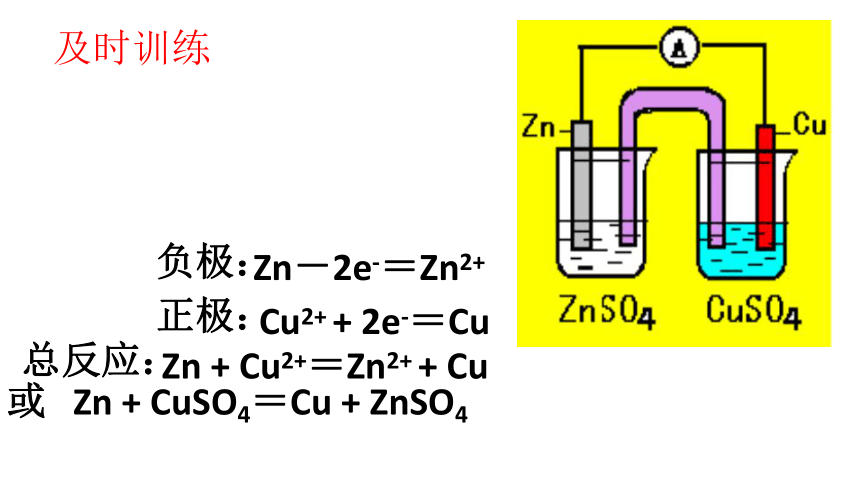
正极:
负极:
总反应:
Zn-2e-=Zn2+
Cu2+ + 2e-=Cu
Zn + Cu2+=Zn2+ + Cu
或 Zn + CuSO4=Cu + ZnSO4
及时训练
发明电池的故事
伏特是意大利帕维亚大学的研究电学的物理学家。
有一天,伏特看了一位名叫加伐尼的解剖学家的一篇论文,说动物肌肉里贮存着电,可以用金属接触肌肉把电引出来。看了这篇论文,伏特非常兴奋,便决定亲自来做这个实验。他用许多只活青蛙反复实验,终于发现,实际情况并不像加伐尼所说的那样,而是两种不同的金属接触产生的电流,才使蛙腿的肌肉充电而收缩。
为了证明自己的发现是正确的,伏特决定更深入地了解电的来源。
一天,他拿出一块锡片和一枚银币,把这两种金属放在自己的舌头上,然后叫助手将金属导线把它们连接起来,刹时,他感到满嘴的酸味儿。
接着,他将银币和锡片交换了位置,当助手将金属导线接通的一瞬间,伏特感到满嘴的咸味。
这些实验证明,两种金属在一定的条件下就能产生电流。伏特想,只要能把这种电流引出来,就能大有作用。
伏特经过反复实验,终于发明了被后人称做“伏特电堆”的电池,这就是在铜板和锌板中间夹上卡纸和用盐水浸过的布片,一层一层堆起来的蓄电池。这种电池,今天仍然在使用着
为了纪念他的贡献,人们把电压的计量单位叫做伏特,简称伏,符号V。比如我们手电筒里的电池的电压是1.5伏特,我们家里的电灯的电压是220伏特。
化学电池的分类
一次电池(干电池):电池消耗到一定程度,就不能使用;
二次电池(充电电池或蓄电池):放电后可以再充电重新使用;
燃料电池:一种将燃料和氧化剂的化学能直接转换成电能的化学电池。
化学电池优点
(1)能量转换效率高,供能稳定可靠。
(2)可以制成各种形状和大小、不同容量和电压的电池和电池组,使用方便。
(3)易维护,可在各种环境下工作。
判断电池优劣的标准
(1)比能量
[符号(A·h/kg),(A·h/L)]
指电池单位质量或单位体积所能输出电能的多少
(2)比功率
[符号是W/kg,W/L)]
指电池单位质量或单位体积所能输出功率的大小
(3)电池的储存时间的长短
除特殊情况外,质量轻、体积小而输出电能多、功率大、储存时间长的电池,其质量好。
干电池
碱性电池
蓄电池
锂离子电池
燃料电池
干电池
碱性电池
1. 干电池结构及电极反应原理
锌筒
石墨棒
MnO2和C
普通锌-锰干电池的结构
NH4Cl、ZnCl2和 H2O等
1.1 普通锌锰干电池(酸性)
负极(锌筒):
正极(石墨):
总反应:
电极反应:
Zn -2e? == Zn2+
2 + 2e? == 2NH3 ↑ + H2 ↑
Zn + 2 ==Zn2+ + +2NH3 ↑+ H2 ↑
特点:
a:一次性电池,不可逆。
b:用KOH代替NH4Cl能提高 性能,延长寿命。
思考与交流:
锌锰干电池即使不用,放置过久,也会失效(作为电解质的糊状NH4Cl显酸性),为了充分而有效地利用锌锰干电池,在购买、保存和使用方面你有何经验与建议?请与同学交流分享。
碱性电池
1.2 碱性干电池
碱性电池是个人音响、照相机等的首选电源。
碱性电池
电解液: 中性NH4Cl→碱性KOH(离子导电性更好)
负极:锌片→锌粉(反应面积成倍增长,使放电电流大幅度提高)
优点:比能量和储存时间有所提高,适用于大电流和连续放电
2. 充电电池
又称二次电池,能够重复使用至一定的周期。
铅蓄电池:最早使用的充电电池。
镍镉充电电池:它是一种体积少,具有残留性记忆的充电电池,可重复使用500次以上。
铅蓄电池
铅蓄电池
(1)电极材料及原料
(2)电解质溶液
(3)电极反应式:
正极:PbO2 负极:Pb
H2SO4溶液
负极(Pb): Pb- 2e-+ SO4 2 - =PbSO4
正极(PbO2): PbO2+4H++SO42 -+ 2e-= PbSO4 +2H2O
铅蓄电池充电和放电的总化学方程式:
PbO2 + Pb + 2H2SO4 2PbSO4 + 2H2O
放电
充电
用途:目前汽车上使用的电瓶大多仍是铅蓄电池,它还广泛用于国防、生产、生活等领域。
汽车用蓄电池
特点:铅蓄电池的电压稳定,使用方便安全可靠,可再次充电使用。
2.2 镍镉电池
镉有致癌作用,有被镍氢电池取代的趋势。
H2+NiO(OH)2 Ni(OH)2+H2O 。
放电
充电
镍
镉
电
池
电极反应(KOH为电解液)
用途:广泛用于收录机、无线对讲机、电子闪光灯、电动剃须刀等。
2NiO(OH) + 2H2O + Cd 2Ni(OH)2+ Cd(OH)2
放电
充电
锂离子电池
2.3 锂离子电池:
它是新一代可充电的绿色电池,现已成为笔记本电脑、移动电话、摄像机等低功耗电器的主流。
负极:Li - e— ==Li+
正极:MnO2 + e — + Li+ == LiMnO2
总反应: Li+ MnO2== LiMnO2
氢氧燃料电池
3. 燃料电池
氢氧燃料电池:它是一种高效、环境友好的发电装置。它的电极材料一般为活性电极,具有很强的催化活性,如铂电极,活性炭电极等。
燃料电池不是把还原剂、氧化剂物质全部贮藏在电池内,而是在工作时,不断从外界输入,同时将电极反应产物不断排出电池。
燃料电池的规律
①燃料做负极,助燃剂氧气为正极
②电极材料一般不参加化学反应,只起传导电子的作用。
③能量转化率高(超过80%),普通的只有30%,有利于节约能源。
燃料电池与前几种电池的差别
①氧化剂与还原剂在工作时不断补充;
②反应产物不断排出
3.1 酸性氢氧燃料电池
H2
O2
H2O
电解质:H2SO4溶液
使用铂电极
电极反应
负极:2H2 - 4e — == 4H+
正极:O2 + 4H+ + 4e— == 2H2O
总反应:2H2 + O2==2H2O
电极反应
负极:2H2 + 4OH—-4e— == 4H2O
正极:O2 + 2H2O + 4e— == 4OH—
总反应:2H2 + O2==2H2O
3.2 碱性氢氧燃料电池
KOH溶液
O2
H2O
a极 b极
O2→ O2- →
酸性环境: O2- + 2H+ == H2O
碱性环境: O2- + H2O == 2OH-
注:
用途:氢氧燃料电池目前已应用于航天、军事通讯、电视中继站等领域
H2
怎样书写燃料电池的电极反应式和总反应式?
书写步骤:(1)写出燃烧反应,根据电解液改写燃料电池总反应;
(2)写出正极的电极反应式(一般较简单);
(3)由燃料电池总反应减去正极的电极反应式得负极的电极反应式。
正极反应一般为
①酸性介质
②碱性介质
O2+4H++4e-=2H2O
O2+2H2O+4e-=4OH-
燃 料 电 池
介质 电池反应: 2H2 +O2 = 2H2O
酸性 负极
正极
中性 负极
正极
碱性 负极
正极
2H2 - 4e- = 4H+
O2 + 4H+ + 4e-= 2H2O
2H2 - 4e- = 4H+
O2 + 2H2O + 4e-= 4OH-
2H2 +4OH-- 4e- = 4H2O
O2 + 2H2O + 4e-= 4OH-
(2)CH4燃料电池(碱性介质)
1.燃烧总化学反应: CH4+2O2→CO2+2H2O
2.燃料电池总反应:
3.正极:
4.负极:
CH4+2OH-+2O2 = CO3 2 -+3H2O
2O2+4H2O+8e-= 8OH-
CH4+10OH--8e-= CO32-+7H2O
CH4燃料电池(酸性介质)
1、燃料电池总反应: CH4+2O2=CO2+2H2O ①
2、正极反应:O2+4H++4e-=2H2O ②
3、负极反应:①-②×2,得:
CH4-8e-+2H2O=CO2+8H+
(3)甲醇燃料电池(酸性介质)
总反应:
2CH4O + 3O2 === 2CO2 + 4H2O
正极的电极反应式为:
3O2+12e-+12H+ === 6H2O
负极的电极反应式为:
2CH4O-12e-+2H2O === 12H++ 2CO2
甲醇燃料电池(碱性介质)
总反应式:
2CH4O + 3O2 +4KOH === 2K2CO3 + 6H2O
正极的电极反应式为:
3O2+12e- + 6H20===12OH-
负极的电极反应式为:
2CH4O -12e-+16OH- === 2CO32- + 12H2O
(4)海水电池
1991年,我国首创以铝-空气-海水为能源的新型电
池,用作航海标志灯。该电池以取之不的海水为电
解质,靠空气中的氧气使铝不断氧化而产生电流。
这种海水电池的能量比“干电池”高20~50倍。电极
反应式为:
负极:
正极:
电池总反应:
4Al - 12e-= 4Al 3+
3O2+ 6H2O +12e-= 12 OH -
4Al+3O2+ 6H2O = 4Al (OH)3↓
使用燃料电池的汽车
改变燃料
正极:
2O2 + 4H2O + 8e— == 8OH—
负极:
CH4 + 10OH— – 8e— == + 7H2O
CH4 +2O2 == CO2 + 2H2O
CH4 +2O2 + 2OH— == + 2H2O
O2
总反应:
CH4
其他电池
空气电池
电池的发展方向
光电池使用方便,特别是近年来微小型半导体逆变器迅速发展,应用更快捷。美、日、欧和发展中国家都制定出庞大的光伏技术发展计划,开发方向是大幅度提高光电池转换效率和稳定性,降低成本,不断扩大产业.目前已有80多个国家和地区形成商业化,半商业化生产能力,年均增长达16,市场开拓从空间转向地面系统应用。
废电池对环境的危害
电池中含有汞、镉、铅等有毒金属。随意丢弃废电池会对环境造成严重的污染。
上世纪50年代,震惊世界的日本“水俣病”就是因汞中毒引起的。
减 少 污 染 节 约 资 源
1.废电池的污染引起人们的广泛重视,废电池中对环境形成污染的主要物质是( )
A.锌 B.汞 C.石墨 D.二氧化锰
2.实验室中制取氢气,最好的方法是( )
A.纯锌与稀硫酸反应
B.纯锌与浓硫酸反应
C.纯锌与稀盐酸反应
D.粗锌(含铜、银)与稀硫酸反应
B
D
3.某金属能和盐酸反应生成氢气,该金属与锌组成原电池时,锌为负极,则该金属可能为( )
A.铝 B.铜
C.锡 D.硅
C
4.已知空气-锌电池的电极反应为:
锌片:Zn+2OH—-2e — == ZnO+H2O
石墨:O2+2H2O+4e — == 4OH —
根据此判断,锌片是( )
A.负极,并被氧化 B.负极,并被还原
C.正极,并被氧化 D.正极,并被还原
A
5.一个原电池的总反应的离子方程式是Zn+Cu2+==Zn2++Cu,该反应的原电池的组成正确的是( )
C
6.表明金属甲的活动性比金属乙的活动性强的叙述正确的是( )
A.在氧化还原反应中,甲失电子比乙失电子多
B.甲比乙同价态的阳离子的氧化性强
C.甲能与稀盐酸反应生成氢气而乙不能
D.将甲与乙组成原电池时,甲为正极
C
化学电池的组成
组 成 负 极 正 极 电解质
电极材料
电极上发生反应的物质
电子流向
反应类型
能导电的物质
还原性较强的物质(大多是金属电极本身)
氧化性较强的物质
酸、碱、盐溶液或熔融液
流出电子
流入电子
氧化反应
还原反应
今日份化学作业~
组织建设
发展中的化学电源
【温故知新】电池电极反应式的书写
铜锌原电池 先分析正、负极,再根据负极发生氧化反应,正极发生还原反应的规律书写电极反应式。
2H++2e-=H2↑
负极:
总反应:
正极:
Zn-2e-=Zn2+
Zn+2H+=Zn2++H2↑
正极:
负极:
总反应:
Zn-2e-=Zn2+
Cu2+ + 2e-=Cu
Zn + Cu2+=Zn2+ + Cu
或 Zn + CuSO4=Cu + ZnSO4
及时训练
发明电池的故事
伏特是意大利帕维亚大学的研究电学的物理学家。
有一天,伏特看了一位名叫加伐尼的解剖学家的一篇论文,说动物肌肉里贮存着电,可以用金属接触肌肉把电引出来。看了这篇论文,伏特非常兴奋,便决定亲自来做这个实验。他用许多只活青蛙反复实验,终于发现,实际情况并不像加伐尼所说的那样,而是两种不同的金属接触产生的电流,才使蛙腿的肌肉充电而收缩。
为了证明自己的发现是正确的,伏特决定更深入地了解电的来源。
一天,他拿出一块锡片和一枚银币,把这两种金属放在自己的舌头上,然后叫助手将金属导线把它们连接起来,刹时,他感到满嘴的酸味儿。
接着,他将银币和锡片交换了位置,当助手将金属导线接通的一瞬间,伏特感到满嘴的咸味。
这些实验证明,两种金属在一定的条件下就能产生电流。伏特想,只要能把这种电流引出来,就能大有作用。
伏特经过反复实验,终于发明了被后人称做“伏特电堆”的电池,这就是在铜板和锌板中间夹上卡纸和用盐水浸过的布片,一层一层堆起来的蓄电池。这种电池,今天仍然在使用着
为了纪念他的贡献,人们把电压的计量单位叫做伏特,简称伏,符号V。比如我们手电筒里的电池的电压是1.5伏特,我们家里的电灯的电压是220伏特。
化学电池的分类
一次电池(干电池):电池消耗到一定程度,就不能使用;
二次电池(充电电池或蓄电池):放电后可以再充电重新使用;
燃料电池:一种将燃料和氧化剂的化学能直接转换成电能的化学电池。
化学电池优点
(1)能量转换效率高,供能稳定可靠。
(2)可以制成各种形状和大小、不同容量和电压的电池和电池组,使用方便。
(3)易维护,可在各种环境下工作。
判断电池优劣的标准
(1)比能量
[符号(A·h/kg),(A·h/L)]
指电池单位质量或单位体积所能输出电能的多少
(2)比功率
[符号是W/kg,W/L)]
指电池单位质量或单位体积所能输出功率的大小
(3)电池的储存时间的长短
除特殊情况外,质量轻、体积小而输出电能多、功率大、储存时间长的电池,其质量好。
干电池
碱性电池
蓄电池
锂离子电池
燃料电池
干电池
碱性电池
1. 干电池结构及电极反应原理
锌筒
石墨棒
MnO2和C
普通锌-锰干电池的结构
NH4Cl、ZnCl2和 H2O等
1.1 普通锌锰干电池(酸性)
负极(锌筒):
正极(石墨):
总反应:
电极反应:
Zn -2e? == Zn2+
2 + 2e? == 2NH3 ↑ + H2 ↑
Zn + 2 ==Zn2+ + +2NH3 ↑+ H2 ↑
特点:
a:一次性电池,不可逆。
b:用KOH代替NH4Cl能提高 性能,延长寿命。
思考与交流:
锌锰干电池即使不用,放置过久,也会失效(作为电解质的糊状NH4Cl显酸性),为了充分而有效地利用锌锰干电池,在购买、保存和使用方面你有何经验与建议?请与同学交流分享。
碱性电池
1.2 碱性干电池
碱性电池是个人音响、照相机等的首选电源。
碱性电池
电解液: 中性NH4Cl→碱性KOH(离子导电性更好)
负极:锌片→锌粉(反应面积成倍增长,使放电电流大幅度提高)
优点:比能量和储存时间有所提高,适用于大电流和连续放电
2. 充电电池
又称二次电池,能够重复使用至一定的周期。
铅蓄电池:最早使用的充电电池。
镍镉充电电池:它是一种体积少,具有残留性记忆的充电电池,可重复使用500次以上。
铅蓄电池
铅蓄电池
(1)电极材料及原料
(2)电解质溶液
(3)电极反应式:
正极:PbO2 负极:Pb
H2SO4溶液
负极(Pb): Pb- 2e-+ SO4 2 - =PbSO4
正极(PbO2): PbO2+4H++SO42 -+ 2e-= PbSO4 +2H2O
铅蓄电池充电和放电的总化学方程式:
PbO2 + Pb + 2H2SO4 2PbSO4 + 2H2O
放电
充电
用途:目前汽车上使用的电瓶大多仍是铅蓄电池,它还广泛用于国防、生产、生活等领域。
汽车用蓄电池
特点:铅蓄电池的电压稳定,使用方便安全可靠,可再次充电使用。
2.2 镍镉电池
镉有致癌作用,有被镍氢电池取代的趋势。
H2+NiO(OH)2 Ni(OH)2+H2O 。
放电
充电
镍
镉
电
池
电极反应(KOH为电解液)
用途:广泛用于收录机、无线对讲机、电子闪光灯、电动剃须刀等。
2NiO(OH) + 2H2O + Cd 2Ni(OH)2+ Cd(OH)2
放电
充电
锂离子电池
2.3 锂离子电池:
它是新一代可充电的绿色电池,现已成为笔记本电脑、移动电话、摄像机等低功耗电器的主流。
负极:Li - e— ==Li+
正极:MnO2 + e — + Li+ == LiMnO2
总反应: Li+ MnO2== LiMnO2
氢氧燃料电池
3. 燃料电池
氢氧燃料电池:它是一种高效、环境友好的发电装置。它的电极材料一般为活性电极,具有很强的催化活性,如铂电极,活性炭电极等。
燃料电池不是把还原剂、氧化剂物质全部贮藏在电池内,而是在工作时,不断从外界输入,同时将电极反应产物不断排出电池。
燃料电池的规律
①燃料做负极,助燃剂氧气为正极
②电极材料一般不参加化学反应,只起传导电子的作用。
③能量转化率高(超过80%),普通的只有30%,有利于节约能源。
燃料电池与前几种电池的差别
①氧化剂与还原剂在工作时不断补充;
②反应产物不断排出
3.1 酸性氢氧燃料电池
H2
O2
H2O
电解质:H2SO4溶液
使用铂电极
电极反应
负极:2H2 - 4e — == 4H+
正极:O2 + 4H+ + 4e— == 2H2O
总反应:2H2 + O2==2H2O
电极反应
负极:2H2 + 4OH—-4e— == 4H2O
正极:O2 + 2H2O + 4e— == 4OH—
总反应:2H2 + O2==2H2O
3.2 碱性氢氧燃料电池
KOH溶液
O2
H2O
a极 b极
O2→ O2- →
酸性环境: O2- + 2H+ == H2O
碱性环境: O2- + H2O == 2OH-
注:
用途:氢氧燃料电池目前已应用于航天、军事通讯、电视中继站等领域
H2
怎样书写燃料电池的电极反应式和总反应式?
书写步骤:(1)写出燃烧反应,根据电解液改写燃料电池总反应;
(2)写出正极的电极反应式(一般较简单);
(3)由燃料电池总反应减去正极的电极反应式得负极的电极反应式。
正极反应一般为
①酸性介质
②碱性介质
O2+4H++4e-=2H2O
O2+2H2O+4e-=4OH-
燃 料 电 池
介质 电池反应: 2H2 +O2 = 2H2O
酸性 负极
正极
中性 负极
正极
碱性 负极
正极
2H2 - 4e- = 4H+
O2 + 4H+ + 4e-= 2H2O
2H2 - 4e- = 4H+
O2 + 2H2O + 4e-= 4OH-
2H2 +4OH-- 4e- = 4H2O
O2 + 2H2O + 4e-= 4OH-
(2)CH4燃料电池(碱性介质)
1.燃烧总化学反应: CH4+2O2→CO2+2H2O
2.燃料电池总反应:
3.正极:
4.负极:
CH4+2OH-+2O2 = CO3 2 -+3H2O
2O2+4H2O+8e-= 8OH-
CH4+10OH--8e-= CO32-+7H2O
CH4燃料电池(酸性介质)
1、燃料电池总反应: CH4+2O2=CO2+2H2O ①
2、正极反应:O2+4H++4e-=2H2O ②
3、负极反应:①-②×2,得:
CH4-8e-+2H2O=CO2+8H+
(3)甲醇燃料电池(酸性介质)
总反应:
2CH4O + 3O2 === 2CO2 + 4H2O
正极的电极反应式为:
3O2+12e-+12H+ === 6H2O
负极的电极反应式为:
2CH4O-12e-+2H2O === 12H++ 2CO2
甲醇燃料电池(碱性介质)
总反应式:
2CH4O + 3O2 +4KOH === 2K2CO3 + 6H2O
正极的电极反应式为:
3O2+12e- + 6H20===12OH-
负极的电极反应式为:
2CH4O -12e-+16OH- === 2CO32- + 12H2O
(4)海水电池
1991年,我国首创以铝-空气-海水为能源的新型电
池,用作航海标志灯。该电池以取之不的海水为电
解质,靠空气中的氧气使铝不断氧化而产生电流。
这种海水电池的能量比“干电池”高20~50倍。电极
反应式为:
负极:
正极:
电池总反应:
4Al - 12e-= 4Al 3+
3O2+ 6H2O +12e-= 12 OH -
4Al+3O2+ 6H2O = 4Al (OH)3↓
使用燃料电池的汽车
改变燃料
正极:
2O2 + 4H2O + 8e— == 8OH—
负极:
CH4 + 10OH— – 8e— == + 7H2O
CH4 +2O2 == CO2 + 2H2O
CH4 +2O2 + 2OH— == + 2H2O
O2
总反应:
CH4
其他电池
空气电池
电池的发展方向
光电池使用方便,特别是近年来微小型半导体逆变器迅速发展,应用更快捷。美、日、欧和发展中国家都制定出庞大的光伏技术发展计划,开发方向是大幅度提高光电池转换效率和稳定性,降低成本,不断扩大产业.目前已有80多个国家和地区形成商业化,半商业化生产能力,年均增长达16,市场开拓从空间转向地面系统应用。
废电池对环境的危害
电池中含有汞、镉、铅等有毒金属。随意丢弃废电池会对环境造成严重的污染。
上世纪50年代,震惊世界的日本“水俣病”就是因汞中毒引起的。
减 少 污 染 节 约 资 源
1.废电池的污染引起人们的广泛重视,废电池中对环境形成污染的主要物质是( )
A.锌 B.汞 C.石墨 D.二氧化锰
2.实验室中制取氢气,最好的方法是( )
A.纯锌与稀硫酸反应
B.纯锌与浓硫酸反应
C.纯锌与稀盐酸反应
D.粗锌(含铜、银)与稀硫酸反应
B
D
3.某金属能和盐酸反应生成氢气,该金属与锌组成原电池时,锌为负极,则该金属可能为( )
A.铝 B.铜
C.锡 D.硅
C
4.已知空气-锌电池的电极反应为:
锌片:Zn+2OH—-2e — == ZnO+H2O
石墨:O2+2H2O+4e — == 4OH —
根据此判断,锌片是( )
A.负极,并被氧化 B.负极,并被还原
C.正极,并被氧化 D.正极,并被还原
A
5.一个原电池的总反应的离子方程式是Zn+Cu2+==Zn2++Cu,该反应的原电池的组成正确的是( )
C
6.表明金属甲的活动性比金属乙的活动性强的叙述正确的是( )
A.在氧化还原反应中,甲失电子比乙失电子多
B.甲比乙同价态的阳离子的氧化性强
C.甲能与稀盐酸反应生成氢气而乙不能
D.将甲与乙组成原电池时,甲为正极
C
化学电池的组成
组 成 负 极 正 极 电解质
电极材料
电极上发生反应的物质
电子流向
反应类型
能导电的物质
还原性较强的物质(大多是金属电极本身)
氧化性较强的物质
酸、碱、盐溶液或熔融液
流出电子
流入电子
氧化反应
还原反应
今日份化学作业~
