人教版九年级化学下册溶解度第一课时(共19张PPT)
文档属性
| 名称 | 人教版九年级化学下册溶解度第一课时(共19张PPT) |  | |
| 格式 | rar | ||
| 文件大小 | 30.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-02-28 18:08:02 | ||
图片预览






文档简介
(共19张PPT)
张 春 红 制
课题2 溶解度
饱和与不饱和溶液
互转方法
结晶的用途
浓稀与饱和不饱和关系
实验探究
1、氯化钠的溶解实验 —— 一定温度下
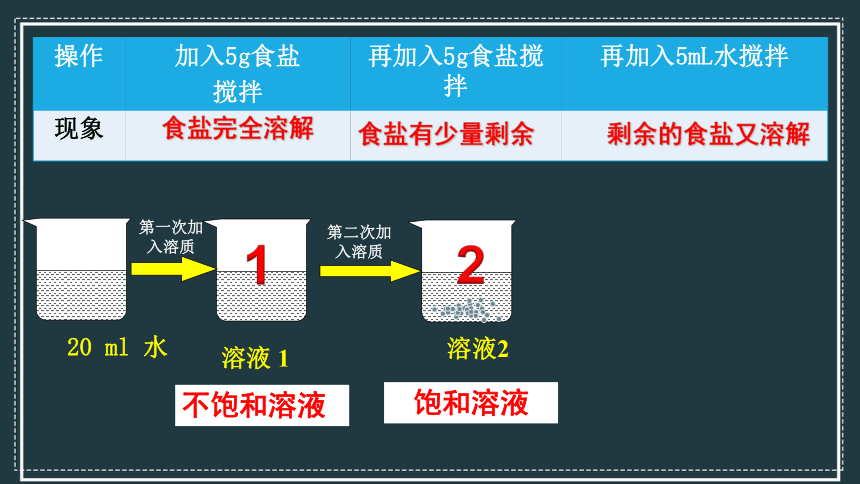
操作 加入5g食盐
搅拌 再加入5g食盐搅拌 再加入5mL水搅拌
现象
食盐完全溶解
食盐有少量剩余
剩余的食盐又溶解
【结论】溶解现象与溶质和溶剂的量有关,物质不能无限量地溶解在一定量的水中。水的量增多,溶解的物质也增多。
2、硝酸钾的溶解实验 —— 温度改变
操作 现象 结论
加入5g硝酸钾
再加入5g硝酸钾
加热
再加入5g硝酸钾,搅拌
冷却
固体消失
有固体剩余
固体消失
固体消失
有晶体析出
溶解现象还与温度有关。
小结
影响物质溶解的因素:
(1)溶质的性质
(2)溶剂量
(3)温度
20 ml 水
第二次加入溶质
溶液2
第一次加入溶质
1
2
溶液 1
不饱和溶液
饱和溶液
操作 加入5g食盐
搅拌 再加入5g食盐搅拌 再加入5mL水搅拌
现象 食盐完全溶解
食盐有少量剩余
剩余的食盐又溶解
饱和溶液与不饱和溶液
二、概念
1、饱和溶液:
2、不饱和溶液:
在一定温度下,在一定量的溶剂里不能再溶解某种溶质的溶液,叫做这种溶质的饱和溶液。
在一定温度下,在一定量的溶剂里还能继续溶解某种溶质的溶液,叫做这种溶质的不饱和溶液。
【提醒】只有指明“在一定量溶剂里”和“在一定温度下”,溶液的“饱和”和“不饱和”才有意义,且针对“某种溶质”。
思考
1、为什么要指明“一定温度”和“一定溶剂量”呢?
20 ml 水
第二次加入溶质
溶液2
第一次加入溶质
1
2
溶液 1
不饱和溶液
饱和溶液
再加入5mL水搅拌
3
溶液3
操作 现象
加入5g硝酸钾
再加入5g硝酸钾
加热
再加入5g硝酸钾
固体消失
有固体剩余
固体消失
固体消失
1
溶液 1
不饱和溶液
2
溶液 2
饱和溶液
3
溶液 3
4
溶液 4
不饱和溶液
思考
2、为什么概念中要指明“某种溶质”的饱和溶液?氯化钠的饱和溶液中还能不能溶解其他的物质?
向氯化钠的饱和溶液中加入少量的硫酸铜固体,搅拌并观察现象
加入少量
硫酸铜
继续探究
NaCl的饱和溶液
思考
2、为什么概念中要指明“某种溶质”的饱和溶液?氯化钠的饱和溶液中还能不能溶解其他的物质?
一种物质的饱和溶液,还能继续溶解其他物质,是其他物质的不饱和溶液。在讲饱和与不饱和溶液时,必须指明是哪种物质的饱和溶液
饱和溶液与不饱和溶液的相互转化
不饱和
溶液
饱和
溶液
增加溶质
降低温度
蒸发溶剂
升高温度
增加溶剂
练习:在其他条件不变的情况下,要使接近饱和溶液的硝酸钾溶液达到饱和溶液,下列措施达不到目的的是:
1)降低溶液温度; 2)加入溶质硝酸钾;
3)升高溶液的温度; 4)蒸发溶液中的溶剂。
如何判断溶液是否为饱和溶液呢
观察在一定温度下,有没有未溶解的剩余溶质存在
如果有,且溶质的量不再减少,那么这种溶液就是饱和溶液。
如果没有,再加入少量溶质,看是否能继续溶解
浓稀溶液与饱和溶液的关系
10毫升水 + 2克食盐:振荡,
现象:
溶液类型:
10毫升水 + 0.2克熟石灰 :振荡,
现象:
溶液类型:
食盐溶解
食盐的不饱和溶液
熟石灰不完全溶解
熟石灰的饱和溶液
浓度大
浓度小
浓稀溶液与饱和溶液的关系
[练习] 在一定温度下,某物质的饱和溶液一定是:
1)非常浓的溶液;
2)增加该溶质,能继续溶解的溶液;
3)非常稀的溶液;
4)增加该溶质,不能继续溶解的溶液。
①.对于同一种溶质来说,在相同温度时饱和溶液比不饱和溶液要浓。 ②.对于不同种溶质来说,饱和溶液不一定是浓溶液, 不饱和溶液不一定是稀溶液。
结 晶
雪花晶体
硝酸钾晶体
冷却热饱和溶液(降温结晶)
不饱和溶液转化为饱和溶液后,如果继续蒸发溶剂或降低温度,溶质会从溶液中以晶体的形式析出,这一过程叫做结晶。
蒸发结晶 实例——海水晒盐
蒸发结晶
海水
贮水池
蒸发池
结晶池
食盐
母液
氯化钠
多种化工原料
饱和溶液
可能是饱和溶液
原理
:利用日光和风力使水分蒸发
当 堂 训 练
1.?将一杯20℃的硝酸钾饱和溶液变为不饱和溶液,可采用的方法是( )
A.?降低温度 B.?加入溶剂
C.?倒去一半溶液 D.?蒸发溶剂
2.?能证明30℃时的某一硝酸钾溶液已经达到饱和的正确方法是( )
A.?向30℃的该溶液中加入少量硝酸钾后搅拌,加入的硝酸钾固体的质量不变?
B.?加入少量硝酸钾后升温,硝酸钾固体又溶解了
C.?温度不变时,蒸发掉10g水后,有少量的硝酸钾析出
D.?将温度降至10℃时,有少量硝酸钾析出?
B
A
张 春 红 制
课题2 溶解度
饱和与不饱和溶液
互转方法
结晶的用途
浓稀与饱和不饱和关系
实验探究
1、氯化钠的溶解实验 —— 一定温度下
操作 加入5g食盐
搅拌 再加入5g食盐搅拌 再加入5mL水搅拌
现象
食盐完全溶解
食盐有少量剩余
剩余的食盐又溶解
【结论】溶解现象与溶质和溶剂的量有关,物质不能无限量地溶解在一定量的水中。水的量增多,溶解的物质也增多。
2、硝酸钾的溶解实验 —— 温度改变
操作 现象 结论
加入5g硝酸钾
再加入5g硝酸钾
加热
再加入5g硝酸钾,搅拌
冷却
固体消失
有固体剩余
固体消失
固体消失
有晶体析出
溶解现象还与温度有关。
小结
影响物质溶解的因素:
(1)溶质的性质
(2)溶剂量
(3)温度
20 ml 水
第二次加入溶质
溶液2
第一次加入溶质
1
2
溶液 1
不饱和溶液
饱和溶液
操作 加入5g食盐
搅拌 再加入5g食盐搅拌 再加入5mL水搅拌
现象 食盐完全溶解
食盐有少量剩余
剩余的食盐又溶解
饱和溶液与不饱和溶液
二、概念
1、饱和溶液:
2、不饱和溶液:
在一定温度下,在一定量的溶剂里不能再溶解某种溶质的溶液,叫做这种溶质的饱和溶液。
在一定温度下,在一定量的溶剂里还能继续溶解某种溶质的溶液,叫做这种溶质的不饱和溶液。
【提醒】只有指明“在一定量溶剂里”和“在一定温度下”,溶液的“饱和”和“不饱和”才有意义,且针对“某种溶质”。
思考
1、为什么要指明“一定温度”和“一定溶剂量”呢?
20 ml 水
第二次加入溶质
溶液2
第一次加入溶质
1
2
溶液 1
不饱和溶液
饱和溶液
再加入5mL水搅拌
3
溶液3
操作 现象
加入5g硝酸钾
再加入5g硝酸钾
加热
再加入5g硝酸钾
固体消失
有固体剩余
固体消失
固体消失
1
溶液 1
不饱和溶液
2
溶液 2
饱和溶液
3
溶液 3
4
溶液 4
不饱和溶液
思考
2、为什么概念中要指明“某种溶质”的饱和溶液?氯化钠的饱和溶液中还能不能溶解其他的物质?
向氯化钠的饱和溶液中加入少量的硫酸铜固体,搅拌并观察现象
加入少量
硫酸铜
继续探究
NaCl的饱和溶液
思考
2、为什么概念中要指明“某种溶质”的饱和溶液?氯化钠的饱和溶液中还能不能溶解其他的物质?
一种物质的饱和溶液,还能继续溶解其他物质,是其他物质的不饱和溶液。在讲饱和与不饱和溶液时,必须指明是哪种物质的饱和溶液
饱和溶液与不饱和溶液的相互转化
不饱和
溶液
饱和
溶液
增加溶质
降低温度
蒸发溶剂
升高温度
增加溶剂
练习:在其他条件不变的情况下,要使接近饱和溶液的硝酸钾溶液达到饱和溶液,下列措施达不到目的的是:
1)降低溶液温度; 2)加入溶质硝酸钾;
3)升高溶液的温度; 4)蒸发溶液中的溶剂。
如何判断溶液是否为饱和溶液呢
观察在一定温度下,有没有未溶解的剩余溶质存在
如果有,且溶质的量不再减少,那么这种溶液就是饱和溶液。
如果没有,再加入少量溶质,看是否能继续溶解
浓稀溶液与饱和溶液的关系
10毫升水 + 2克食盐:振荡,
现象:
溶液类型:
10毫升水 + 0.2克熟石灰 :振荡,
现象:
溶液类型:
食盐溶解
食盐的不饱和溶液
熟石灰不完全溶解
熟石灰的饱和溶液
浓度大
浓度小
浓稀溶液与饱和溶液的关系
[练习] 在一定温度下,某物质的饱和溶液一定是:
1)非常浓的溶液;
2)增加该溶质,能继续溶解的溶液;
3)非常稀的溶液;
4)增加该溶质,不能继续溶解的溶液。
①.对于同一种溶质来说,在相同温度时饱和溶液比不饱和溶液要浓。 ②.对于不同种溶质来说,饱和溶液不一定是浓溶液, 不饱和溶液不一定是稀溶液。
结 晶
雪花晶体
硝酸钾晶体
冷却热饱和溶液(降温结晶)
不饱和溶液转化为饱和溶液后,如果继续蒸发溶剂或降低温度,溶质会从溶液中以晶体的形式析出,这一过程叫做结晶。
蒸发结晶 实例——海水晒盐
蒸发结晶
海水
贮水池
蒸发池
结晶池
食盐
母液
氯化钠
多种化工原料
饱和溶液
可能是饱和溶液
原理
:利用日光和风力使水分蒸发
当 堂 训 练
1.?将一杯20℃的硝酸钾饱和溶液变为不饱和溶液,可采用的方法是( )
A.?降低温度 B.?加入溶剂
C.?倒去一半溶液 D.?蒸发溶剂
2.?能证明30℃时的某一硝酸钾溶液已经达到饱和的正确方法是( )
A.?向30℃的该溶液中加入少量硝酸钾后搅拌,加入的硝酸钾固体的质量不变?
B.?加入少量硝酸钾后升温,硝酸钾固体又溶解了
C.?温度不变时,蒸发掉10g水后,有少量的硝酸钾析出
D.?将温度降至10℃时,有少量硝酸钾析出?
B
A
同课章节目录
