2019-2020学年高中化学人教版必修一课件 金属的化学性质 (共48张PPT)
文档属性
| 名称 | 2019-2020学年高中化学人教版必修一课件 金属的化学性质 (共48张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 742.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-03-02 15:56:44 | ||
图片预览










文档简介
(共48张PPT)
金属的化学性质
学习目标
1.了解钠和铝的物理性质。
2.掌握钠与水反应的原理、现象。
3.掌握钠、铝、铁的化学性质。
4.通过金属及其化合物性质的实验,培养实验意识、操作技能、观察能力和分析问题的能力等。
5.掌握物质的量在化学方程式计算中的应用。
一、金属的通性
1.物理性质
外观 导电性 导热性 延展性
不透明、有金属光泽 良好 良好 良好
2.化学性质
(1)与非金属的反应
(2)与酸的反应
①Mg与盐酸反应的化学方程式为:
Mg+2HCl=MgCl2+H2↑;
②Fe与稀硫酸反应的化学方程式为:
Fe+H2SO4=FeSO4+H2↑;
点燃
(3)与盐的反应
①Al与CuSO4溶液反应的化学方程式为:
2Al+3CuSO4=3Cu+Al2(SO4)3;
②Cu与AgNO3溶液反应的化学方程式为:
Cu+2AgNO3=2Ag+Cu(NO3)2。
二、金属与非金属的反应
1.钠与氧气的反应
实验操作 实验现象 实验结论
新切开的钠具有 金属光泽,在空气中表面很快 钠是 金属,硬度 ,熔点 ,通常保存在 中。常温下与O2的反应为:4Na+O2
2Na2O
把一小块金属钠放在坩埚里,加热 钠先熔化为 小球,然后燃烧,火焰呈
色,最后生成 固体 加热时与O2的反应为:2Na+O2
Na2O2
银白色
变暗
银白色
小
低
煤油
银白色
黄
淡黄色
2.铝与氧气的反应
铝与空气中的氧气发生反应的化学方程式为:
4Al+3O2=2Al2O3。
3.金属与Cl2、S的反应
金属与Cl2、S等物质反应生成相应的氯化物、硫化物。
三、金属与酸的反应
酸和金属活动性顺序表中氢前面的金属反应生成H2,如Zn、Fe和稀盐酸反应的离子方程式分别为:
Zn+2H+=Zn2++H2↑
Fe+2H+=Fe2++H2↑
四、金属与水的反应
1.钠与水的反应
实验操作 实验现象 原因解释
钠 在水面上 钠的密度比水
钠熔化成闪亮的小球 钠熔点 ,反应放热
小球在水面上四处游动,最后完全消失 反应产生的 推动小球运动
与水反应发出嘶嘶响声 钠与水反应剧烈
反应后溶液的颜色逐渐变 反应生成
浮
小
低
气体
红
碱
实验操作 实验现象 原因解释
实验结论 常温下,钠与水剧烈反应,生成NaOH和H2,化学方程式为:2Na+2H2O=2NaOH+H2↑,离子方程式为:2Na+2H2O=2OH-+2Na++H2↑
注意事项 取用的钠要小,过大易发生危险
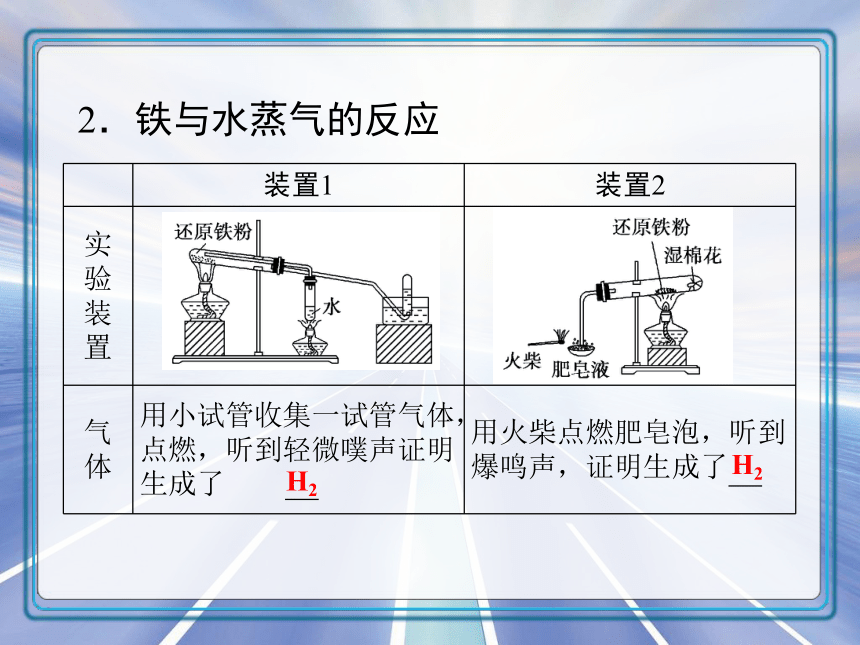
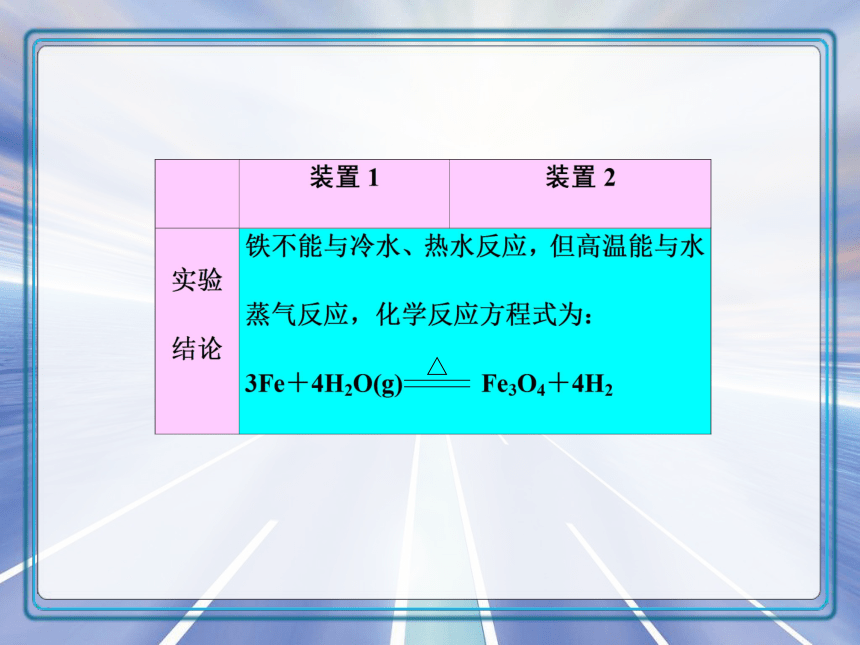
2.铁与水蒸气的反应
装置1 装置2
实验装置
气体 用小试管收集一试管气体,点燃,听到轻微噗声证明生成了 用火柴点燃肥皂泡,听到爆鸣声,证明生成了
H2
H2
△
1.在金属活动顺序表中,钠排在铜的前面,所以,将钠加入到CuSO4溶液中,会置换出金属铜。这种说法对吗?为什么?
【思考·提示】不对。钠加入到CuSO4溶液中,应先与水反应生成NaOH和H2,NaOH再与CuSO4反应生成Cu(OH)2沉淀,不会有Cu生成。
思考
五、铝与氢氧化钠溶液的反应
铝分别与盐酸、NaOH溶液反应的对比实验
实验操作
实验现象 试管中 ,铝片 ;点燃的木条放在试管口时发出 声 试管中 ,铝片
;点燃的木条放在试管口时发出 声
有关化学方程式 2Al+6HCl=
2AlCl3+3H2↑ 2Al+2NaOH+2H2O=
2NaAlO2+3H2↑
有气泡冒出
慢慢溶解
爆鸣
有气泡冒出
慢慢溶解
爆鸣
六、化学方程式中化学计量数与各化学计量间的关系
2Na + 2H2O=2NaOH + H2↑
质量之比 46 g 36 g 80 g 2 g
计量数之比 2 2 2 1
扩大NA倍 2NA 2NA 2NA NA
物质的量之比 2 mol 2 mol 2 mol 1 mol
结论:化学方程式中化学计量数之比= 之比= 之比= 之比。
微粒个数
物质的量
气体体积(相同条件)
2.根据化学方程式进行计算时,已知物理量与被求的物理量是否必须一致?
【思考·提示】不一定。只要满足“上下一致,左右相当”即可进行求算。
思考
1.金属钠与碱溶液反应的实质是与水反应。
2.金属钠与酸溶液反应:当Na投入酸溶液中时,首先与酸反应,且比在纯水中反应剧烈,只有当酸反应完后,才与水反应。例如少量Na投入盐酸中先发生反应:
2Na+2HCl=2NaCl+H2↑。
要点一
钠与酸、碱、盐溶液的反应规律
3.钠与盐溶液的反应:钠和盐溶液反应,不能置换出盐中的金属,这是因为金属阳离子在水中一般是以水合离子形式存在,即金属离子周围有一定数目的水分子包围着,不能和钠直接接触,而是钠先与水反应,再考虑生成的碱与盐的反应。例如钠与氯化铁溶液反应:
2Na+2H2O=2NaOH+H2↑
3NaOH+FeCl3=Fe(OH)3↓+3NaCl。
1.通常钠不能从盐溶液中置换出金属;若盐为熔融状态,钠可以置换出较不活泼的金属,如:
特别提醒
2.分析钠与酸、碱、盐溶液反应的计算题时,生成H2的物质的量均按钠计算,使问题更简捷。
电解
有人设计出一种在隔绝空气下让钠与水反应的方法,利用煤油来控制反应速率,使学生能仔细观察到各种实验现象。该方法简便、安全、现象明显、有趣味性,实验装置如图所示。
例1
将带胶塞的尖嘴玻璃管和长颈漏斗插入橡皮塞孔中,但玻璃管勿插入液体,乳胶管上夹上弹簧夹。
实验时,往100 mL的大试管中先加入40 mL煤油,取3粒米粒大小的金属钠放入大试管后塞上橡皮塞,通过漏斗加入滴有2滴酚酞的水。根据反应中观察到的现象,回答下列问题。
(1)金属钠变化的现象是_____________ _________________________________________________________________________________。
(2)大试管中溶液颜色的变化是 _____________________________________________________________________________________________________________。
(3)装置中液面的变化分别是:大试管中 ;长颈漏斗中 。
(4)简述检验产生气体的方法:_______ _________________________________________________________________。
【解析】 由于钠的密度比水小,比煤油大,所以钠在煤油与水的界面处漂浮。钠与水反应产生的气体在逸出过程中把钠带入煤油层,钠在重力作用下再回到界面。反复多次,直至钠完全消失。产生的气体聚集在大试管上部,把液体反压到长颈漏斗中。
【答案】 (1)钠在煤油中逐渐下沉,至水面时与水发生反应,熔化成银白色小球,像热气球一样在煤油与水的界面处作上下游动,最后完全消失
(2)水溶液从上至下逐渐由无色变为红色
(3)液面逐渐下降 液面逐渐上升
(4)当漏斗中液面上升到一定高度后,打开弹簧夹点燃气体,有淡蓝色火焰产生
1.将金属钠分别投入下列物质的溶液中,有气体放出,且溶液质量减轻的是( )
A.HCl B.K2SO4
C.CuCl2 D.饱和NaOH溶液
变式训练
解析:选CD。钠遇水或水溶液均能发生反应置换出氢气,故以上四个选项均能满足题干中有气体放出这一条件。解题的关键在于题干中的最后“溶液质量减轻”。若投入金属钠的质量小于脱离溶液的物质的质量,则溶液的质量必定减轻。选项A、B中每有23 g钠进入溶液均生成1 g H2,溶液质量增加22 g。C项中由于钠与水反应生成的NaOH还能进一步与CuCl2反应,析出Cu(OH)2沉淀,所以溶液质量减轻。D选项中NaOH溶液是饱和溶液,投入钠后消耗水,析出氢氧化钠固体,溶液质量也减轻。
1.铝的两性
铝与盐酸的反应原理为2Al+6H+=2Al3++3H2↑,这是活泼金属的化学通性之一。铝还能与NaOH溶液反应:2Al+2OH-+2H2O=2AlO2-+3H2↑。常利用铝的这一特性来判断铝的存在。
要点二
铝与氢氧化钠、盐酸的反应及有关计算
2.有关计算:
分析依据:2Al+6HCl=2AlCl3+3H2↑
2Al+2NaOH+2H2O=2NaAlO2+3H2↑
甲、乙两烧杯中各盛有100 mL 3 mol·L-1的盐酸和NaOH溶液,向两烧杯中分别加入等质量的铝粉,反应结束后测得生成的气体体积比为甲∶乙=1∶2,则加入铝粉的质量为________。
【思路点拨】 解答本题要从以下两方面考虑:
(1)等量的铝粉分别与足量的盐酸和NaOH溶液反应放出H2的关系。
(2)足量的铝粉分别与盐酸和NaOH溶液反应放出H2的关系。
例2
【解析】解答本题的关键是由题给条件判断出哪种物质完全反应以找出计量关系。等质量的铝粉分别与足量的HCl和NaOH溶液反应,放出H2的体积关系为甲∶乙=1∶1,因2Al+6HCl=2AlCl3+3H2↑,2Al+2NaOH+2H2O=2NaAlO2+3H2↑,故等物质的量的HCl和NaOH分别与足量的铝粉反应,放出H2的体积关系为甲∶乙=1∶3。现产生H2的体积比甲∶乙=1∶2,说明铝粉的量对盐酸来说是过量的,对NaOH来说是不足的,据上述两方程式可求得:与盐酸反应的铝粉是2.7 g,与NaOH反应的铝粉是5.4 g,所以投入铝粉的质量为5.4 g。
【答案】5.4 g
2.铝分别与足量的稀盐酸和氢氧化钠溶液反应,当两个反应放出的气体在相同状况下体积相等时,反应中消耗的HCl和NaOH物质的量之比为( )
A.1∶1 B.2∶1
C.3∶1 D.1∶3
变式训练
解析:选C。
发生反应:2Al+6HCl=2AlCl3+3H2↑
2Al+2NaOH+2H2O=2NaAlO2+3H2↑
据以上两个方程式知,消耗HCl和NaOH的物质的量之比为3∶1。
1.根据化学方程式进行计算的基本步骤
(1)基本步骤
要点三
物质的量在化学方程式计算中的应用
——设所求物质的物质的量或质量、体积等
?
——写出相关的化学方程式
——在方程式中有关物质的化学式下面标出
已知物质和所求物质的有关物理量关系,并
代入已知量和未知量?
——列出比例式
——根据比例式求解
——简明地写出答案
(2)实例
现有1 L 1 mol/L的盐酸与50 g NaOH样品恰好完全反应(杂质不与盐酸反应),则该样品中NaOH的含量为多少?
①设:设样品中NaOH的质量为x
②写:HCl + NaOH=NaCl+H2O
③标:1 mol 40 g
1 L×1 mol/L x
⑥答:该样品中NaOH的含量为80%
2.化学计算中常用的方法
(1)关系式法
化学计算的依据是物质之间量的比例关系,这种比例关系通常可从化学方程式或化学式中得到。当已知物与待求物之间是靠很多个反应来联系时,只需直接确定已知量与未知量之间的比例关系,即“关系式”。
确定已知量与未知量之间的关系式的一般方法:
①根据化学方程式确定关系式:先写出化学方程式,然后再根据需要从方程式中提炼出某些关系。如
②根据守恒原理确定关系式:如根据得失电子守恒,可知2Na~H2。
△
(2)守恒法
在化学反应中的守恒关系有:质量守恒、得失电子守恒、电荷守恒。
①质量守恒
a.宏观特征:反应前后元素的质量守恒;
b.微观特征:反应前后元素的原子个数守恒。
②得失电子守恒
氧化还原反应中,氧化剂得电子数等于还原剂失电子数。
③电荷守恒
a.电解质溶液中,阴离子所带负电荷总数等于阳离子所带正电荷总数;
b.离子方程式中,反应物所带电荷总数与生成物所带电荷总数相等且电性相同。
(3)差量法
根据化学反应前后物质的有关物理量发生的变化,找出所谓“理论差量”,如反应前后的质量、物质的量、气体体积、气体压强、反应过程中的热量变化等。该差量的大小与反应物质的有关量成正比。差量法就是借助这种比例关系,解决一定量变的计算题。解此类题的关键是根据题意确定“理论差量”,再根据题目提供的“实际差量”,列出比例式,求出答案。
向500 mL NaOH溶液中投入10.8 g Al,二者恰好完全反应后,计算:
(1)参加反应的NaOH的物质的量和溶液的物质的量浓度。
(2)生成标准状况下H2的体积。
例3
【解析】 设参加反应的NaOH的物质的量为n,生成标准状况下H2的体积为V
2Al+ 2NaOH+2H2O=2NaAlO2+3H2↑
54 g 2 mol 67.2 L
10.8 g n V
【答案】 (1)参加反应的NaOH的物质的量为0.4 mol,
NaOH溶液的物质的量浓度为0.8 mol/L。
(2)生成标准状况下的H2体积为13.44 L。
(1)若NaOH溶液物质的量浓度为1 mol/L,完全反应时,可消耗多少克铝?
(2)若产生标准状况下11.2 L H2,转移多少mol电子?
互动探究
【提示】 (1)设可消耗铝的质量为x
2Al+2NaOH+2H2O=2NaAlO2+3H2↑
54 g 2 mol
x 0.5 L×1 mol/L
(2)设转移电子物质的量为y
由方程式可得出关系式
2Al~6e- ~ 3H2
6 mol 67.2 L
y 11.2 L
(1)原混合气体中甲烷的物质的量是_______。
(2)原混合气体中氮气的体积分数为多少?(写出计算过程)
变式训练
△
则n(CO2)=0.085 mol
因此,原混合气体中含有的CO2为:
n(CO2,原)=0.085 mol-0.075 mol=0.01 mol
则原混合气体中所含N2的物质的量为:
n(N2)=n(混)-n(CH4)-n(CO2,原)=0.005 mol
答案:(1)0.075 mol (2)5.56%
金属的化学性质
学习目标
1.了解钠和铝的物理性质。
2.掌握钠与水反应的原理、现象。
3.掌握钠、铝、铁的化学性质。
4.通过金属及其化合物性质的实验,培养实验意识、操作技能、观察能力和分析问题的能力等。
5.掌握物质的量在化学方程式计算中的应用。
一、金属的通性
1.物理性质
外观 导电性 导热性 延展性
不透明、有金属光泽 良好 良好 良好
2.化学性质
(1)与非金属的反应
(2)与酸的反应
①Mg与盐酸反应的化学方程式为:
Mg+2HCl=MgCl2+H2↑;
②Fe与稀硫酸反应的化学方程式为:
Fe+H2SO4=FeSO4+H2↑;
点燃
(3)与盐的反应
①Al与CuSO4溶液反应的化学方程式为:
2Al+3CuSO4=3Cu+Al2(SO4)3;
②Cu与AgNO3溶液反应的化学方程式为:
Cu+2AgNO3=2Ag+Cu(NO3)2。
二、金属与非金属的反应
1.钠与氧气的反应
实验操作 实验现象 实验结论
新切开的钠具有 金属光泽,在空气中表面很快 钠是 金属,硬度 ,熔点 ,通常保存在 中。常温下与O2的反应为:4Na+O2
2Na2O
把一小块金属钠放在坩埚里,加热 钠先熔化为 小球,然后燃烧,火焰呈
色,最后生成 固体 加热时与O2的反应为:2Na+O2
Na2O2
银白色
变暗
银白色
小
低
煤油
银白色
黄
淡黄色
2.铝与氧气的反应
铝与空气中的氧气发生反应的化学方程式为:
4Al+3O2=2Al2O3。
3.金属与Cl2、S的反应
金属与Cl2、S等物质反应生成相应的氯化物、硫化物。
三、金属与酸的反应
酸和金属活动性顺序表中氢前面的金属反应生成H2,如Zn、Fe和稀盐酸反应的离子方程式分别为:
Zn+2H+=Zn2++H2↑
Fe+2H+=Fe2++H2↑
四、金属与水的反应
1.钠与水的反应
实验操作 实验现象 原因解释
钠 在水面上 钠的密度比水
钠熔化成闪亮的小球 钠熔点 ,反应放热
小球在水面上四处游动,最后完全消失 反应产生的 推动小球运动
与水反应发出嘶嘶响声 钠与水反应剧烈
反应后溶液的颜色逐渐变 反应生成
浮
小
低
气体
红
碱
实验操作 实验现象 原因解释
实验结论 常温下,钠与水剧烈反应,生成NaOH和H2,化学方程式为:2Na+2H2O=2NaOH+H2↑,离子方程式为:2Na+2H2O=2OH-+2Na++H2↑
注意事项 取用的钠要小,过大易发生危险
2.铁与水蒸气的反应
装置1 装置2
实验装置
气体 用小试管收集一试管气体,点燃,听到轻微噗声证明生成了 用火柴点燃肥皂泡,听到爆鸣声,证明生成了
H2
H2
△
1.在金属活动顺序表中,钠排在铜的前面,所以,将钠加入到CuSO4溶液中,会置换出金属铜。这种说法对吗?为什么?
【思考·提示】不对。钠加入到CuSO4溶液中,应先与水反应生成NaOH和H2,NaOH再与CuSO4反应生成Cu(OH)2沉淀,不会有Cu生成。
思考
五、铝与氢氧化钠溶液的反应
铝分别与盐酸、NaOH溶液反应的对比实验
实验操作
实验现象 试管中 ,铝片 ;点燃的木条放在试管口时发出 声 试管中 ,铝片
;点燃的木条放在试管口时发出 声
有关化学方程式 2Al+6HCl=
2AlCl3+3H2↑ 2Al+2NaOH+2H2O=
2NaAlO2+3H2↑
有气泡冒出
慢慢溶解
爆鸣
有气泡冒出
慢慢溶解
爆鸣
六、化学方程式中化学计量数与各化学计量间的关系
2Na + 2H2O=2NaOH + H2↑
质量之比 46 g 36 g 80 g 2 g
计量数之比 2 2 2 1
扩大NA倍 2NA 2NA 2NA NA
物质的量之比 2 mol 2 mol 2 mol 1 mol
结论:化学方程式中化学计量数之比= 之比= 之比= 之比。
微粒个数
物质的量
气体体积(相同条件)
2.根据化学方程式进行计算时,已知物理量与被求的物理量是否必须一致?
【思考·提示】不一定。只要满足“上下一致,左右相当”即可进行求算。
思考
1.金属钠与碱溶液反应的实质是与水反应。
2.金属钠与酸溶液反应:当Na投入酸溶液中时,首先与酸反应,且比在纯水中反应剧烈,只有当酸反应完后,才与水反应。例如少量Na投入盐酸中先发生反应:
2Na+2HCl=2NaCl+H2↑。
要点一
钠与酸、碱、盐溶液的反应规律
3.钠与盐溶液的反应:钠和盐溶液反应,不能置换出盐中的金属,这是因为金属阳离子在水中一般是以水合离子形式存在,即金属离子周围有一定数目的水分子包围着,不能和钠直接接触,而是钠先与水反应,再考虑生成的碱与盐的反应。例如钠与氯化铁溶液反应:
2Na+2H2O=2NaOH+H2↑
3NaOH+FeCl3=Fe(OH)3↓+3NaCl。
1.通常钠不能从盐溶液中置换出金属;若盐为熔融状态,钠可以置换出较不活泼的金属,如:
特别提醒
2.分析钠与酸、碱、盐溶液反应的计算题时,生成H2的物质的量均按钠计算,使问题更简捷。
电解
有人设计出一种在隔绝空气下让钠与水反应的方法,利用煤油来控制反应速率,使学生能仔细观察到各种实验现象。该方法简便、安全、现象明显、有趣味性,实验装置如图所示。
例1
将带胶塞的尖嘴玻璃管和长颈漏斗插入橡皮塞孔中,但玻璃管勿插入液体,乳胶管上夹上弹簧夹。
实验时,往100 mL的大试管中先加入40 mL煤油,取3粒米粒大小的金属钠放入大试管后塞上橡皮塞,通过漏斗加入滴有2滴酚酞的水。根据反应中观察到的现象,回答下列问题。
(1)金属钠变化的现象是_____________ _________________________________________________________________________________。
(2)大试管中溶液颜色的变化是 _____________________________________________________________________________________________________________。
(3)装置中液面的变化分别是:大试管中 ;长颈漏斗中 。
(4)简述检验产生气体的方法:_______ _________________________________________________________________。
【解析】 由于钠的密度比水小,比煤油大,所以钠在煤油与水的界面处漂浮。钠与水反应产生的气体在逸出过程中把钠带入煤油层,钠在重力作用下再回到界面。反复多次,直至钠完全消失。产生的气体聚集在大试管上部,把液体反压到长颈漏斗中。
【答案】 (1)钠在煤油中逐渐下沉,至水面时与水发生反应,熔化成银白色小球,像热气球一样在煤油与水的界面处作上下游动,最后完全消失
(2)水溶液从上至下逐渐由无色变为红色
(3)液面逐渐下降 液面逐渐上升
(4)当漏斗中液面上升到一定高度后,打开弹簧夹点燃气体,有淡蓝色火焰产生
1.将金属钠分别投入下列物质的溶液中,有气体放出,且溶液质量减轻的是( )
A.HCl B.K2SO4
C.CuCl2 D.饱和NaOH溶液
变式训练
解析:选CD。钠遇水或水溶液均能发生反应置换出氢气,故以上四个选项均能满足题干中有气体放出这一条件。解题的关键在于题干中的最后“溶液质量减轻”。若投入金属钠的质量小于脱离溶液的物质的质量,则溶液的质量必定减轻。选项A、B中每有23 g钠进入溶液均生成1 g H2,溶液质量增加22 g。C项中由于钠与水反应生成的NaOH还能进一步与CuCl2反应,析出Cu(OH)2沉淀,所以溶液质量减轻。D选项中NaOH溶液是饱和溶液,投入钠后消耗水,析出氢氧化钠固体,溶液质量也减轻。
1.铝的两性
铝与盐酸的反应原理为2Al+6H+=2Al3++3H2↑,这是活泼金属的化学通性之一。铝还能与NaOH溶液反应:2Al+2OH-+2H2O=2AlO2-+3H2↑。常利用铝的这一特性来判断铝的存在。
要点二
铝与氢氧化钠、盐酸的反应及有关计算
2.有关计算:
分析依据:2Al+6HCl=2AlCl3+3H2↑
2Al+2NaOH+2H2O=2NaAlO2+3H2↑
甲、乙两烧杯中各盛有100 mL 3 mol·L-1的盐酸和NaOH溶液,向两烧杯中分别加入等质量的铝粉,反应结束后测得生成的气体体积比为甲∶乙=1∶2,则加入铝粉的质量为________。
【思路点拨】 解答本题要从以下两方面考虑:
(1)等量的铝粉分别与足量的盐酸和NaOH溶液反应放出H2的关系。
(2)足量的铝粉分别与盐酸和NaOH溶液反应放出H2的关系。
例2
【解析】解答本题的关键是由题给条件判断出哪种物质完全反应以找出计量关系。等质量的铝粉分别与足量的HCl和NaOH溶液反应,放出H2的体积关系为甲∶乙=1∶1,因2Al+6HCl=2AlCl3+3H2↑,2Al+2NaOH+2H2O=2NaAlO2+3H2↑,故等物质的量的HCl和NaOH分别与足量的铝粉反应,放出H2的体积关系为甲∶乙=1∶3。现产生H2的体积比甲∶乙=1∶2,说明铝粉的量对盐酸来说是过量的,对NaOH来说是不足的,据上述两方程式可求得:与盐酸反应的铝粉是2.7 g,与NaOH反应的铝粉是5.4 g,所以投入铝粉的质量为5.4 g。
【答案】5.4 g
2.铝分别与足量的稀盐酸和氢氧化钠溶液反应,当两个反应放出的气体在相同状况下体积相等时,反应中消耗的HCl和NaOH物质的量之比为( )
A.1∶1 B.2∶1
C.3∶1 D.1∶3
变式训练
解析:选C。
发生反应:2Al+6HCl=2AlCl3+3H2↑
2Al+2NaOH+2H2O=2NaAlO2+3H2↑
据以上两个方程式知,消耗HCl和NaOH的物质的量之比为3∶1。
1.根据化学方程式进行计算的基本步骤
(1)基本步骤
要点三
物质的量在化学方程式计算中的应用
——设所求物质的物质的量或质量、体积等
?
——写出相关的化学方程式
——在方程式中有关物质的化学式下面标出
已知物质和所求物质的有关物理量关系,并
代入已知量和未知量?
——列出比例式
——根据比例式求解
——简明地写出答案
(2)实例
现有1 L 1 mol/L的盐酸与50 g NaOH样品恰好完全反应(杂质不与盐酸反应),则该样品中NaOH的含量为多少?
①设:设样品中NaOH的质量为x
②写:HCl + NaOH=NaCl+H2O
③标:1 mol 40 g
1 L×1 mol/L x
⑥答:该样品中NaOH的含量为80%
2.化学计算中常用的方法
(1)关系式法
化学计算的依据是物质之间量的比例关系,这种比例关系通常可从化学方程式或化学式中得到。当已知物与待求物之间是靠很多个反应来联系时,只需直接确定已知量与未知量之间的比例关系,即“关系式”。
确定已知量与未知量之间的关系式的一般方法:
①根据化学方程式确定关系式:先写出化学方程式,然后再根据需要从方程式中提炼出某些关系。如
②根据守恒原理确定关系式:如根据得失电子守恒,可知2Na~H2。
△
(2)守恒法
在化学反应中的守恒关系有:质量守恒、得失电子守恒、电荷守恒。
①质量守恒
a.宏观特征:反应前后元素的质量守恒;
b.微观特征:反应前后元素的原子个数守恒。
②得失电子守恒
氧化还原反应中,氧化剂得电子数等于还原剂失电子数。
③电荷守恒
a.电解质溶液中,阴离子所带负电荷总数等于阳离子所带正电荷总数;
b.离子方程式中,反应物所带电荷总数与生成物所带电荷总数相等且电性相同。
(3)差量法
根据化学反应前后物质的有关物理量发生的变化,找出所谓“理论差量”,如反应前后的质量、物质的量、气体体积、气体压强、反应过程中的热量变化等。该差量的大小与反应物质的有关量成正比。差量法就是借助这种比例关系,解决一定量变的计算题。解此类题的关键是根据题意确定“理论差量”,再根据题目提供的“实际差量”,列出比例式,求出答案。
向500 mL NaOH溶液中投入10.8 g Al,二者恰好完全反应后,计算:
(1)参加反应的NaOH的物质的量和溶液的物质的量浓度。
(2)生成标准状况下H2的体积。
例3
【解析】 设参加反应的NaOH的物质的量为n,生成标准状况下H2的体积为V
2Al+ 2NaOH+2H2O=2NaAlO2+3H2↑
54 g 2 mol 67.2 L
10.8 g n V
【答案】 (1)参加反应的NaOH的物质的量为0.4 mol,
NaOH溶液的物质的量浓度为0.8 mol/L。
(2)生成标准状况下的H2体积为13.44 L。
(1)若NaOH溶液物质的量浓度为1 mol/L,完全反应时,可消耗多少克铝?
(2)若产生标准状况下11.2 L H2,转移多少mol电子?
互动探究
【提示】 (1)设可消耗铝的质量为x
2Al+2NaOH+2H2O=2NaAlO2+3H2↑
54 g 2 mol
x 0.5 L×1 mol/L
(2)设转移电子物质的量为y
由方程式可得出关系式
2Al~6e- ~ 3H2
6 mol 67.2 L
y 11.2 L
(1)原混合气体中甲烷的物质的量是_______。
(2)原混合气体中氮气的体积分数为多少?(写出计算过程)
变式训练
△
则n(CO2)=0.085 mol
因此,原混合气体中含有的CO2为:
n(CO2,原)=0.085 mol-0.075 mol=0.01 mol
则原混合气体中所含N2的物质的量为:
n(N2)=n(混)-n(CH4)-n(CO2,原)=0.005 mol
答案:(1)0.075 mol (2)5.56%
