第二节 海水“晒盐”——复分解反应 课件(21张PPT)
文档属性
| 名称 | 第二节 海水“晒盐”——复分解反应 课件(21张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 11.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-03-02 22:43:23 | ||
图片预览





文档简介
(共21张PPT)
再识复分解反应
回 顾
什么是复分解反应?
分类观
变化观
微粒观
复分解反应
活动一
用“分类观”再识复分解反应概念
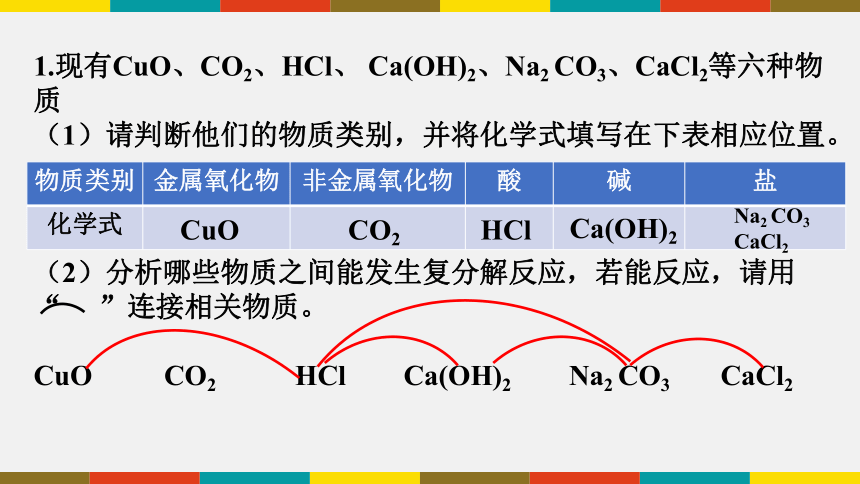
1.现有CuO、CO2、HCl、 Ca(OH)2、Na2 CO3、CaCl2等六种物质
(1)请判断他们的物质类别,并将化学式填写在下表相应位置。
(2)分析哪些物质之间能发生复分解反应,若能反应,请用“ ”连接相关物质。
CuO CO2 HCl Ca(OH)2 Na2 CO3 CaCl2
物质类别 金属氧化物 非金属氧化物 酸 碱 盐
化学式
CuO
CO2
HCl
Ca(OH)2
Na2 CO3
CaCl2
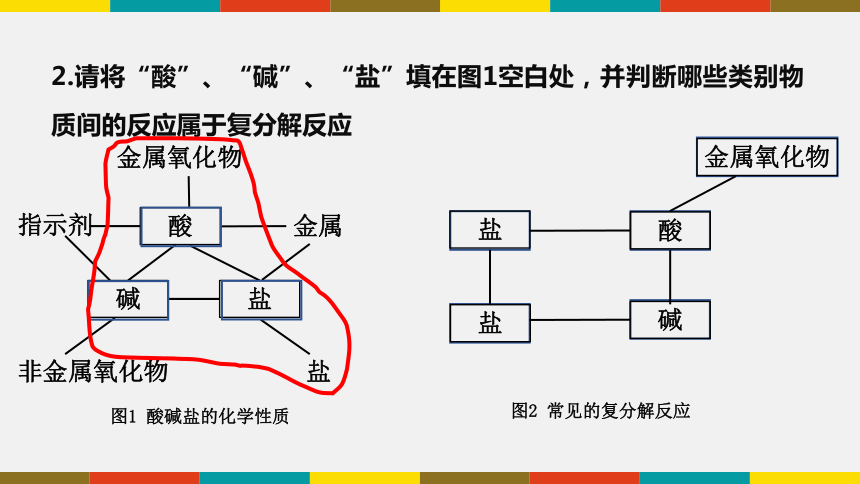
2.请将“酸”、“碱”、“盐”填在图1空白处,并判断哪些类别物质间的反应属于复分解反应
金属氧化物
指示剂
酸
非金属氧化物
碱
盐
金属
盐
图1 酸碱盐的化学性质
图2 常见的复分解反应
酸
碱
盐
盐
金属氧化物
从微粒角度了解复分解反应,
它的实质是什么?
活动二
用“微粒观”揭示复分解反应实质
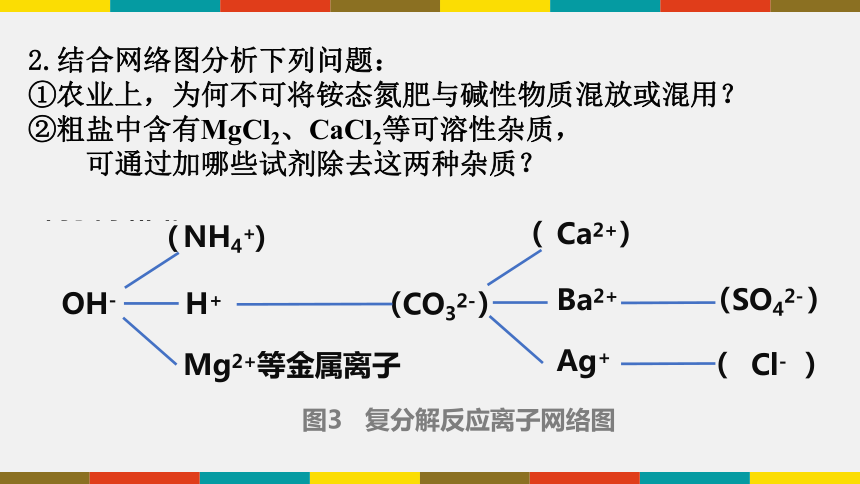
1.图3为复分解反应离子网络图,图中用短线相连的离子之间能两两结合生成气体或者水或者沉淀。现有NH4+、Ca2+、SO42-、CO32-、Cl-,请将它们提案如下面合适的括号中,使其成为一个完整的复分解反应离子网络图。
OH-
NH4+
H+
Mg2+等金属离子
( )
( )
CO32-
( )
Ca2+
Ba2+
Ag+
( )
SO42-
( )
Cl-
图3 复分解反应离子网络图
2.结合网络图分析下列问题:
①农业上,为何不可将铵态氮肥与碱性物质混放或混用?
②粗盐中含有MgCl2、CaCl2等可溶性杂质,
可通过加哪些试剂除去这两种杂质?
3.根据图4所示实验回答下列问题:
(1)预测现象并填表:
溶液颜色 沉淀情况
实验1
实验2
实验3
由红变无色
由红变无色
仍为红色
无
白色沉淀
白色沉淀
(2)图5、6分别为实验1、2发生反应的微观模拟图,请结合图形分析实验1、2现象异同的原因。
(3)实验2、3中,溶液导电性变化如图7所示,则A表示的是哪个实验中溶液导电性的变化?为什么?
复分解反应规律
是一成不变的吗?
活动三 拓展
用“变化观”认识复分解反应的规律
1.已知t℃时,四种化合物在水中以及液氮中的溶解度如下:
AgNO3 Ba(NO3)2 AgCl BaCl2
水 170g 9.2g 1.5x10-4g 33.3g
液氮 8.6g 97.2g 0.8g 约为0
请判断Ba(NO3)2和AgCl在以液氮为溶剂的溶液中能否发生复分解反应?为什么?
2.实验室模拟侯氏制碱法生产原理的主要过程为:①20℃时,向浓氨水中通入足量的二氧化碳得到NH4HCO3饱和溶液;②向NH4HCO3饱和溶液中加入食盐细粒,并不断搅拌,直到NaHCO3结晶析出完毕;③将析出的晶体过滤,得到晶体和滤液,洗涤晶体,然后将晶体放在试管中充分加热,得到Na2CO3。
步骤②中发生反应的化学方程式为: NH4HCO3 + NaCl = NaHCO3↓+ NH4Cl,请结合下表分析该反应为何能发生?
NaCl NH4HCO3 NaHCO3 NH4Cl
20℃时的溶解度 36.0g 21.0g 9.6g 37.2g
透过现象看本质
要用辩证的思想看待事物
过 关 检 测
1.下列物质中能与Na2CO3在溶液中大量共存的是( )
A.HCl B. BaCl2 C. KOH D. KNO3
CD
2.选择合适的试剂,完成下列实验:
实验目的 原理方程式
除去NaCl溶液中少量盐酸
鉴别Na2SO4溶液和NaOH溶液
Na2SO4+BaCl2=BaSO4↓+2NaCl
NaOH+HCl=NaCl+H2O
3.为理解稀盐酸和氢氧化钠两者之间发生反应的微观实质,某同学绘制了下图,请完善:
H2O
谢 谢 !
再识复分解反应
回 顾
什么是复分解反应?
分类观
变化观
微粒观
复分解反应
活动一
用“分类观”再识复分解反应概念
1.现有CuO、CO2、HCl、 Ca(OH)2、Na2 CO3、CaCl2等六种物质
(1)请判断他们的物质类别,并将化学式填写在下表相应位置。
(2)分析哪些物质之间能发生复分解反应,若能反应,请用“ ”连接相关物质。
CuO CO2 HCl Ca(OH)2 Na2 CO3 CaCl2
物质类别 金属氧化物 非金属氧化物 酸 碱 盐
化学式
CuO
CO2
HCl
Ca(OH)2
Na2 CO3
CaCl2
2.请将“酸”、“碱”、“盐”填在图1空白处,并判断哪些类别物质间的反应属于复分解反应
金属氧化物
指示剂
酸
非金属氧化物
碱
盐
金属
盐
图1 酸碱盐的化学性质
图2 常见的复分解反应
酸
碱
盐
盐
金属氧化物
从微粒角度了解复分解反应,
它的实质是什么?
活动二
用“微粒观”揭示复分解反应实质
1.图3为复分解反应离子网络图,图中用短线相连的离子之间能两两结合生成气体或者水或者沉淀。现有NH4+、Ca2+、SO42-、CO32-、Cl-,请将它们提案如下面合适的括号中,使其成为一个完整的复分解反应离子网络图。
OH-
NH4+
H+
Mg2+等金属离子
( )
( )
CO32-
( )
Ca2+
Ba2+
Ag+
( )
SO42-
( )
Cl-
图3 复分解反应离子网络图
2.结合网络图分析下列问题:
①农业上,为何不可将铵态氮肥与碱性物质混放或混用?
②粗盐中含有MgCl2、CaCl2等可溶性杂质,
可通过加哪些试剂除去这两种杂质?
3.根据图4所示实验回答下列问题:
(1)预测现象并填表:
溶液颜色 沉淀情况
实验1
实验2
实验3
由红变无色
由红变无色
仍为红色
无
白色沉淀
白色沉淀
(2)图5、6分别为实验1、2发生反应的微观模拟图,请结合图形分析实验1、2现象异同的原因。
(3)实验2、3中,溶液导电性变化如图7所示,则A表示的是哪个实验中溶液导电性的变化?为什么?
复分解反应规律
是一成不变的吗?
活动三 拓展
用“变化观”认识复分解反应的规律
1.已知t℃时,四种化合物在水中以及液氮中的溶解度如下:
AgNO3 Ba(NO3)2 AgCl BaCl2
水 170g 9.2g 1.5x10-4g 33.3g
液氮 8.6g 97.2g 0.8g 约为0
请判断Ba(NO3)2和AgCl在以液氮为溶剂的溶液中能否发生复分解反应?为什么?
2.实验室模拟侯氏制碱法生产原理的主要过程为:①20℃时,向浓氨水中通入足量的二氧化碳得到NH4HCO3饱和溶液;②向NH4HCO3饱和溶液中加入食盐细粒,并不断搅拌,直到NaHCO3结晶析出完毕;③将析出的晶体过滤,得到晶体和滤液,洗涤晶体,然后将晶体放在试管中充分加热,得到Na2CO3。
步骤②中发生反应的化学方程式为: NH4HCO3 + NaCl = NaHCO3↓+ NH4Cl,请结合下表分析该反应为何能发生?
NaCl NH4HCO3 NaHCO3 NH4Cl
20℃时的溶解度 36.0g 21.0g 9.6g 37.2g
透过现象看本质
要用辩证的思想看待事物
过 关 检 测
1.下列物质中能与Na2CO3在溶液中大量共存的是( )
A.HCl B. BaCl2 C. KOH D. KNO3
CD
2.选择合适的试剂,完成下列实验:
实验目的 原理方程式
除去NaCl溶液中少量盐酸
鉴别Na2SO4溶液和NaOH溶液
Na2SO4+BaCl2=BaSO4↓+2NaCl
NaOH+HCl=NaCl+H2O
3.为理解稀盐酸和氢氧化钠两者之间发生反应的微观实质,某同学绘制了下图,请完善:
H2O
谢 谢 !
同课章节目录
- 第七单元 常见的酸和碱
- 第一节 酸及其性质
- 第二节 碱及其性质
- 第三节 溶液的酸碱性
- 第四节 酸碱中和反应
- 到实验室去:探究酸和碱的化学性质
- 第八单元 海水中的化学
- 第一节 海洋化学资源
- 第二节 海水“晒盐“
- 第三节 海水“制碱“
- 到实验室去:粗盐中难溶性杂质的去除
- 第九单元 金属
- 第一节 常见的金属材料
- 第二节 金属的化学性质
- 第三节 钢铁的锈蚀与防护
- 到实验室去 探究金属的性质
- 第十单元 化学与健康
- 第一节 食物中的有机物
- 第二节 化学元素与人体健康
- 第三节 远离有毒物质
- 第十一单元 化学与社会发展
- 第一节 化学与能源开发
- 第二节 化学与材料研制
- 第三节 化学与农业生产
- 第四节 化学与环境保护
