第二节 海水“晒盐”课件(23张PPT)
图片预览







文档简介
(共23张PPT)
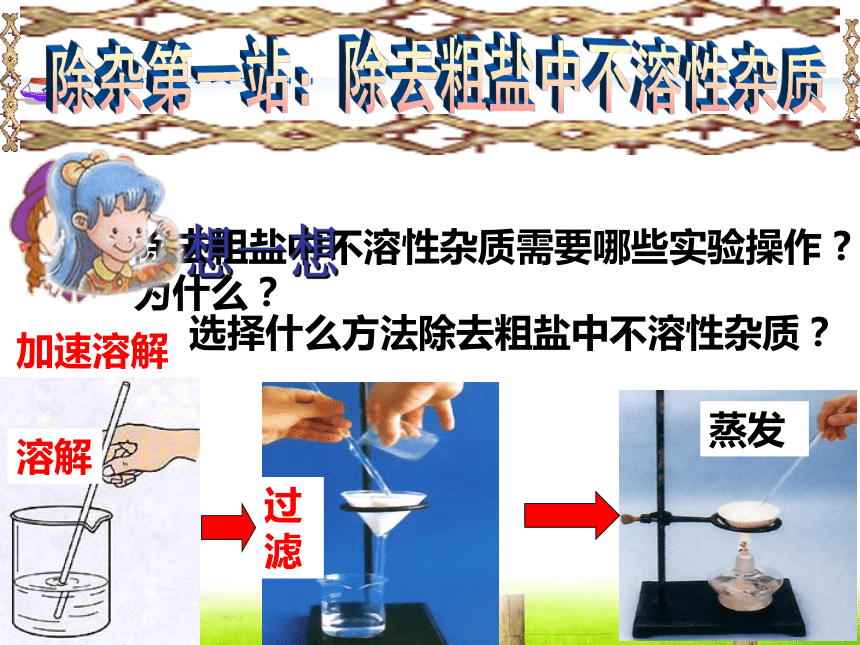
除去粗盐中不溶性杂质需要哪些实验操作 ?
为什么?
过滤
蒸发
溶解
选择什么方法除去粗盐中不溶性杂质?
加速溶解
滤纸要紧贴漏斗内壁。
(1)烧杯要紧靠玻璃棒;
(2)玻璃棒下端要靠三层滤纸处;
(3)漏斗下端的要紧靠烧杯内壁。
玻璃棒的作用:
引流
滤液的液面要低于滤纸边缘
滤纸边缘低于漏斗口。
一贴
二低
三靠近
蒸发注意事项:
1、少量原则
2、用玻璃棒搅拌,防止局部温度过高造成液滴飞溅
3、当有较多晶体出现时,停止加热。
4、用坩埚钳夹住蒸发皿放在实验桌的石棉网上。
温馨提示: 20℃时,NaCl的溶解度36g
实验名称 除去粗盐中不溶性杂质
实验方案
实验反思
温馨提示:20℃NaCl溶解度是36g
将烧杯中的液体沿玻璃棒倒入过滤器,进行过滤。
将蒸发皿放到铁架台的铁圈上,将滤液少量倒入蒸发皿中,用酒精灯加热,并用玻璃棒不断搅拌。待蒸发皿中出现较多晶体时,即停止加热。
用天平称取3.0 g粗盐,加入烧杯中。用量筒量取10 mL水,倒入烧杯中。用玻璃棒不断搅拌,直至粗盐不再溶解为止。
2. 过滤
3. 蒸发
1. 溶解
实验名称 除去粗盐中不溶性杂质
实验方案
反思:在实验中遇到问题或困惑
1、粗盐提纯实验的部分操作如图所示,其中不
正确的是( )
A.取一定量粗盐 B.溶解 C.过滤 D.蒸发
CD
氯化钠
应选择什么离子才
能将杂质离子除去?
为什么?
SO42-
BaCl2 溶液
NaOH溶液
Na2CO3溶液
SO42-
Mg2+
Ca2+
过量
过量
过量
温馨提示:添加的试剂必须过量,以达到完全除杂的目的
加入过量的
NaOH溶液
Cl-
Na+
Ca2+
(SO42- Mg2+ Ca2+)
除去可溶性杂质
Mg2+
加入过量的
BaCl2溶液
SO42-
氯化钡溶液 碳酸钠溶液
氢氧化钠溶液
Ca2+
OH-
加入过量的
NaOH溶液
Mg2+
Ca2+
Cl-
Na+
Ba2+
Cl-
CO32-
加入过量的Na2CO3溶液
Ba2+
OH-
Na+
Cl-
OH-
Na+
H+
加入适量的稀盐酸
Ba2+
Mg2+
Ca2+
Cl-
Na+
SO42-
OH-
OH-
CO32-
CO32-
过
滤
H+
H+
CO32-
H2O
H2O
CO2
加入过量的
BaCl2溶液
除可溶性杂质
Ba2+
蒸发结晶
氯化钠晶体
(SO42- Mg2+ Ca2+)
转化法
将杂质离子转换成气体、沉淀或水
通过本节课的学习,你学到哪些知识?画出思维导图,建构知识体系
过滤
不需要
当蒸发皿中出现较多晶体时停止加热
加快食盐溶解
引流
防止液体局部温度过高,造成液滴飞溅。
(2013年中考改编)实验是进行科学探究的重要方式。请填写下列空格(1)除去粗盐中难溶性杂质,主要分以下三个操作步骤
其中,操作B的名称为: ;操作C中,给蒸发皿加热时
(选填“需要”或“不需要”)垫石棉网。
(2)在蒸发食盐水获取食盐晶体时,应在蒸发皿内出现
—————————————————————————— 时,即停止加热.
(3) 粗盐提纯的实验中三个步骤均用到玻璃棒,它的作用分别是:a 、溶解时的作用是( )
b、过滤时的作用是( )
c、蒸发时的作用是( )
2、用Na2CO3, BaCl2,盐酸三种药品除去粗盐中含有CaCl2, Na2SO4得到纯净的NaCl溶液,则加入药品顺序
BaCl2,Na2CO3, 盐酸
巩 固 性 作业
实 践 性 作 业
拓 展 性 作 业
完成新课堂第一课
时
写篇有关食盐的小论文(可包括用途,吃多危害制备)
到你所在村普及食盐相关知识
大海一如人生,
愿同学们一路前行,
能在激流里开出花来,荡涤尘埃与污垢,
收获纯粹,湛蓝与美好
除去粗盐中不溶性杂质需要哪些实验操作 ?
为什么?
过滤
蒸发
溶解
选择什么方法除去粗盐中不溶性杂质?
加速溶解
滤纸要紧贴漏斗内壁。
(1)烧杯要紧靠玻璃棒;
(2)玻璃棒下端要靠三层滤纸处;
(3)漏斗下端的要紧靠烧杯内壁。
玻璃棒的作用:
引流
滤液的液面要低于滤纸边缘
滤纸边缘低于漏斗口。
一贴
二低
三靠近
蒸发注意事项:
1、少量原则
2、用玻璃棒搅拌,防止局部温度过高造成液滴飞溅
3、当有较多晶体出现时,停止加热。
4、用坩埚钳夹住蒸发皿放在实验桌的石棉网上。
温馨提示: 20℃时,NaCl的溶解度36g
实验名称 除去粗盐中不溶性杂质
实验方案
实验反思
温馨提示:20℃NaCl溶解度是36g
将烧杯中的液体沿玻璃棒倒入过滤器,进行过滤。
将蒸发皿放到铁架台的铁圈上,将滤液少量倒入蒸发皿中,用酒精灯加热,并用玻璃棒不断搅拌。待蒸发皿中出现较多晶体时,即停止加热。
用天平称取3.0 g粗盐,加入烧杯中。用量筒量取10 mL水,倒入烧杯中。用玻璃棒不断搅拌,直至粗盐不再溶解为止。
2. 过滤
3. 蒸发
1. 溶解
实验名称 除去粗盐中不溶性杂质
实验方案
反思:在实验中遇到问题或困惑
1、粗盐提纯实验的部分操作如图所示,其中不
正确的是( )
A.取一定量粗盐 B.溶解 C.过滤 D.蒸发
CD
氯化钠
应选择什么离子才
能将杂质离子除去?
为什么?
SO42-
BaCl2 溶液
NaOH溶液
Na2CO3溶液
SO42-
Mg2+
Ca2+
过量
过量
过量
温馨提示:添加的试剂必须过量,以达到完全除杂的目的
加入过量的
NaOH溶液
Cl-
Na+
Ca2+
(SO42- Mg2+ Ca2+)
除去可溶性杂质
Mg2+
加入过量的
BaCl2溶液
SO42-
氯化钡溶液 碳酸钠溶液
氢氧化钠溶液
Ca2+
OH-
加入过量的
NaOH溶液
Mg2+
Ca2+
Cl-
Na+
Ba2+
Cl-
CO32-
加入过量的Na2CO3溶液
Ba2+
OH-
Na+
Cl-
OH-
Na+
H+
加入适量的稀盐酸
Ba2+
Mg2+
Ca2+
Cl-
Na+
SO42-
OH-
OH-
CO32-
CO32-
过
滤
H+
H+
CO32-
H2O
H2O
CO2
加入过量的
BaCl2溶液
除可溶性杂质
Ba2+
蒸发结晶
氯化钠晶体
(SO42- Mg2+ Ca2+)
转化法
将杂质离子转换成气体、沉淀或水
通过本节课的学习,你学到哪些知识?画出思维导图,建构知识体系
过滤
不需要
当蒸发皿中出现较多晶体时停止加热
加快食盐溶解
引流
防止液体局部温度过高,造成液滴飞溅。
(2013年中考改编)实验是进行科学探究的重要方式。请填写下列空格(1)除去粗盐中难溶性杂质,主要分以下三个操作步骤
其中,操作B的名称为: ;操作C中,给蒸发皿加热时
(选填“需要”或“不需要”)垫石棉网。
(2)在蒸发食盐水获取食盐晶体时,应在蒸发皿内出现
—————————————————————————— 时,即停止加热.
(3) 粗盐提纯的实验中三个步骤均用到玻璃棒,它的作用分别是:a 、溶解时的作用是( )
b、过滤时的作用是( )
c、蒸发时的作用是( )
2、用Na2CO3, BaCl2,盐酸三种药品除去粗盐中含有CaCl2, Na2SO4得到纯净的NaCl溶液,则加入药品顺序
BaCl2,Na2CO3, 盐酸
巩 固 性 作业
实 践 性 作 业
拓 展 性 作 业
完成新课堂第一课
时
写篇有关食盐的小论文(可包括用途,吃多危害制备)
到你所在村普及食盐相关知识
大海一如人生,
愿同学们一路前行,
能在激流里开出花来,荡涤尘埃与污垢,
收获纯粹,湛蓝与美好
同课章节目录
- 第七单元 常见的酸和碱
- 第一节 酸及其性质
- 第二节 碱及其性质
- 第三节 溶液的酸碱性
- 第四节 酸碱中和反应
- 到实验室去:探究酸和碱的化学性质
- 第八单元 海水中的化学
- 第一节 海洋化学资源
- 第二节 海水“晒盐“
- 第三节 海水“制碱“
- 到实验室去:粗盐中难溶性杂质的去除
- 第九单元 金属
- 第一节 常见的金属材料
- 第二节 金属的化学性质
- 第三节 钢铁的锈蚀与防护
- 到实验室去 探究金属的性质
- 第十单元 化学与健康
- 第一节 食物中的有机物
- 第二节 化学元素与人体健康
- 第三节 远离有毒物质
- 第十一单元 化学与社会发展
- 第一节 化学与能源开发
- 第二节 化学与材料研制
- 第三节 化学与农业生产
- 第四节 化学与环境保护
