苏教版高中化学必修2专题二《化学反应与能量转化》单元检测题
文档属性
| 名称 | 苏教版高中化学必修2专题二《化学反应与能量转化》单元检测题 |
|
|
| 格式 | zip | ||
| 文件大小 | 264.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-03-02 20:24:55 | ||
图片预览




文档简介
《化学反应与能量转化》单元检测题
一、单选题
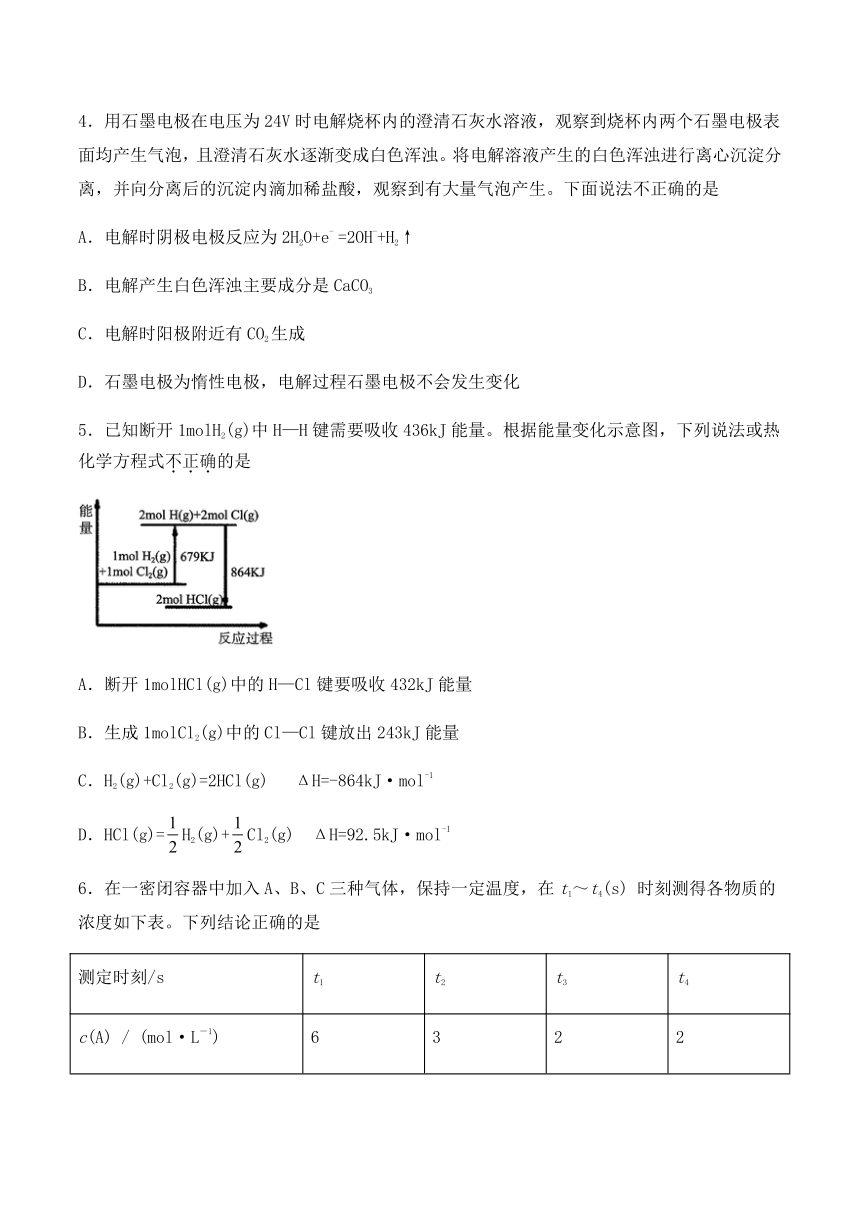
1.在溶液中,原电池的两电极距离越近,导电能力越强。重铬酸钾具有强氧化性,能加快反应速率。下列锌?铜原电池装置中,电极材料、灯泡、烧杯等均相同,能使小灯泡最亮的是
A. B.
C. D.
2.某课外活动小组,将剪下的一块镀锌铁皮放入试剂瓶中,并滴入少量食盐水将其浸湿,再加数滴酚酞溶液,按图装置进行实验。数分钟后观察,下列现象不可能出现的是(?? )
A.B中导管里形成一段水柱 B.锌被腐蚀
C.金属片剪口处溶液变红 D.B中导管产生气泡
3.已知X(g)+ 3Y(g) = 2Z(g) ΔH>0,下列对该反应的说法中正确的是( )
A.ΔS>0 B.能自发进行
C.反应物总能量大于生成物总能量 D.在任何温度下都不能自发进行
4.用石墨电极在电压为24V时电解烧杯内的澄清石灰水溶液,观察到烧杯内两个石墨电极表面均产生气泡,且澄清石灰水逐渐变成白色浑浊。将电解溶液产生的白色浑浊进行离心沉淀分离,并向分离后的沉淀内滴加稀盐酸,观察到有大量气泡产生。下面说法不正确的是
A.电解时阴极电极反应为2H2O+e- =2OH-+H2↑
B.电解产生白色浑浊主要成分是CaCO3
C.电解时阳极附近有CO2生成
D.石墨电极为惰性电极,电解过程石墨电极不会发生变化
5.已知断开1molH2(g)中H—H键需要吸收436kJ能量。根据能量变化示意图,下列说法或热化学方程式不正确的是
A.断开1molHCl(g)中的H—Cl键要吸收432kJ能量
B.生成1molCl2(g)中的Cl—Cl键放出243kJ能量
C.H2(g)+Cl2(g)=2HCl(g) ΔH=-864kJ·mol-1
D.HCl(g)=H2(g)+Cl2(g) ΔH=92.5kJ·mol-1
6.在一密闭容器中加入A、B、C三种气体,保持一定温度,在t1~t4(s) 时刻测得各物质的浓度如下表。下列结论正确的是
测定时刻/s t1 t2 t3 t4
c(A) / (mol·L-1) 6 3 2 2
c(B) / (mol·L-1) 5 3.5 3 3
c(C) / (mol·L-1) 1 2.5 3 3
A.在t3时刻反应已经停止
B.t3~t4内正、逆反应速率不相等
C.在容器中发生的反应为A + BC
D.在t2~t3内A的平均反应速率为mol·L-1·s-1
7.银锌电池广泛用作各种电子仪器的电源,其电极分别为Ag2O、Zn,电解质溶液为KOH溶液,总反应为Ag2O+Zn+H2O =2Ag + Zn(OH)2 。下列说法中错误的是( )
A.原电池放电时,负极上发生反应的物质是Zn
B.溶液中OH— 向正极移动,K+、 H+向负极移动
C.工作时,电子由Zn电极沿导线流向Ag2O电极
D.负极上发生的反应是Zn + 2OH— — 2e— =Zn(OH)2
8.下列关于化学反应与能量的说法,正确的是( )
A.放热反应都能自发进行,吸热反应需要在加热的条件下才能进行
B.在化学反应中,反应物的总能量总是等于生成物的总能量
C.化学键断裂吸收能量,化学键形成放出能量
D.只有化学反应中才有能量的变化
9.硼化钒(VB2)-空气电池是目前储电能力最高的电池,示意图如图所示,该电池工作时的反应为4VB2+11O2=4B2O3+2V2O5。下列说法错误的是( )
A.放电时,OH-由a电极向VB2极移动
B.VB2极的电极反应式为2VB2-22e-+22OH-=2B2O3+V2O5+11H2O
C.电子由VB2极经KOH溶液流向电极a
D.若采用稀盐酸作电解质溶液,则该电池发生的总反应改变
10.已知SO2和O2反应生成2molSO3时,放出的热量为QkJ,在1L的密闭容器中进行反应2SO2(g)+O2(g)2SO3(g),SO2、O2、SO3的起始物质的量分别为0.2mol、0.1mol、0.2mol,下列叙述正确的是( )
A.某时刻,SO3的物质的量为0.28 mol,则SO2的转化率为40%
B.反应达到平衡时放出的热量为0.1QkJ
C.某时刻,SO2、O2、SO3的物质的量分别为0.3mol、0.15mol、0.15mol
D.某时刻,SO3的浓度可能为0.4mol-1·L-1
11.某学生设计了一个“黑笔写红字”的趣味实验滤纸先用氯化钠、无色酚酞的混合液浸湿,然后平铺在一块铂片上,接通电源后,用铅笔在滤纸上写字,会出现红色字迹。据此,下列叙述正确的是( )
A.铅笔端作阳极,生成氢气 B.铂片端作阴极,生成氯气
C.铅笔端有少量的氯气产生 D.a点是负极,b点是正极
12.有关下列四个常用电化学装置的叙述中,正确的是( )
图Ⅰ 碱性锌锰电池 图Ⅱ铅?硫酸蓄电池 图Ⅲ 电解精炼铜 图Ⅳ 银锌纽扣电池
A.图Ⅰ所示电池中,MnO2的作用是催化剂
B.图Ⅱ所示电池放电过程中,正极质量不断增大
C.图Ⅲ所示装置工作过程中,电解质溶液浓度始终不变
D.图Ⅳ所示电池中,放电时,负极附近溶液的pH不变
13.在密闭容器中进行可逆反应,A与B反应生成C,其反应速率分别用υ(A)、υ(B)、υ(C)(mol?L﹣1?s﹣1)表示,且υ(A)、υ(B)、υ(C)之间有如下所示的关系:υ(B)=3υ(A); 3υ(C)=2υ(B)。则此反应可表示为( )
A.2A+3B2C B.A+3B2C
C.3A+B2C D.A+BC
二、实验题
14.回答下列问题:
(1)肼(N2H4)和NO2是一种双组分火箭推进剂。两种气体混合发生反应生成N2和H2O(g),已知8g气体肼在上述反应中放出142kJ热量,其热化学方程式为___。
(2)已知反应2HI(g)=H2(g)+I2(g)的ΔH=+11kJ·mol-1,1 molH2(g)、1molI2(g)分子中化学键断裂时分别需要吸收436kJ、151kJ的能量,则1molHI(g)分子中化学键断裂时需吸收的能量为___kJ。
(3)草酸与KMnO4在酸性条件下能够发生如下反应:MnO4-+H2C2O4+H+→Mn2++CO2↑+H2O(未配平)。用4mL0.001mol/LKMnO4溶液与2mL0.01mol/LH2C2O4溶液,研究不同条件对化学反应速率的影响。改变的条件如下:
组别 10%硫酸体积/mL 温度/℃ 其他物质
Ⅰ 2 20 /
Ⅱ 2 20 10滴饱和MnSO4溶液
Ⅲ 2 30 /
Ⅳ 1 20 1 mL蒸馏水
①如果研究催化剂对化学反应速率的影响,使用实验___和____(用Ⅰ~Ⅳ表示,下同)。
②如果研究温度对化学反应速率的影响,使用实验____和____。
③对比实验Ⅰ和Ⅳ,可以研究____对化学反应速率的影响。
三、推断题
15.A、B、C、X和Y均为中学常见物质,其中A、B、C为单质,X、Y为化合物,各物质之间的转化关系如图所示部分反应条件略去.
若X是光导纤维的主要成分,工业上常利用反应Ⅰ制备B,Y的化学式为 ____,B的其中一种用途为 ______ .
若A、B为生活中常见的两种金属单质,X是一种黑色磁性物质.X与氢碘酸反应的离子方程式为 ______ .
若组成A的元素在短周期中原子半径最大稀有气体除外,以Y为电解质溶液,气体B为燃料,C为氧化剂可构成碱性燃料电池,其负极反应式为 ______ ,工作一段时间后,Y溶液的pH ______ 填“增大”、“减小”或“不变”.
若常温下A、B、C和X均为气体,Y为固体,管道工人曾利用反应Ⅰ检验氯气管道是否漏气.
的电子式为 ______ ,反应Ⅰ的化学方程式为 ______ .
将的X溶液与的Y溶液等体积混合,所得溶液中各离子浓度由大到小的顺序为 ______ .
16.某学生为了探究Zn与硫酸反应过程中的速率变化,在100mL稀硫酸中加入足量的Zn粒,用排水集气法收集反应放出的H2,实验记录如下(累计值):
时间(min) 1 2 3 4 5
氢气体积(mL)(标况下) 50 120 232 290 310
(1)哪一时间段(指0~1、1~2、2~3、3~4、4~5min)反应速率最大________,原因是_________。
(2)哪一时间段的反应速率最小_________,原因是____________。
(3)该同学在用稀硫酸与锌制取氢气的实验中,发现加入少量硫酸铜溶液可加快氢气的生成速率。
①硫酸铜溶液可以加快氢气生成速率的原因是____________。
②当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降。请分析氢气生成速率下降的主要原因____________。
(4)要加快上述实验中气体产生的速率,还可采取的措施有________(答两种)。
17.部分中学化学常见元素原子结构及性质如表所示
元素 结构及性质
A A在第三周期中简单离子半径最小
B B原子最外层电子数是内层电子数的
C 使用最广泛的金属元素C能形成两种氯化物,其相对分子质量之差为35.5
D D与B同主族,且通常状况下D没有正化合价
E E在周期表中位于IA族,有人认为将其排在VIIA族也有一定道理
F F与B同周期,其最高价氧化物的水化物与A或B的最高价氧化物的水化物均能反应
(1)C元素在周期表中的位置_____________;E形成的一种简单离子能支持“将E排在VIIA族”这一观点,该离子的结构示意图为_______________________。
(2)E与D可以按原子个数比2:1、1:1形成两种化合物X、Y,区别X、Y这两种物质的实验方法为________________________________。
E与B形成的一种化合物Z与X、Y中的一种电子总数相同且能发生化学反应,写出该反应的化学方程式__________________________(用相应化学式表示)
(3)请画出化合物F2B2的电子式__________,该化合物中含有的化学键类型是_______。
(4)将A、C的单质用导线连接后插入F的最高价氧化物的水化物溶液中可形成原电池,该原电池中阴离子移向_________(填“A”或“C”),写出该原电池总反应的离子方程式____________________。
四、计算题
18.为了提高煤的利用率,人们先把煤转化为CO和H2,再将它们转化为甲醇,某实验人员在一定温度下2L的密闭容器中,充入一定量的H2和CO,发生反应:2H2(g)+CO(g)CH3OH(g),测定的部分实验数据如下:
t/s 0 500 1?000
c(H2)/ mol.L-1 5.00 3.52 2.48
c(CO)/ mol.L-1 2.50
(1)在500s内用H2表示的化学反应速率是________________。
(2)在1000s内用CO表示的化学反应速率是________________,1000s时CO的转化率是________。
(3)在500s时生成的甲醇的浓度是________
19.(1)已知:2H2(g) + O2(g) == 2H2O(g);△H= –483.6 kJ·mol-1, H2(g) + O2(g) == H2O(l) △H=–285.8 kJ·,由此可知,在等温下蒸发45g液态水需吸收___________kJ的热量。
(2)工业制氢气的一个重要反应是:CO(g)+?H2O(g)?==?CO2(g)?+?H2(g),已知25℃时:
C(石墨)?+O2?(g)?==?CO2(g)??△H1?=-394?kJ·mol-1
C(石墨)?+O2?(g)?==?CO?(g)???△H2?=-111?kJ·mol-1
H2(g)?+O2?(g)==?H2O(g)??△H3=-242kJ·mol-1
试计算25℃时CO(g)+?H2O(g)?==?CO2(g)?+?H2(g)的△H=______?kJ·mol-1
(3) 在25℃、101KPa时,___时所放出的热量,叫做该反应的燃烧热。在25℃、101KPa时,1g乙醇完全燃烧生成CO2和液态水时放热29.713kJ,则能表示乙醇燃烧热的热化学方程式为________。
20.某温度下,在2L密闭容器中投入一定量的A、B发生反应:3A(g)+bB(g)cC(g) △H= -Q kJ?mol-1(Q>0),12s 时达到平衡,生成C的物质的量为0.8mol,反应过程如图所示。试计算:
(1)前12s内,A的平均反应速率为______________。
(2)化学计量数之比b:c=______________。
(3)12s内,A和B反应放出的热量为__________(用Q表示)。
参考答案
1.C 2.D 3.D 4.D 5.C 6.D 7.B 8.C 9.C 10.A 11.D 12.B 13.B
14.2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g);△H=-1136kJ/mol 299kJ Ⅰ Ⅱ Ⅰ Ⅲ c(H+)(或硫酸溶液的浓度)
15.CO 半导体、芯片、太阳能电池板等 减小
16.2~3min 反应放热,加快反应速率 4~5min 硫酸的浓度减小,反应速率减慢 Zn置换出Cu,形成原电池,加快反应速率 置换出的铜太多,覆盖在锌的表面,减小了锌与稀硫酸的接触面积,使反应速率慢 升高反应的温度;适当提高硫酸的浓度;将锌粒换成锌粉
17.第四周期第VIII族 分别取两种液体少量于试管中,加入少量二氧化锰,有大量气泡冒出的是H2O2 H2O2+H2S=S↓+2H2O 离子键、共价键 A 2Al+2OH-+6H2O=2[Al(OH)4]-+3H2↑ (或2Al+2OH-+2H2O=2AlO2-+3H2↑)
18.2.96×10?3mol/(L?s) 1.26×10?3mol/(L?s) 50.4% 0.74mol/L
19.110 -41 1mol纯物质完全燃烧生成稳定的氧化物 C2H5OH(l)+3O2(g)═2CO2(g)+3H2O(l)△H=-1366.8 kJ?mol-1
20.0.05mol/(L·s) 1:2 0.4Q kJ
