新人教版必修第二册第六章化学反应与能量第一节第3课时原电池原理应用化学电源(共22张PPT)
文档属性
| 名称 | 新人教版必修第二册第六章化学反应与能量第一节第3课时原电池原理应用化学电源(共22张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 906.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-03-03 17:59:59 | ||
图片预览






文档简介
(共22张PPT)
第六章 化学反应与能量
第一节 化学反应与能量变化
第3课时 原电池原理应用 化学电源
学习目标
1.知道干电池、充电电池、燃料电池等化学电池的特点。
2.掌握构成原电池的要素,了解不同电极材料对电池性能的影响。
3.能正确书写简单的化学电源的电极反应式。
学习探究
一、原电池原理应用
1.设计原电池
(1)依据
已知一个氧化还原反应,要先确定氧化剂、还原剂。一般还原剂为负极材料,在负极上被氧化;氧化剂即电解质中的阳离子,在正极上被还原。
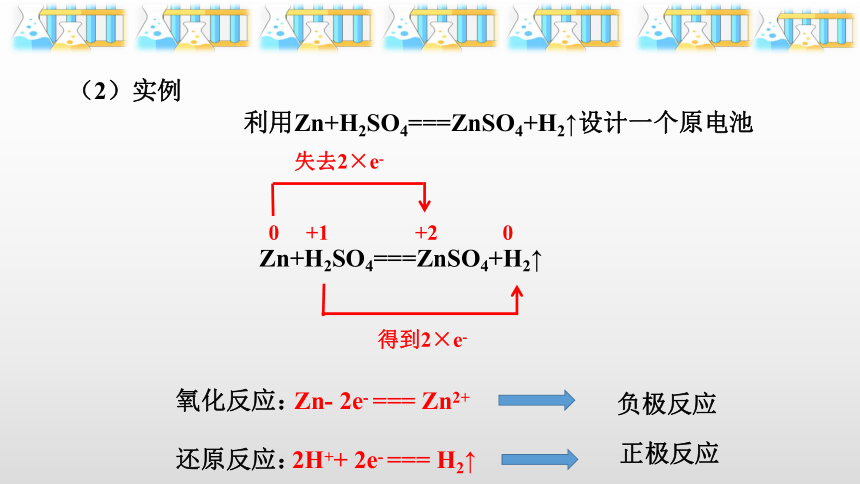
(2)实例
利用Zn+H2SO4===ZnSO4+H2↑设计一个原电池
Zn+H2SO4===ZnSO4+H2↑
0 +1 +2 0
失去2×e-
得到2×e-
Zn- 2e- === Zn2+
2H++ 2e- === H2↑
还原反应:
氧化反应:
负极反应
正极反应
Zn- 2e- === Zn2+
2H++ 2e- === H2↑
正极反应:
负极反应:
正极材料:Cu、C等比Zn的活动性弱的金属或导电的非金属
负极材料:Zn
电解质溶液:稀硫酸
双线桥法写电极反应:
(1)画出已知氧化还原反应的双线桥,标出电子转移方向和数目。
(2)将双线桥拆分成氧化反应和还原反应两个半反应。
(3)拆分出的氧化反应半反应为负极反应,还原反应半反应为正极反应。
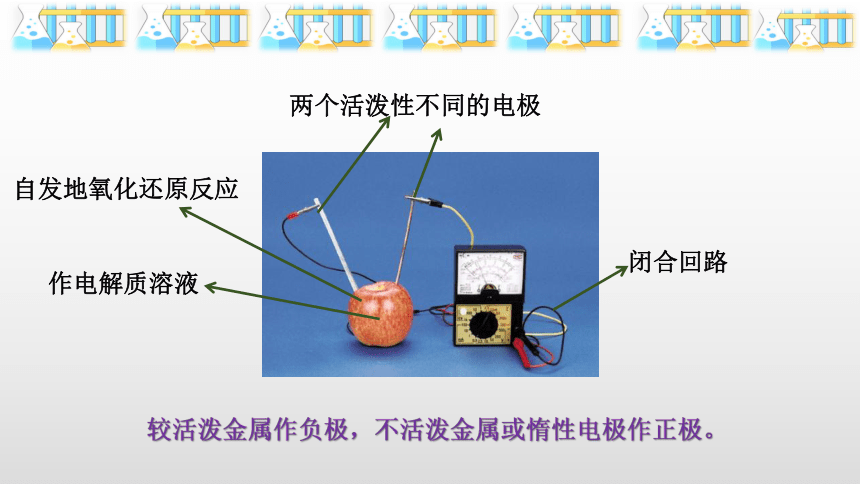
2.水果简易电池的制作
(1)构成水果电池的要素(电流表的指针偏向电子流入的电极)
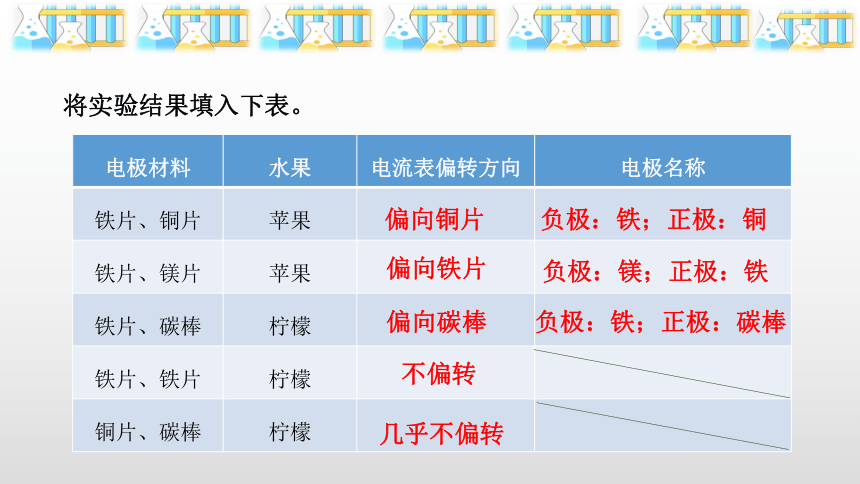
将实验结果填入下表。
电极材料 水果 电流表偏转方向 电极名称
铁片、铜片 苹果
铁片、镁片 苹果
铁片、碳棒 柠檬
铁片、铁片 柠檬
铜片、碳棒 柠檬
偏向铜片
偏向铁片
偏向碳棒
不偏转
几乎不偏转
负极:铁;正极:铜
负极:镁;正极:铁
负极:铁;正极:碳棒
作电解质溶液
两个活泼性不同的电极
闭合回路
自发地氧化还原反应
较活泼金属作负极,不活泼金属或惰性电极作正极。
其他条件相同时,电极材料活泼性相差越大,电流效果越好。
铁
铜
偏转角度小
镁
铜
偏转角度大
(2)影响电流效果的因素
其他条件相同时,不同的电解质溶液,电流效果不同。
苹果
柠檬
偏转角度小
偏转角度大
偏转角度大
偏转角度小
电极间距
2厘米
电极间距
1厘米
其他条件相同时,电极间距越小,电流效果越好。
二、化学电源
1.一次电池(以锌锰干电池为例)
电池放电后不能充电(内部的氧化还原反应无法逆向进行)。
锌锰干电池
正极
负极
电解质溶液
2.二次电池(充电电池)
铅酸电池
镍氢电池
锂离子电池
放电时所进行的氧化还原反应,在充电时可以逆向进行,使电池恢复到放电前的状态。
放电
充电
化学能
电能
3.燃料电池
反应物储存在电池外部,
能量转换率高、清洁、安全,供电易于调节。
常用燃料:氢气、甲烷、乙醇等。
常用氧化剂:氧气。
燃料电池电极反应式的书写
1.写出电池总反应式
燃料电池的总反应与燃料的燃烧反应一致,若产物能和电解质反应则总反应为加合后的反应。
2.写出电池的正负极反应式
无论负极燃料是H2还是含碳燃料,正极一般都是O2发生还原反应,在碱性条件下,正极反应式为O2+2H2O+4e- === 4OH-,若在酸性条件,则正极反应式为O2+4H++4e- === 2H2O。
3.写出负极反应式
负极反应式 = 总反应式 - 正极反应式。
随堂演练
1.下列有关原电池的说法正确的是( )。
A.理论上,任何氧化还原反应均可设计成原电池
B.原电池中,负极发生氧化反应
C.原电池中,正极材料一定发生还原反应
D.原电池中,正极材料必须与电解质溶液的某种离子反应
B
2.下列有关电池的说法正确的是( )。
A.锌锰干电池工作一段时间后,碳棒变细
B.氢氧燃料电池可将热能直接转化为电能
C.充电电池可以无限制地反复充电、放电
D.氢氧燃料电池比氢气直接燃烧发电能量利用率高
D
3.某锂离子电池的工作原理如图所示(a极材料为金属锂和石墨的复合材料,b极材料为FePO4和石墨的复合材料),其电池反应为Li+FePO4===LiFePO4。
(1)a为 极,电极反应式为: ;
b为 极,电极反应式: 。
(2)电池内部Li+由 侧移向 侧(填“左”或“右”)。
(3)能否用磷酸溶液作电解质 (填“能”或“否”)。
负
Li - e- === Li+
正
FePO4+ e-+Li+ ===LiFePO4
左
右
否
4.如图,为氢氧燃料电池。
当电解质溶液为硫酸时,电极反应:
负极: ;
正极: ;
电池总反应: 。
2H2 - 4e- === 4H+
O2+ 4e- + 4H+ === 2H2O
O2+2H2 === 2H2O
谢谢!
第六章 化学反应与能量
第一节 化学反应与能量变化
第3课时 原电池原理应用 化学电源
学习目标
1.知道干电池、充电电池、燃料电池等化学电池的特点。
2.掌握构成原电池的要素,了解不同电极材料对电池性能的影响。
3.能正确书写简单的化学电源的电极反应式。
学习探究
一、原电池原理应用
1.设计原电池
(1)依据
已知一个氧化还原反应,要先确定氧化剂、还原剂。一般还原剂为负极材料,在负极上被氧化;氧化剂即电解质中的阳离子,在正极上被还原。
(2)实例
利用Zn+H2SO4===ZnSO4+H2↑设计一个原电池
Zn+H2SO4===ZnSO4+H2↑
0 +1 +2 0
失去2×e-
得到2×e-
Zn- 2e- === Zn2+
2H++ 2e- === H2↑
还原反应:
氧化反应:
负极反应
正极反应
Zn- 2e- === Zn2+
2H++ 2e- === H2↑
正极反应:
负极反应:
正极材料:Cu、C等比Zn的活动性弱的金属或导电的非金属
负极材料:Zn
电解质溶液:稀硫酸
双线桥法写电极反应:
(1)画出已知氧化还原反应的双线桥,标出电子转移方向和数目。
(2)将双线桥拆分成氧化反应和还原反应两个半反应。
(3)拆分出的氧化反应半反应为负极反应,还原反应半反应为正极反应。
2.水果简易电池的制作
(1)构成水果电池的要素(电流表的指针偏向电子流入的电极)
将实验结果填入下表。
电极材料 水果 电流表偏转方向 电极名称
铁片、铜片 苹果
铁片、镁片 苹果
铁片、碳棒 柠檬
铁片、铁片 柠檬
铜片、碳棒 柠檬
偏向铜片
偏向铁片
偏向碳棒
不偏转
几乎不偏转
负极:铁;正极:铜
负极:镁;正极:铁
负极:铁;正极:碳棒
作电解质溶液
两个活泼性不同的电极
闭合回路
自发地氧化还原反应
较活泼金属作负极,不活泼金属或惰性电极作正极。
其他条件相同时,电极材料活泼性相差越大,电流效果越好。
铁
铜
偏转角度小
镁
铜
偏转角度大
(2)影响电流效果的因素
其他条件相同时,不同的电解质溶液,电流效果不同。
苹果
柠檬
偏转角度小
偏转角度大
偏转角度大
偏转角度小
电极间距
2厘米
电极间距
1厘米
其他条件相同时,电极间距越小,电流效果越好。
二、化学电源
1.一次电池(以锌锰干电池为例)
电池放电后不能充电(内部的氧化还原反应无法逆向进行)。
锌锰干电池
正极
负极
电解质溶液
2.二次电池(充电电池)
铅酸电池
镍氢电池
锂离子电池
放电时所进行的氧化还原反应,在充电时可以逆向进行,使电池恢复到放电前的状态。
放电
充电
化学能
电能
3.燃料电池
反应物储存在电池外部,
能量转换率高、清洁、安全,供电易于调节。
常用燃料:氢气、甲烷、乙醇等。
常用氧化剂:氧气。
燃料电池电极反应式的书写
1.写出电池总反应式
燃料电池的总反应与燃料的燃烧反应一致,若产物能和电解质反应则总反应为加合后的反应。
2.写出电池的正负极反应式
无论负极燃料是H2还是含碳燃料,正极一般都是O2发生还原反应,在碱性条件下,正极反应式为O2+2H2O+4e- === 4OH-,若在酸性条件,则正极反应式为O2+4H++4e- === 2H2O。
3.写出负极反应式
负极反应式 = 总反应式 - 正极反应式。
随堂演练
1.下列有关原电池的说法正确的是( )。
A.理论上,任何氧化还原反应均可设计成原电池
B.原电池中,负极发生氧化反应
C.原电池中,正极材料一定发生还原反应
D.原电池中,正极材料必须与电解质溶液的某种离子反应
B
2.下列有关电池的说法正确的是( )。
A.锌锰干电池工作一段时间后,碳棒变细
B.氢氧燃料电池可将热能直接转化为电能
C.充电电池可以无限制地反复充电、放电
D.氢氧燃料电池比氢气直接燃烧发电能量利用率高
D
3.某锂离子电池的工作原理如图所示(a极材料为金属锂和石墨的复合材料,b极材料为FePO4和石墨的复合材料),其电池反应为Li+FePO4===LiFePO4。
(1)a为 极,电极反应式为: ;
b为 极,电极反应式: 。
(2)电池内部Li+由 侧移向 侧(填“左”或“右”)。
(3)能否用磷酸溶液作电解质 (填“能”或“否”)。
负
Li - e- === Li+
正
FePO4+ e-+Li+ ===LiFePO4
左
右
否
4.如图,为氢氧燃料电池。
当电解质溶液为硫酸时,电极反应:
负极: ;
正极: ;
电池总反应: 。
2H2 - 4e- === 4H+
O2+ 4e- + 4H+ === 2H2O
O2+2H2 === 2H2O
谢谢!
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
