人教版2019高一《物质的量》第一课时教材分析以及课例分析(共29张ppt)
文档属性
| 名称 | 人教版2019高一《物质的量》第一课时教材分析以及课例分析(共29张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 4.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-03-03 18:53:24 | ||
图片预览




文档简介
(共29张PPT)
物质的量第一课时 课例分析
北京八中化学组
课例分析
1.教学指导思想
3.教学目标
4.教学策略及过程
2.教材分析
一、教学指导思想
课程标准
第一课时
课程标准
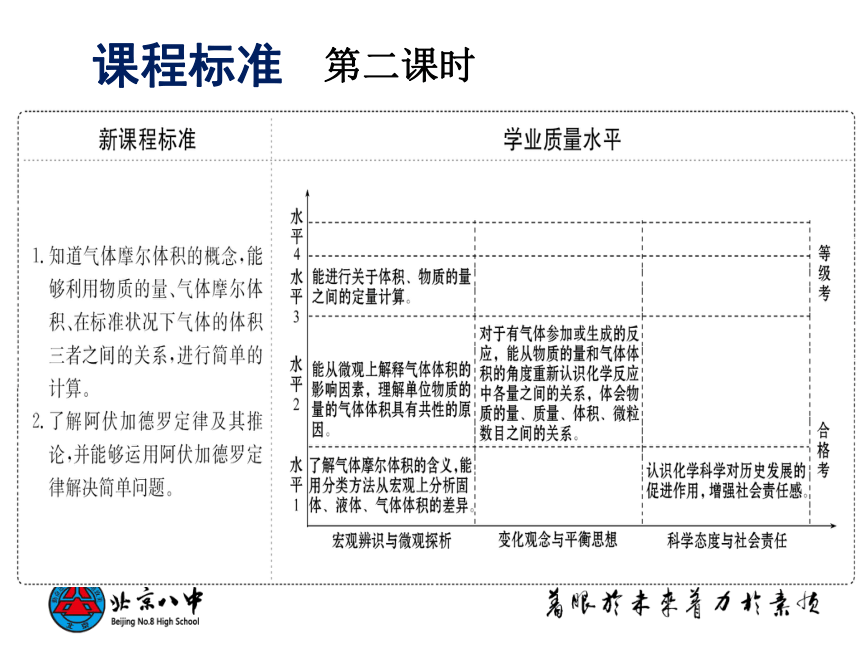
第二课时
课程标准
第三课时
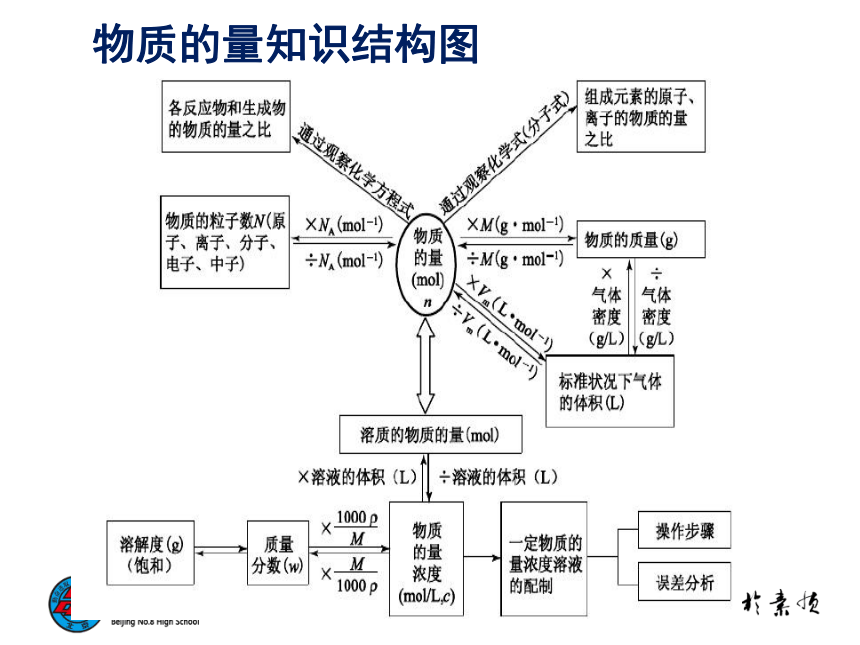
物质的量知识结构图
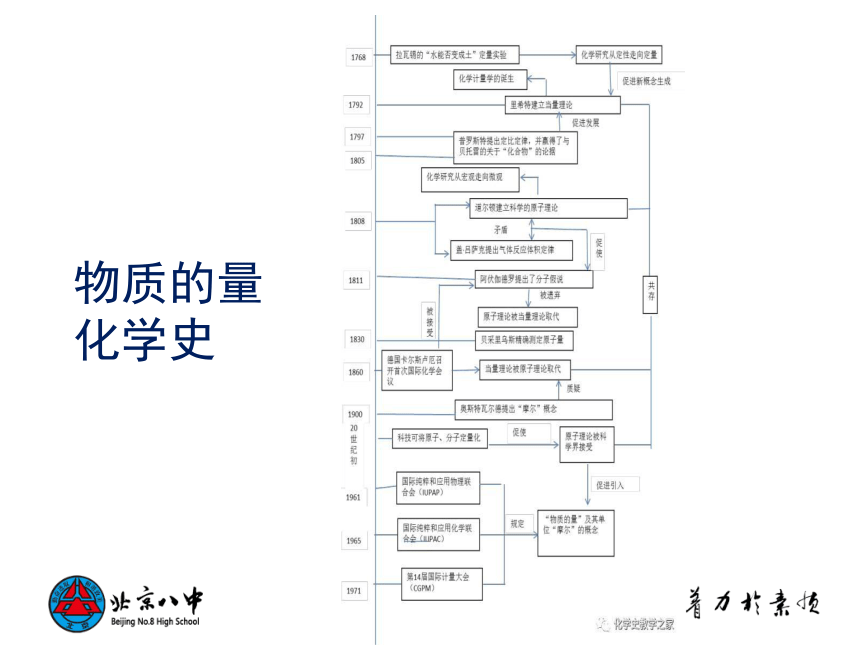
物质的量化学史
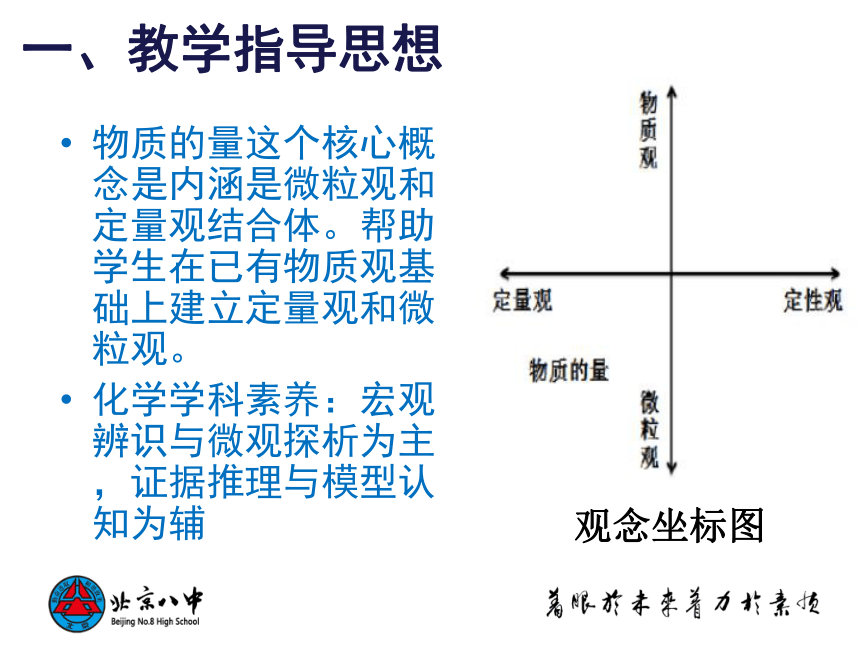
物质的量这个核心概念是内涵是微粒观和定量观结合体。帮助学生在已有物质观基础上建立定量观和微粒观。
化学学科素养:宏观辨识与微观探析为主,证据推理与模型认知为辅
观念坐标图
一、教学指导思想
二、教材分析
1.教材的地位与作用
本节内容安排在人教版化学必修一第二章第三节,物质的量是宏观与微观联系的桥梁。
属于“工具性”概念,贯穿与整个高中化学的教学始终,它在化学计算中处于核心地位。
鲁科版
1、掌握物质的量及其单位摩尔、NA、摩尔质量的概念
2、掌握n与NA、m与M间的关系
3、通过对物质的量概念的建构,建立宏观到微观的认知模型,学会运用类比推理、 归纳推理等一些基本的科学方法
三、教学目标
四、教学策略及过程
情景引入
问题探究
课堂练习
课堂总结
导出概念
n
mol
NA
M
2Na + Cl2 === 2NaCl
情景引入:复习旧知,引入新知
点燃
宏观 46g 71g 117g
微观 2个 1个 2个
微观粒子数?
表示?
100g米粒
?粒米
化整为零:
100粒米质量
……
在生活中,很多东西常常都不是单个使用,单个购买的。
定义:表示含有一定数目粒子的集合体的物理量,是国际单位制中七个物理量之一
符号: n
注意:
?.“粒子”在这里指分子、原子、离子、质子、电子、原子团、中子等微观微粒
?.“物质的量”是一个完整的、专用的名词,读写时四个字不能拆分、增减,同时要注意和“物质的质量”进行区别。
1.物质的量
导出概念
2、单位:摩尔,简称摩,符号mol
Mole:鼹鼠
国际制单位:
3.阿伏伽德罗常数(NA)
每年10月23日定为摩尔日。
计算的时候不用“≈”, 用“=”,叙述时用“约”。
1mol粒子集体所含的粒子数(NA)
=0.012 kg12C所含碳原子的数目
≈6.02×1023
注意:阿伏加德罗常数是一个物理量,单位是mol-1。
(1)1mol的C中有多少个 碳原子
(2)2mol的C中有多少个 碳原子
(3)1.02×1024个H,合多少 mol
(4)N个水分子的物质的量是 mol
请同学自己归纳n、N、NA三者关系
课堂练习1
在知道物质的量—微观粒子的“集合” 后,返回课堂最初提的问题,依然无法解决。那我们还需要知道什么呢?
金属钠由钠原子构成,那我们怎么迅速知道46g钠有多少钠原子呢?
质量m
物质的量n
引出摩尔质量
问题探究
填写以下表格,从这些数据中得出相关结论
【结论】:当质量以g为单位时,1 mol任何微粒(原子、分子、离子)的质量数值都与该粒子的相对原子质量或相对分子质量相等。
≈6.023×1023
≈6.023×1023
≈6.023×1023
≈6.023×1023
12g
56g
18g
23g
定义:单位物质的量的物质所具有的质量叫做摩尔质量
符号:为M,常用单位是g/mol
数值:1mol任何粒子的质量(g)在数值上都与该粒子的相对原子(分子)质量相等
相对原子(分子)质量与摩尔质量的单位不同,所表示的意义也不同
注意
导出概念2:摩尔质量
(1)3molC的质量是 。
(2)36gC的物质的量是 。
(3)64gCu的物质的量是 。
(4)72gNa2SO4含有 mol Na+。
请同学自己归纳n、m、M三者关系
课堂练习2
在知道钠原子的“集合”—物质的量后,我们又知道了钠原子的摩尔质量,就可以轻而易举的解决我们最开始提出的问题了。
金属钠由钠原子构成,那我们怎么迅速知道46 g钠有多少钠原子呢?
问题探究
2Na + Cl2 === 2NaCl
宏观 46 g 71 g 117 g
微观 2 mol 1 mol 2 mol
点燃
微观世界
宏观世界
通过这节课的学习,我们认识了四个名词、两个公式,并认识了一位伟大的科学家
物质的量
小结
【课堂练习】
1、下列关于摩尔质量的说法正确的是?( )
A、氯气的摩尔质量是71克????????
B、氯化氢的摩尔质量为36.5?g/moL?
C、1摩尔氢气的质量为2克????????
D、O2的摩尔质量为16g/moL
2、下列说法错误的是 ( )
A.1mol任何物质都含有约6.02×1023个原子
B.0.012kg12C约含有6.02×1023个碳原子
C.使用物质的量时,应用化学式指明粒子的种类
D.1mol H2的质量是1g
BC
AD
谢 谢 大 家!
物质的量第一课时 课例分析
北京八中化学组
课例分析
1.教学指导思想
3.教学目标
4.教学策略及过程
2.教材分析
一、教学指导思想
课程标准
第一课时
课程标准
第二课时
课程标准
第三课时
物质的量知识结构图
物质的量化学史
物质的量这个核心概念是内涵是微粒观和定量观结合体。帮助学生在已有物质观基础上建立定量观和微粒观。
化学学科素养:宏观辨识与微观探析为主,证据推理与模型认知为辅
观念坐标图
一、教学指导思想
二、教材分析
1.教材的地位与作用
本节内容安排在人教版化学必修一第二章第三节,物质的量是宏观与微观联系的桥梁。
属于“工具性”概念,贯穿与整个高中化学的教学始终,它在化学计算中处于核心地位。
鲁科版
1、掌握物质的量及其单位摩尔、NA、摩尔质量的概念
2、掌握n与NA、m与M间的关系
3、通过对物质的量概念的建构,建立宏观到微观的认知模型,学会运用类比推理、 归纳推理等一些基本的科学方法
三、教学目标
四、教学策略及过程
情景引入
问题探究
课堂练习
课堂总结
导出概念
n
mol
NA
M
2Na + Cl2 === 2NaCl
情景引入:复习旧知,引入新知
点燃
宏观 46g 71g 117g
微观 2个 1个 2个
微观粒子数?
表示?
100g米粒
?粒米
化整为零:
100粒米质量
……
在生活中,很多东西常常都不是单个使用,单个购买的。
定义:表示含有一定数目粒子的集合体的物理量,是国际单位制中七个物理量之一
符号: n
注意:
?.“粒子”在这里指分子、原子、离子、质子、电子、原子团、中子等微观微粒
?.“物质的量”是一个完整的、专用的名词,读写时四个字不能拆分、增减,同时要注意和“物质的质量”进行区别。
1.物质的量
导出概念
2、单位:摩尔,简称摩,符号mol
Mole:鼹鼠
国际制单位:
3.阿伏伽德罗常数(NA)
每年10月23日定为摩尔日。
计算的时候不用“≈”, 用“=”,叙述时用“约”。
1mol粒子集体所含的粒子数(NA)
=0.012 kg12C所含碳原子的数目
≈6.02×1023
注意:阿伏加德罗常数是一个物理量,单位是mol-1。
(1)1mol的C中有多少个 碳原子
(2)2mol的C中有多少个 碳原子
(3)1.02×1024个H,合多少 mol
(4)N个水分子的物质的量是 mol
请同学自己归纳n、N、NA三者关系
课堂练习1
在知道物质的量—微观粒子的“集合” 后,返回课堂最初提的问题,依然无法解决。那我们还需要知道什么呢?
金属钠由钠原子构成,那我们怎么迅速知道46g钠有多少钠原子呢?
质量m
物质的量n
引出摩尔质量
问题探究
填写以下表格,从这些数据中得出相关结论
【结论】:当质量以g为单位时,1 mol任何微粒(原子、分子、离子)的质量数值都与该粒子的相对原子质量或相对分子质量相等。
≈6.023×1023
≈6.023×1023
≈6.023×1023
≈6.023×1023
12g
56g
18g
23g
定义:单位物质的量的物质所具有的质量叫做摩尔质量
符号:为M,常用单位是g/mol
数值:1mol任何粒子的质量(g)在数值上都与该粒子的相对原子(分子)质量相等
相对原子(分子)质量与摩尔质量的单位不同,所表示的意义也不同
注意
导出概念2:摩尔质量
(1)3molC的质量是 。
(2)36gC的物质的量是 。
(3)64gCu的物质的量是 。
(4)72gNa2SO4含有 mol Na+。
请同学自己归纳n、m、M三者关系
课堂练习2
在知道钠原子的“集合”—物质的量后,我们又知道了钠原子的摩尔质量,就可以轻而易举的解决我们最开始提出的问题了。
金属钠由钠原子构成,那我们怎么迅速知道46 g钠有多少钠原子呢?
问题探究
2Na + Cl2 === 2NaCl
宏观 46 g 71 g 117 g
微观 2 mol 1 mol 2 mol
点燃
微观世界
宏观世界
通过这节课的学习,我们认识了四个名词、两个公式,并认识了一位伟大的科学家
物质的量
小结
【课堂练习】
1、下列关于摩尔质量的说法正确的是?( )
A、氯气的摩尔质量是71克????????
B、氯化氢的摩尔质量为36.5?g/moL?
C、1摩尔氢气的质量为2克????????
D、O2的摩尔质量为16g/moL
2、下列说法错误的是 ( )
A.1mol任何物质都含有约6.02×1023个原子
B.0.012kg12C约含有6.02×1023个碳原子
C.使用物质的量时,应用化学式指明粒子的种类
D.1mol H2的质量是1g
BC
AD
谢 谢 大 家!
