第七单元 常见的酸和碱 复习课件(20张PPT)
文档属性
| 名称 | 第七单元 常见的酸和碱 复习课件(20张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 4.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-03-04 00:00:00 | ||
图片预览







文档简介
(共20张PPT)
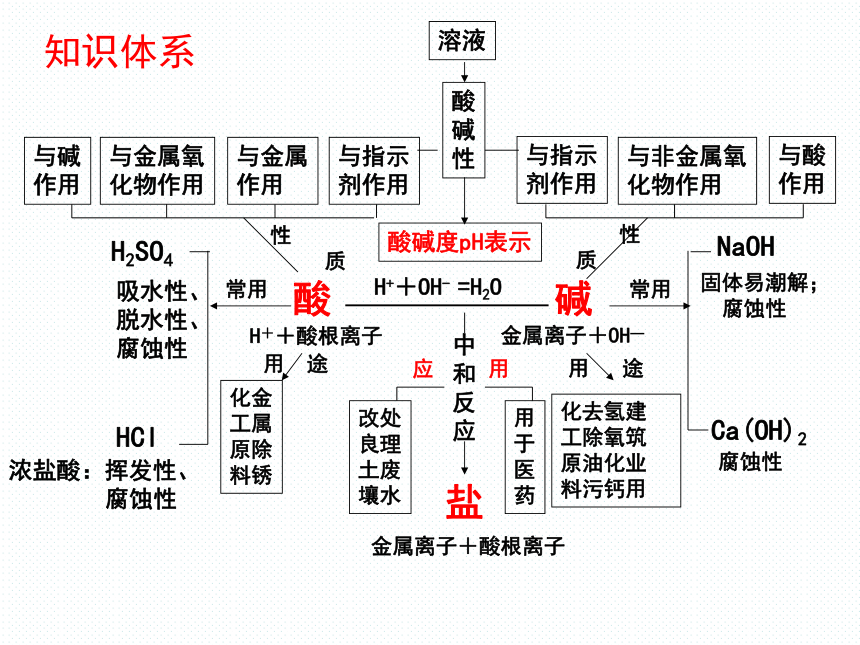
第八章 常见的酸和碱
吸水性、脱水性、腐蚀性
常考的知识点
1、常见的酸:①浓盐酸、浓硫酸的特性(常考);
②盐酸、稀硫酸的化学性质及有关的
化学方程式(必考);
③浓硫酸的稀释(常考)。
知识点1 溶液的酸碱性
知识回顾
知识回顾
1.像石蕊、酚酞这样,能跟酸或碱的溶液起作用而显示不同颜色的物质叫_____________。
遇酸溶液______
遇碱溶液______
酚酞试液
遇酸溶液_______
遇碱溶液_____
石蕊试液
酸碱指示剂
变红
变蓝
不变色
变红
知识回顾
2.人们用_______来表示溶液酸性和碱性强弱的程度。
pH=7时,溶液呈____
pH<7时,溶液呈____
pH>7时,溶液呈____
溶液酸性越强,pH____;溶液碱性越强,pH_____。
越小
越大
中性
酸性
碱性
pH
pH测定方法:在__________上放一小片pH试纸,用__________蘸取被测液,滴到试纸上,把试纸的颜色与______________比较。
玻璃片
玻璃棒
标准比色卡
【注意】
①指示剂遇到酸性溶液或碱性溶液时,变色的是指示剂,而不是酸性溶液或碱性溶液;
②根据指示剂颜色的变化,能判断溶液的酸碱性,但不能确定此溶液一定是酸或一定是碱。因为有的盐溶液可能会显酸性或碱性,如Na2CO3溶液显碱性。
③pH试纸测溶液的pH时,pH试纸不能用水润湿;
④不能将pH试纸直接放入待测试样溶液中,会污染试剂。
知识回顾
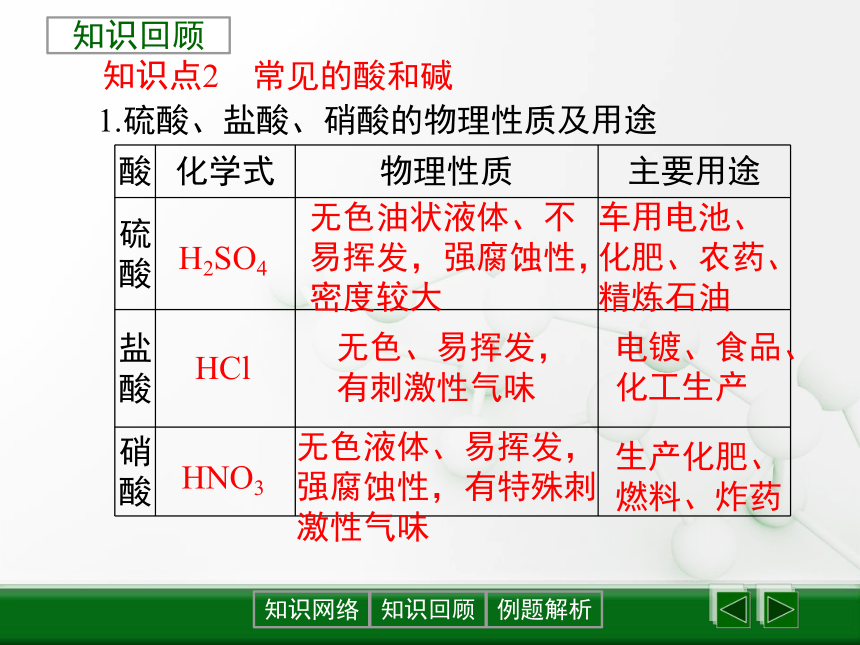
知识点2 常见的酸和碱
知识回顾
1.硫酸、盐酸、硝酸的物理性质及用途
H2SO4
HCl
HNO3
无色、易挥发,有刺激性气味
电镀、食品、化工生产
无色油状液体、不易挥发,强腐蚀性,密度较大
车用电池、化肥、农药、精炼石油
无色液体、易挥发,强腐蚀性,有特殊刺激性气味
生产化肥、燃料、炸药
酸 化学式 物理性质 主要用途
硫酸
盐酸
硝酸
知识回顾
2.浓硫酸很快使蔗糖、纸张等脱水,变成碳,可见它有________________。
——可做____________。
浓硫酸有强吸水性
强脱水性
强腐蚀性
干燥剂
浓硫酸的稀释方法:把________缓缓注入盛有_____的烧杯中,用________引流(或沿着烧杯壁缓缓倾倒)并不断______。
玻璃棒
浓硫酸
水
搅拌
浓硫酸对衣物、皮肤等有____________。
如果不慎沾上硫酸,应立即用布抹去,再用大量水冲洗。
课堂训练:
1.下列物质敞口放一段时间,质量会减少的是 ( )
A.浓硫酸 B.大理石
C.稀硫酸 D.浓盐酸
D
B
2.下列叙述正确的是 ( )
A.打开浓盐酸的试剂瓶盖,瓶口出现白烟
B.用浓硫酸在白纸上写字,白纸上的字迹慢慢变黑
C.把鼻孔凑到容器口闻气体的气味
D.稀硫酸沾到皮肤或衣服上,无需处理
吸水性 质量增大
挥发性
小液滴
3.(2012南宁)打开盛有浓盐酸的试剂瓶的瓶盖,可观察到 的现象,这是因为浓盐酸具有 性。浓盐酸长期敞口放置在空气中,溶液中溶质的质量会 (填增大、不变、减小)
(2015南宁、2018市一模)浓硫酸是实验室常用的气体干燥剂,说明浓硫酸具有 性
瓶口出现白雾
挥发
减小
吸水性
中考 链接
浓硫酸很快使蔗糖、纸张等脱水,变成碳,可见它有________________。
强脱水性
4、(07福州)图14 是稀释浓硫酸实验
的示意图。
( 1 )写出图14 中a 、b 两种仪器的名称:____________ _______
( 2 ) b 容器所盛的试剂是________(填“水”或“浓硫酸,' )。
( 3 )稀释时,若两种试剂添加顺序颠倒,将会发生 __________________
【 联系与拓展】 据媒体报道,2007 年5 月有一村民在家里误将装在酒瓶中的浓硫酸当成白酒喝下,造成食道和胃严重损伤,这是因为浓硫酸具有_____________________ 。
这一事件警示我们,家中存放或使用药物时应注意_____________________________.
浓硫酸的稀释方法、腐蚀性、使用注意事项
玻璃棒
量筒
浓硫酸
硫酸溶液飞溅出来伤人
强烈的腐蚀性
注意保存和小心使用
三、酸的化学性质
1:酸能与指示剂反应。
酸遇紫色石蕊试液变 ,遇无色酚酞溶液 。
红色
不变色
三、酸的化学性质:
2:酸能与多种活泼金属反应。
Mg+2HCl=MgCl2+H2↑
Zn+2HCl=ZnCl2+H2↑
Mg+H2SO4=MgSO4+H2↑
Zn+H2SO4=ZnSO4+H2↑
Fe+2HCl=FeCl2+H2↑
Fe+H2SO4=FeSO4+H2↑
★注意:置换反应——一种单质与一种化合物作用,生成另一种单质和另一种化合物的反应。( AB + C = A + CB )
与稀盐酸反应 与稀硫酸反应
镁
锌
铁
三、酸的化学性质
3、酸能与某些金属氧化物反应
Fe2O3+6HCl=2FeCl3+3H2O
Fe2O3+3H2SO4=Fe2(SO4)3+3H2O
CuO+2HCl=CuCl2+H2O
CuO+H2SO4=CuSO4+H2O
现象 化学方程式
铁锈+盐酸
铁锈+硫酸
氧化铜+盐酸
氧化铜+硫酸
三、酸的化学性质
4、酸能与碱发生反应。
★注意:中和反应——酸与碱作用生成盐和水 的反应。(实质:H+ + OH- = H2O)
实验室用大理石和稀盐酸反应制二氧化碳:
_________________________________
纯碱中加入稀盐酸:
__________________________________
CaCO3 + 2HCl = CaCl2 + H2O + CO2 ↑
Na2CO3 + 2HCl = 2NaCl + H2O + CO2 ↑
三、酸的化学性质
5、酸能与某些盐发生反应
例题解析
命题角度:考查学生对常见酸的知识的掌握情况
1、 生锈的铁钉放入足量的稀盐酸中,片刻观察到的现象是_________________________________,发生的化学方程式___________________________;反应一段时间后,又观察到的现象是_____________,发生反应的化学方程式为_____________________。
?考点、常见酸的性质和用途
铁锈逐渐消失,无色溶液变成黄色
Fe2O3 + 6HCl == 2FeCl3+3H2O
有气泡产生
Fe + 2HCl == FeCl2 + H2↑
2、(15南宁)稀盐酸和稀硫酸都可以用于金属除锈,是因为他们的溶液中都含有
3、(15桂林)区分稀硫酸和稀盐酸,不能使用的试剂是( )
A、Ba(NO3 )2 B、BaCl2
C、 Ba(OH) 2 D、NaCl
H+
D
4. 酸碱反应与人们的日常生活和生产有密切的关系。
(1)由于人的胃里有_________,胃液分泌过多会引起胃病,服用含有氢氧化铝的药物可缓解病痛。其治疗的化学原理为(用化学方程式表示)____________________
(2) 做馒头发酵面团时,会产生乳酸等有机酸,蒸馒头前需加进适量的纯碱或小苏打等碱性物质,它们相互作用产生了__________气体(填化学式),使蒸出的馒头疏松多孔。若加入的碱性物质过多,可向面团或蒸锅中滴加少许_______ (填名称),否则蒸出的馒头会变涩,颜色发黄。
盐酸
Al(OH)3+3HCl=AlCl3+3H2O
CO2
食醋
第八章 常见的酸和碱
吸水性、脱水性、腐蚀性
常考的知识点
1、常见的酸:①浓盐酸、浓硫酸的特性(常考);
②盐酸、稀硫酸的化学性质及有关的
化学方程式(必考);
③浓硫酸的稀释(常考)。
知识点1 溶液的酸碱性
知识回顾
知识回顾
1.像石蕊、酚酞这样,能跟酸或碱的溶液起作用而显示不同颜色的物质叫_____________。
遇酸溶液______
遇碱溶液______
酚酞试液
遇酸溶液_______
遇碱溶液_____
石蕊试液
酸碱指示剂
变红
变蓝
不变色
变红
知识回顾
2.人们用_______来表示溶液酸性和碱性强弱的程度。
pH=7时,溶液呈____
pH<7时,溶液呈____
pH>7时,溶液呈____
溶液酸性越强,pH____;溶液碱性越强,pH_____。
越小
越大
中性
酸性
碱性
pH
pH测定方法:在__________上放一小片pH试纸,用__________蘸取被测液,滴到试纸上,把试纸的颜色与______________比较。
玻璃片
玻璃棒
标准比色卡
【注意】
①指示剂遇到酸性溶液或碱性溶液时,变色的是指示剂,而不是酸性溶液或碱性溶液;
②根据指示剂颜色的变化,能判断溶液的酸碱性,但不能确定此溶液一定是酸或一定是碱。因为有的盐溶液可能会显酸性或碱性,如Na2CO3溶液显碱性。
③pH试纸测溶液的pH时,pH试纸不能用水润湿;
④不能将pH试纸直接放入待测试样溶液中,会污染试剂。
知识回顾
知识点2 常见的酸和碱
知识回顾
1.硫酸、盐酸、硝酸的物理性质及用途
H2SO4
HCl
HNO3
无色、易挥发,有刺激性气味
电镀、食品、化工生产
无色油状液体、不易挥发,强腐蚀性,密度较大
车用电池、化肥、农药、精炼石油
无色液体、易挥发,强腐蚀性,有特殊刺激性气味
生产化肥、燃料、炸药
酸 化学式 物理性质 主要用途
硫酸
盐酸
硝酸
知识回顾
2.浓硫酸很快使蔗糖、纸张等脱水,变成碳,可见它有________________。
——可做____________。
浓硫酸有强吸水性
强脱水性
强腐蚀性
干燥剂
浓硫酸的稀释方法:把________缓缓注入盛有_____的烧杯中,用________引流(或沿着烧杯壁缓缓倾倒)并不断______。
玻璃棒
浓硫酸
水
搅拌
浓硫酸对衣物、皮肤等有____________。
如果不慎沾上硫酸,应立即用布抹去,再用大量水冲洗。
课堂训练:
1.下列物质敞口放一段时间,质量会减少的是 ( )
A.浓硫酸 B.大理石
C.稀硫酸 D.浓盐酸
D
B
2.下列叙述正确的是 ( )
A.打开浓盐酸的试剂瓶盖,瓶口出现白烟
B.用浓硫酸在白纸上写字,白纸上的字迹慢慢变黑
C.把鼻孔凑到容器口闻气体的气味
D.稀硫酸沾到皮肤或衣服上,无需处理
吸水性 质量增大
挥发性
小液滴
3.(2012南宁)打开盛有浓盐酸的试剂瓶的瓶盖,可观察到 的现象,这是因为浓盐酸具有 性。浓盐酸长期敞口放置在空气中,溶液中溶质的质量会 (填增大、不变、减小)
(2015南宁、2018市一模)浓硫酸是实验室常用的气体干燥剂,说明浓硫酸具有 性
瓶口出现白雾
挥发
减小
吸水性
中考 链接
浓硫酸很快使蔗糖、纸张等脱水,变成碳,可见它有________________。
强脱水性
4、(07福州)图14 是稀释浓硫酸实验
的示意图。
( 1 )写出图14 中a 、b 两种仪器的名称:____________ _______
( 2 ) b 容器所盛的试剂是________(填“水”或“浓硫酸,' )。
( 3 )稀释时,若两种试剂添加顺序颠倒,将会发生 __________________
【 联系与拓展】 据媒体报道,2007 年5 月有一村民在家里误将装在酒瓶中的浓硫酸当成白酒喝下,造成食道和胃严重损伤,这是因为浓硫酸具有_____________________ 。
这一事件警示我们,家中存放或使用药物时应注意_____________________________.
浓硫酸的稀释方法、腐蚀性、使用注意事项
玻璃棒
量筒
浓硫酸
硫酸溶液飞溅出来伤人
强烈的腐蚀性
注意保存和小心使用
三、酸的化学性质
1:酸能与指示剂反应。
酸遇紫色石蕊试液变 ,遇无色酚酞溶液 。
红色
不变色
三、酸的化学性质:
2:酸能与多种活泼金属反应。
Mg+2HCl=MgCl2+H2↑
Zn+2HCl=ZnCl2+H2↑
Mg+H2SO4=MgSO4+H2↑
Zn+H2SO4=ZnSO4+H2↑
Fe+2HCl=FeCl2+H2↑
Fe+H2SO4=FeSO4+H2↑
★注意:置换反应——一种单质与一种化合物作用,生成另一种单质和另一种化合物的反应。( AB + C = A + CB )
与稀盐酸反应 与稀硫酸反应
镁
锌
铁
三、酸的化学性质
3、酸能与某些金属氧化物反应
Fe2O3+6HCl=2FeCl3+3H2O
Fe2O3+3H2SO4=Fe2(SO4)3+3H2O
CuO+2HCl=CuCl2+H2O
CuO+H2SO4=CuSO4+H2O
现象 化学方程式
铁锈+盐酸
铁锈+硫酸
氧化铜+盐酸
氧化铜+硫酸
三、酸的化学性质
4、酸能与碱发生反应。
★注意:中和反应——酸与碱作用生成盐和水 的反应。(实质:H+ + OH- = H2O)
实验室用大理石和稀盐酸反应制二氧化碳:
_________________________________
纯碱中加入稀盐酸:
__________________________________
CaCO3 + 2HCl = CaCl2 + H2O + CO2 ↑
Na2CO3 + 2HCl = 2NaCl + H2O + CO2 ↑
三、酸的化学性质
5、酸能与某些盐发生反应
例题解析
命题角度:考查学生对常见酸的知识的掌握情况
1、 生锈的铁钉放入足量的稀盐酸中,片刻观察到的现象是_________________________________,发生的化学方程式___________________________;反应一段时间后,又观察到的现象是_____________,发生反应的化学方程式为_____________________。
?考点、常见酸的性质和用途
铁锈逐渐消失,无色溶液变成黄色
Fe2O3 + 6HCl == 2FeCl3+3H2O
有气泡产生
Fe + 2HCl == FeCl2 + H2↑
2、(15南宁)稀盐酸和稀硫酸都可以用于金属除锈,是因为他们的溶液中都含有
3、(15桂林)区分稀硫酸和稀盐酸,不能使用的试剂是( )
A、Ba(NO3 )2 B、BaCl2
C、 Ba(OH) 2 D、NaCl
H+
D
4. 酸碱反应与人们的日常生活和生产有密切的关系。
(1)由于人的胃里有_________,胃液分泌过多会引起胃病,服用含有氢氧化铝的药物可缓解病痛。其治疗的化学原理为(用化学方程式表示)____________________
(2) 做馒头发酵面团时,会产生乳酸等有机酸,蒸馒头前需加进适量的纯碱或小苏打等碱性物质,它们相互作用产生了__________气体(填化学式),使蒸出的馒头疏松多孔。若加入的碱性物质过多,可向面团或蒸锅中滴加少许_______ (填名称),否则蒸出的馒头会变涩,颜色发黄。
盐酸
Al(OH)3+3HCl=AlCl3+3H2O
CO2
食醋
同课章节目录
- 第七单元 常见的酸和碱
- 第一节 酸及其性质
- 第二节 碱及其性质
- 第三节 溶液的酸碱性
- 第四节 酸碱中和反应
- 到实验室去:探究酸和碱的化学性质
- 第八单元 海水中的化学
- 第一节 海洋化学资源
- 第二节 海水“晒盐“
- 第三节 海水“制碱“
- 到实验室去:粗盐中难溶性杂质的去除
- 第九单元 金属
- 第一节 常见的金属材料
- 第二节 金属的化学性质
- 第三节 钢铁的锈蚀与防护
- 到实验室去 探究金属的性质
- 第十单元 化学与健康
- 第一节 食物中的有机物
- 第二节 化学元素与人体健康
- 第三节 远离有毒物质
- 第十一单元 化学与社会发展
- 第一节 化学与能源开发
- 第二节 化学与材料研制
- 第三节 化学与农业生产
- 第四节 化学与环境保护
