第八单元 海水中的化学 第二节 海水“制碱” ——盐的化学性质 课件(21张PPT)
文档属性
| 名称 | 第八单元 海水中的化学 第二节 海水“制碱” ——盐的化学性质 课件(21张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 1.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-03-04 17:46:10 | ||
图片预览







文档简介
(共21张PPT)
盐的化学性质
初三化学下册复习课
学习目标
1、巩固物质分类及复分解反应的理解;
2、理解并掌握盐的化学性质,学习归纳方法;
3、通过习题训练,了解盐化学性质的应用。
1.Mg 2.H2SO4 3.FeSO4 4.NaOH 5. K2CO3
6.FeCO3 7. K2SO4 8. Na2SO4 9.MgSO4 10. Fe(OH)2
(2).上面物质属于盐的是 。
3、5、6、7、8、9
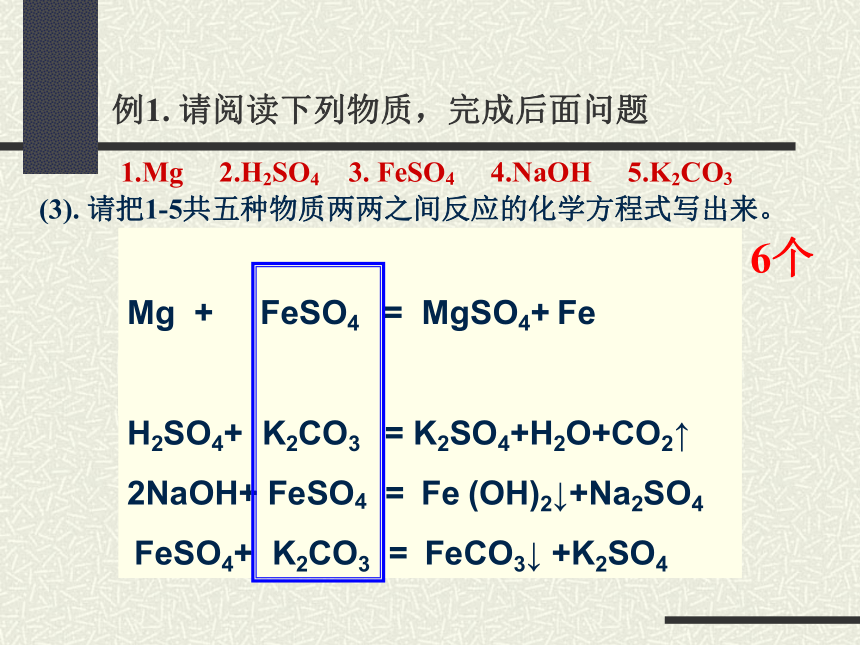
例1. 请阅读下列物质,完成后面问题
(1).请读出上述各物质的名称
1.Mg 2.H2SO4 3. FeSO4 4.NaOH 5.K2CO3
(3). 请把1-5共五种物质两两之间反应的化学方程式写出来。
Mg+ H2SO4 = MgSO4+H2 ↑
Mg + FeSO4 = MgSO4+ Fe
2NaOH+ H2SO4 = Na2SO4+2H2O
H2SO4+ K2CO3 = K2SO4+H2O+CO2↑
2NaOH+ FeSO4 = Fe (OH)2↓+Na2SO4
FeSO4+ K2CO3 = FeCO3↓ +K2SO4
6个
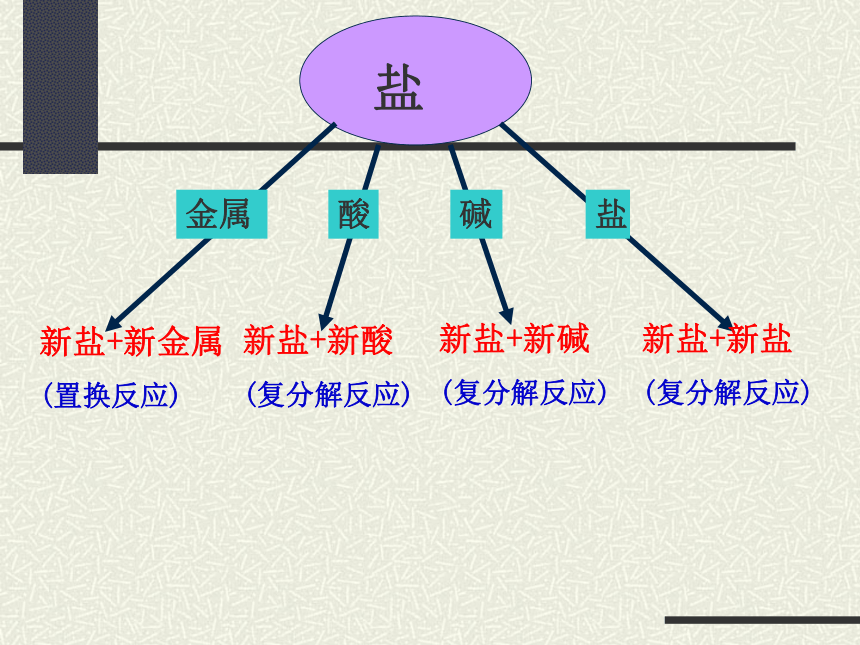
例1. 请阅读下列物质,完成后面问题
金属
新盐+新金属
(置换反应)
酸
新盐+新酸
(复分解反应)
新盐+新碱
(复分解反应)
盐
新盐+新盐
(复分解反应)
碱
盐的化学性质一:盐+金属---新盐+新金属
① CuSO4 + Fe = Cu + FeSO4
②2AgNO3 + Cu = 2Ag + Cu(NO3)2
③ 不反应
④不反应
归纳:金属+盐(溶液)-新盐+新金属(活动性:金属>新金属)
金属活动顺序表:
K Ca Na Mg Al Zn Fe Sn Pb(H)Cu Hg Ag Pt Au
金属活动性逐渐减弱
盐的化学性质二:盐+酸---新盐+新酸
(1) CaCO3 (难溶) +HNO3 —
(2) Na2CO3 +HCl —
(3) NaNO3 +H2SO4—
(4) AgCl (难溶) +HNO3 —
(5) BaCl2 +H2SO4 —
(6) BaSO4 (难溶) +HNO3 —
例3、判断下列反应能否在水中发生:
归纳:盐+酸--新盐+新酸(产物有气体或沉淀或水生成)
盐的化学性质三:盐+碱---新盐+新碱
(1)KNO3 +NaOH –
(2)BaCO3 (难溶) +NaOH –
(3)FeCl3 +Ca(OH)2 –
(4)Na2CO3 +Ca(OH)2 –
(5)Na2CO3 +Cu(OH)2 (难溶) –
例4、判断下列反应能否在水中发生:
(1)不反应
(2)不反应
(3)2FeCl3+3Ca(OH)2=2Fe(OH)3 ↓+3CaCl 2
(4) Na2CO3+Ca(OH)2=2NaOH +CaCO3 ↓
(5)不反应
归纳:盐(溶液)+碱(溶液)---新盐+新碱(产物有沉淀生成)
盐的化学性质四:盐+盐---新盐+新盐
(1)AgNO3 + NaCl —
(2)BaSO4(难溶) +Na2CO3—
(3)BaCl2 + Na2CO3—
(4)KNO3 + NaCl —
例5、判断下列反应能否在水中发生:
(1)AgNO3+NaCl = AgCl↓+NaNO3
(2)不反应
(3)BaCl2+Na2CO3=BaCO3↓+2NaCl
(4)不反应
归纳:盐(溶液)+碱(溶液)--新盐+新盐(产物有沉淀生成)
盐的主要化学性质
(可溶)
(可溶)
(可溶)
(可溶)
(可溶)
(至少有一种沉淀)
(至少有一种沉淀)
归纳小结
(有沉淀或气体或沉淀生成)
(活动性:金属>新金属)
2.一次性区别氯化钠、氯化钡、碳酸钾三种物质的溶液,
应选用( )
A.硝酸银溶液??B.稀硫酸 C.稀盐酸?? D.石灰水
B
练习1-2(盐化学性质应用:物质鉴别)
1.将珍珠放入稀盐酸中,有气泡产生,生成的气体能使澄
清的石灰水变浑浊,则珍珠中含有下列离子中的( )
A、氯离子 B、硫酸根离子
C、碳酸根离子 D、氢氧根离子
C
3. 用Mg、MgO、Mg(OH)2、H2SO4溶液、CuSO4溶液五种
物质两两进行反应,能得到MgSO4的方法有( )
A.3种 B.4种 C.5种 D.无法确定
B
盐
酸+碱
金属+酸
金属+盐
酸+盐
盐+碱
盐+盐
金属氧化物+酸
非金属氧化物+碱
√
√
√
√
练习3(盐化学性质应用:物质制备)
4.下列物质的转变,不能通过一步反应实现的是( )
A.K2SO4→KOH????????? ? B.CO2→CaCO3
C.Cu(NO3)2→CuCl2? D.FeCl3→Fe(OH)3
C
5.下列各组物质能同时存在于同一溶液中的是( )
A.AgNO3、NaCl、KNO3 B.CuSO4、KNO3、Na2CO3
C.NaOH、KCl、Fe(NO3)3 D.KCl、NaOH、Na2CO3
D
练习4-5(盐化学性质应用:物质转化与共存)
6.从Ba(OH)2、Na2SO4、稀HCl、BaCl2四种溶液中,选择适当的物质填入下图方框中。
练习6(盐化学性质应用:物质推断)
7.除去下列物质中的杂质(括号中为杂质),应选什么试剂?
①NaCl[Na2CO3]
②KNO3[KCl]
③CaCl2[NH4Cl]
④NaCl[MgSO4]
HCl
AgNO3
Ca(OH)2
Ba(OH)2
KCl+AgNO3=AgCl↓+KNO3
2NH4Cl+Ca(OH)2=CaCl2+2NH3↑+2H2O
MgSO4+Ba(OH)2=BaSO4↓+Mg(OH)2↓
2HCl+Na2CO3=2NaCl+CO2↑+H2O
练习7(盐化学性质应用:除杂质)
1、酸碱盐的分类;
归纳小结:
2、盐的主要化学性质;
3、盐的化学性质的不同应用;
作业:
1、阅读第十一单元教材;
2、完成学案课后检测试题。
某医院来了一急救病人。
病因:昨天晚上该病人感觉胃部不适、反酸,于是他
服用了一种主要成分为NaHCO3胃药。
病症:胃出血
既往病史:患有胃溃疡。
如果你是该病人的主治医师,请你分析出该病人胃出血的原因:
_______ _________________ _______________;
写出化学方程式:________________________
NaHCO3与胃酸反应生成CO2,在溃疡处造成胃穿孔而出血
NaHCO3+HCl=NaCl+H2O+CO2↑
课后检测1
2.现有H2SO4、BaCl2、 NaOH 、 Na2CO3 、 Ca(OH)2五种
物质的溶液和CO2一种气体,如图11-15所示的相互反应关系,
图中每条线表示两端的物质可以发生化学反应。请将它们的
化学式填入图中相应的6个方框中。
课后检测2
(1)碳酸氢铵是一种化肥,厂家有下面使用说明:“本产品宜存贮于干燥阴冷处,防止受潮,避免曝晒或与碱性物质(如熟石灰)混合使用,以免变质,造成肥效损失。”根据上面叙述,归纳写出碳酸氢铵的化学性质。
①_____ ____________; ②__________ ________
不稳定,受热易分解
能与碱性物质反应
(2)某农民发现他种植的农作物叶片发黄,容易倒伏,于是他决定将碳酸氢铵与草木灰混合施用,以补充植物生长所缺乏的氮元素和钾元素。则该农民的判断是否正确?_____。该农民施用肥料的方法是否合理?
其理由是_______________________________________________。
正确
不合理。碳酸氢铵能与显碱性的草木灰反应,降低肥效
课后检测3
谢谢,再见!
盐的化学性质
初三化学下册复习课
学习目标
1、巩固物质分类及复分解反应的理解;
2、理解并掌握盐的化学性质,学习归纳方法;
3、通过习题训练,了解盐化学性质的应用。
1.Mg 2.H2SO4 3.FeSO4 4.NaOH 5. K2CO3
6.FeCO3 7. K2SO4 8. Na2SO4 9.MgSO4 10. Fe(OH)2
(2).上面物质属于盐的是 。
3、5、6、7、8、9
例1. 请阅读下列物质,完成后面问题
(1).请读出上述各物质的名称
1.Mg 2.H2SO4 3. FeSO4 4.NaOH 5.K2CO3
(3). 请把1-5共五种物质两两之间反应的化学方程式写出来。
Mg+ H2SO4 = MgSO4+H2 ↑
Mg + FeSO4 = MgSO4+ Fe
2NaOH+ H2SO4 = Na2SO4+2H2O
H2SO4+ K2CO3 = K2SO4+H2O+CO2↑
2NaOH+ FeSO4 = Fe (OH)2↓+Na2SO4
FeSO4+ K2CO3 = FeCO3↓ +K2SO4
6个
例1. 请阅读下列物质,完成后面问题
金属
新盐+新金属
(置换反应)
酸
新盐+新酸
(复分解反应)
新盐+新碱
(复分解反应)
盐
新盐+新盐
(复分解反应)
碱
盐的化学性质一:盐+金属---新盐+新金属
① CuSO4 + Fe = Cu + FeSO4
②2AgNO3 + Cu = 2Ag + Cu(NO3)2
③ 不反应
④不反应
归纳:金属+盐(溶液)-新盐+新金属(活动性:金属>新金属)
金属活动顺序表:
K Ca Na Mg Al Zn Fe Sn Pb(H)Cu Hg Ag Pt Au
金属活动性逐渐减弱
盐的化学性质二:盐+酸---新盐+新酸
(1) CaCO3 (难溶) +HNO3 —
(2) Na2CO3 +HCl —
(3) NaNO3 +H2SO4—
(4) AgCl (难溶) +HNO3 —
(5) BaCl2 +H2SO4 —
(6) BaSO4 (难溶) +HNO3 —
例3、判断下列反应能否在水中发生:
归纳:盐+酸--新盐+新酸(产物有气体或沉淀或水生成)
盐的化学性质三:盐+碱---新盐+新碱
(1)KNO3 +NaOH –
(2)BaCO3 (难溶) +NaOH –
(3)FeCl3 +Ca(OH)2 –
(4)Na2CO3 +Ca(OH)2 –
(5)Na2CO3 +Cu(OH)2 (难溶) –
例4、判断下列反应能否在水中发生:
(1)不反应
(2)不反应
(3)2FeCl3+3Ca(OH)2=2Fe(OH)3 ↓+3CaCl 2
(4) Na2CO3+Ca(OH)2=2NaOH +CaCO3 ↓
(5)不反应
归纳:盐(溶液)+碱(溶液)---新盐+新碱(产物有沉淀生成)
盐的化学性质四:盐+盐---新盐+新盐
(1)AgNO3 + NaCl —
(2)BaSO4(难溶) +Na2CO3—
(3)BaCl2 + Na2CO3—
(4)KNO3 + NaCl —
例5、判断下列反应能否在水中发生:
(1)AgNO3+NaCl = AgCl↓+NaNO3
(2)不反应
(3)BaCl2+Na2CO3=BaCO3↓+2NaCl
(4)不反应
归纳:盐(溶液)+碱(溶液)--新盐+新盐(产物有沉淀生成)
盐的主要化学性质
(可溶)
(可溶)
(可溶)
(可溶)
(可溶)
(至少有一种沉淀)
(至少有一种沉淀)
归纳小结
(有沉淀或气体或沉淀生成)
(活动性:金属>新金属)
2.一次性区别氯化钠、氯化钡、碳酸钾三种物质的溶液,
应选用( )
A.硝酸银溶液??B.稀硫酸 C.稀盐酸?? D.石灰水
B
练习1-2(盐化学性质应用:物质鉴别)
1.将珍珠放入稀盐酸中,有气泡产生,生成的气体能使澄
清的石灰水变浑浊,则珍珠中含有下列离子中的( )
A、氯离子 B、硫酸根离子
C、碳酸根离子 D、氢氧根离子
C
3. 用Mg、MgO、Mg(OH)2、H2SO4溶液、CuSO4溶液五种
物质两两进行反应,能得到MgSO4的方法有( )
A.3种 B.4种 C.5种 D.无法确定
B
盐
酸+碱
金属+酸
金属+盐
酸+盐
盐+碱
盐+盐
金属氧化物+酸
非金属氧化物+碱
√
√
√
√
练习3(盐化学性质应用:物质制备)
4.下列物质的转变,不能通过一步反应实现的是( )
A.K2SO4→KOH????????? ? B.CO2→CaCO3
C.Cu(NO3)2→CuCl2? D.FeCl3→Fe(OH)3
C
5.下列各组物质能同时存在于同一溶液中的是( )
A.AgNO3、NaCl、KNO3 B.CuSO4、KNO3、Na2CO3
C.NaOH、KCl、Fe(NO3)3 D.KCl、NaOH、Na2CO3
D
练习4-5(盐化学性质应用:物质转化与共存)
6.从Ba(OH)2、Na2SO4、稀HCl、BaCl2四种溶液中,选择适当的物质填入下图方框中。
练习6(盐化学性质应用:物质推断)
7.除去下列物质中的杂质(括号中为杂质),应选什么试剂?
①NaCl[Na2CO3]
②KNO3[KCl]
③CaCl2[NH4Cl]
④NaCl[MgSO4]
HCl
AgNO3
Ca(OH)2
Ba(OH)2
KCl+AgNO3=AgCl↓+KNO3
2NH4Cl+Ca(OH)2=CaCl2+2NH3↑+2H2O
MgSO4+Ba(OH)2=BaSO4↓+Mg(OH)2↓
2HCl+Na2CO3=2NaCl+CO2↑+H2O
练习7(盐化学性质应用:除杂质)
1、酸碱盐的分类;
归纳小结:
2、盐的主要化学性质;
3、盐的化学性质的不同应用;
作业:
1、阅读第十一单元教材;
2、完成学案课后检测试题。
某医院来了一急救病人。
病因:昨天晚上该病人感觉胃部不适、反酸,于是他
服用了一种主要成分为NaHCO3胃药。
病症:胃出血
既往病史:患有胃溃疡。
如果你是该病人的主治医师,请你分析出该病人胃出血的原因:
_______ _________________ _______________;
写出化学方程式:________________________
NaHCO3与胃酸反应生成CO2,在溃疡处造成胃穿孔而出血
NaHCO3+HCl=NaCl+H2O+CO2↑
课后检测1
2.现有H2SO4、BaCl2、 NaOH 、 Na2CO3 、 Ca(OH)2五种
物质的溶液和CO2一种气体,如图11-15所示的相互反应关系,
图中每条线表示两端的物质可以发生化学反应。请将它们的
化学式填入图中相应的6个方框中。
课后检测2
(1)碳酸氢铵是一种化肥,厂家有下面使用说明:“本产品宜存贮于干燥阴冷处,防止受潮,避免曝晒或与碱性物质(如熟石灰)混合使用,以免变质,造成肥效损失。”根据上面叙述,归纳写出碳酸氢铵的化学性质。
①_____ ____________; ②__________ ________
不稳定,受热易分解
能与碱性物质反应
(2)某农民发现他种植的农作物叶片发黄,容易倒伏,于是他决定将碳酸氢铵与草木灰混合施用,以补充植物生长所缺乏的氮元素和钾元素。则该农民的判断是否正确?_____。该农民施用肥料的方法是否合理?
其理由是_______________________________________________。
正确
不合理。碳酸氢铵能与显碱性的草木灰反应,降低肥效
课后检测3
谢谢,再见!
同课章节目录
- 第七单元 常见的酸和碱
- 第一节 酸及其性质
- 第二节 碱及其性质
- 第三节 溶液的酸碱性
- 第四节 酸碱中和反应
- 到实验室去:探究酸和碱的化学性质
- 第八单元 海水中的化学
- 第一节 海洋化学资源
- 第二节 海水“晒盐“
- 第三节 海水“制碱“
- 到实验室去:粗盐中难溶性杂质的去除
- 第九单元 金属
- 第一节 常见的金属材料
- 第二节 金属的化学性质
- 第三节 钢铁的锈蚀与防护
- 到实验室去 探究金属的性质
- 第十单元 化学与健康
- 第一节 食物中的有机物
- 第二节 化学元素与人体健康
- 第三节 远离有毒物质
- 第十一单元 化学与社会发展
- 第一节 化学与能源开发
- 第二节 化学与材料研制
- 第三节 化学与农业生产
- 第四节 化学与环境保护
