第八单元 课题3金属资源的利用和保护 同步练习(解析版)
文档属性
| 名称 | 第八单元 课题3金属资源的利用和保护 同步练习(解析版) |  | |
| 格式 | zip | ||
| 文件大小 | 106.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-03-05 16:13:45 | ||
图片预览




文档简介
课题3金属资源的利用和保护 同步练习(解析版)
1.铁在潮湿的空气里会发生锈蚀,证明氧气一定参加了反应必须要做的实验是
A.①② B.①③ C.②③ D.①②③
2.下列关于金属资源保护的做法,正确的是( )
A.及时回收废旧金属
B.禁止开采金属矿物
C.禁止使用金属材料
D.大力寻找并开采金属矿物
3.在金属表面覆盖保护膜是普遍采用的金属防锈措施之一。下列自行车的防锈措施中,不属于覆盖保护膜的是
A.擦拭保持洁净与干燥 B.链条上油
C.轮圈镀铬 D.车架喷漆
4.某学习小组用相同的洁净无锈的铁钉对铁制品锈蚀的条件进行探究,设计的实验如图所示,一周后观察。下列说法错误的是
A.①和②中的铁钉无明显变化,③中的铁钉明显生锈
B.②中加入的蒸馏水要事先煮沸,目的是除去水中溶解的氧气
C.③中铁钉的甲、乙、丙三处,甲处锈蚀最严重
D.探究发现铁生锈的主要条件是铁与空气和水(水蒸气)直接接触
5.某博物馆藏有一柄古代铁剑,为防止其生锈,下列做法合理的是
A.定期用清水冲洗,除去灰尘 B.放于体验区,让观众触摸
C.用盐水除去铁剑上的锈斑 D.放在充满氮气的展览柜中
6.下列说法正确的是( )
A.铝是人类最早利用的金属材料
B.铜是目前世界年产量最高的金属
C.大多数金属元素在自然界中以单质形式存在
D.日常使用的金属材料大多数是合金
7.下列有关金属材料的说法正确的是( )
A.硬铝片比纯铝片硬度小 B.钢的性能优良,是很纯的铁
C.沙漠地区的铁制品锈蚀较快 D.为防止钢铁生锈,可在其表面涂油漆
8.下列关于铁的说法,正确的是( )
A.用水可以除去铁锈 B.铁在潮湿空气中容易生锈
C.铁生锈不是缓慢氧化 D.铁部分锈蚀后没有回收价值
9.在一定条件下,一氧化碳、木炭都能与氧化铜发生反应,下列叙述正确的是
A.反应产生的气体都有毒 B.反应中都有红色固体生成
C.反应类型都是置换反应 D.反应的生成物不同
10.下图是“一氧化碳与氧化铁反应”的部分实验装置,关于该实验说法正确的是
A.充分反应后,向固体中加稀盐酸会产生气泡
B.在实验过程中,黑色的粉末会逐渐变成红色
C.该实验的反应原理为FeO+ COFe+ CO2
D.在实验过程中,产生的尾气可以直接排放到空气中
11.人们常说的“五金”是指:金、银、铜、铁、锡。根据所学知识回答:
(1)“真金不怕火炼”说明金即使在高温下也不与________反应。
(2)黄铜片(铜锌合金)和铜片相互刻画,在铜片上留下刻痕,说明黄铜片的硬度比铜片的硬度______(填“大” 或“小”)。
(3)铁制容器不能用来盛放农药波尔多液(主要成分是硫酸铜和氢氧化钙),用化学方程式表示其原因:____________________。
(4)防止金属腐蚀是保护金属资源的有效途经之一,写出一种防止铁制品生锈的具体方法:______ 。
12.) 钢铁是使用最多的金属材料。
⑴早在春秋战国时期,我国就开始生产和使用铁器。写出以赤铁矿(主要成分Fe2O3)为原料炼铁的化学方程式__________________________。
⑵利用新技术能将不锈钢加工成柔软的金属丝,用它和棉纤维一起编织成性能优良的劳保防护服,这是利用了不锈钢的________(填序号)。
A 耐腐蚀性 B 延展性 C 导热性 D 导电性
⑶市场上有一种含铁粉的麦片,食用后在胃酸作用下将铁粉转化为人体可吸收的铁元素,反应的化学方程式为________________________。这种麦片必须真空保存,原因是____________________________________________________。
(4)为探究铁和锌两种金属与酸反应的状况,将等质量的两种金属分别与等质量的溶质质量分数相同的稀硫酸反应,产生氢气的质量与反应时间的函数关系如图所示。下列相关判断中,正确的是_______
A 甲是铁,乙是锌
B 甲是锌,乙是铁
C 图1表示稀硫酸足量,图2表示稀硫酸不足量
D 图1表示金属一定有剩余,图2表示金属一定没有剩余
13.说出两种防止家中厨房里菜刀或者铁锅生锈的方法。______________
14.请列举保护金属资源的有效途径三条. ________________________
15.在研究“铁生锈的条件”的实验中,某兴趣小组对实验进行了创新设计,请把实验报告补充完整。
(实验目的)铁生锈条件的探究。
(实验内容)取3段光亮无锈的细铁丝,绕成螺旋状,放入3支干燥洁净的试管底部,进行下列实验,实验要保证有足够长的时间来观察现象。
(实验现象)实验①②无明显现象;实验③中铁丝生锈,且试管内空气体积减小。
(实验结论)铁生锈实际上是铁与空气中的________、________(填名称)发生反应的结果。
(实验思考)(1)当铁丝足量,时间足够长,实验③进入试管内的水的体积约占试管体积的________。
(2)该实验创新之处在于:可根据铁丝表面的铁锈和__________________________两种现象来判断铁丝反应进行的情况。
(3)用完的菜刀要擦干存放,理由是____________________。
(4)铝比铁活泼,但铝难腐蚀,原因是_______________________。
16.在研究“铁生锈的条件”的实验中,某兴趣小组对实验进行了创新设计,请把实验报告补充完整。取3段光亮无锈的细铁丝,绕成螺旋状,放入3支干燥洁净的试管底部,进行下列实验,实验要保证有足够长的时间来观察现象。实验①②无明显现象,实验③中铁丝生锈,且试管内空气体积减小。铁生锈实际上是铁与空气中的__________________________(填名称)发生反应的结果.
(1)当铁丝足量,时间足够长,实验③进入试管内的水的体积约占试管容积的__________________________
(2)该实验创新之处在于:可根据铁丝表面的铁锈和_____________两种现象来判断铁丝反应进行的情况.
(3)铝比铁活泼,但铝难腐蚀,原因是_______________________________________
(4)金属资源储量有限且不能再生,为了保护金属资源,除防止金属的腐蚀外,你还有什么合理的建议_________________________________________________________________(答一点即可)
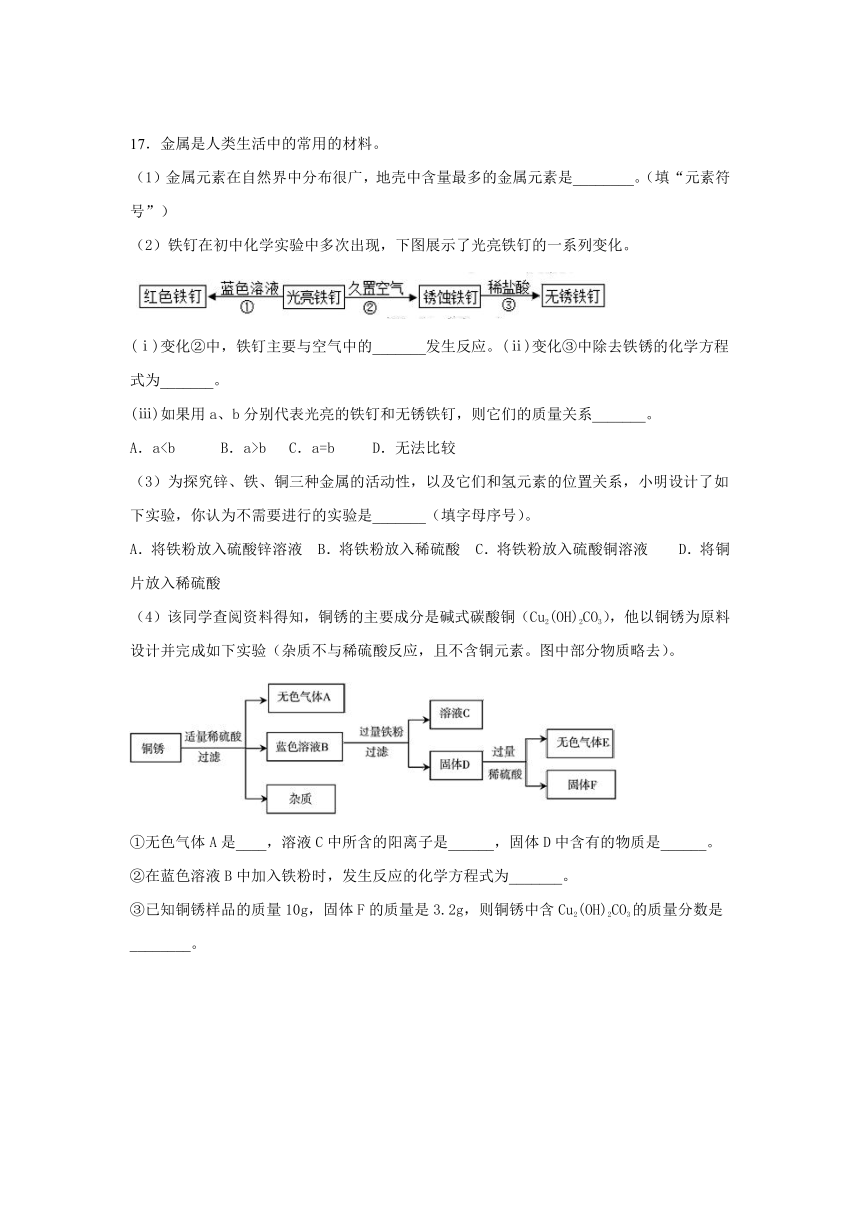
17.金属是人类生活中的常用的材料。
(1)金属元素在自然界中分布很广,地壳中含量最多的金属元素是________。(填“元素符号”)
(2)铁钉在初中化学实验中多次出现,下图展示了光亮铁钉的一系列变化。
(ⅰ)变化②中,铁钉主要与空气中的_______发生反应。(ⅱ)变化③中除去铁锈的化学方程式为_______。
(ⅲ)如果用a、b分别代表光亮的铁钉和无锈铁钉,则它们的质量关系_______。
A.ab C.a=b D.无法比较
(3)为探究锌、铁、铜三种金属的活动性,以及它们和氢元素的位置关系,小明设计了如下实验,你认为不需要进行的实验是_______(填字母序号)。
A.将铁粉放入硫酸锌溶液 B.将铁粉放入稀硫酸 C.将铁粉放入硫酸铜溶液 D.将铜片放入稀硫酸
(4)该同学查阅资料得知,铜锈的主要成分是碱式碳酸铜(Cu2(OH)2CO3),他以铜锈为原料设计并完成如下实验(杂质不与稀硫酸反应,且不含铜元素。图中部分物质略去)。
①无色气体A是____,溶液C中所含的阳离子是______,固体D中含有的物质是______。
②在蓝色溶液B中加入铁粉时,发生反应的化学方程式为_______。
③已知铜锈样品的质量10g,固体F的质量是3.2g,则铜锈中含Cu2(OH)2CO3的质量分数是________。
参考答案
1.A
【解析】
铁生锈的条件是与水和氧气直接接触,要想证明铁生锈时,氧气一定参加了反应,就要进行铁在氧气和水共同作用下的反应实验和铁在只有水,没有氧气下的实验。
【详解】
实验①是铁在氧气和水共同作用下的反应,实验②是铁只与水接触的反应,实验③是铁只与氧气接触的反应。要想证明铁生锈时,氧气一定参加了反应,就要进行铁在氧气和水共同作用下的反应实验和铁在只有水,没有氧气下的实验,及控制变量氧气,其它量相同,所以选①②。故选A。
2.A
【解析】
A、废旧金属回收,能节约金属资源,有利于保护金属资源;废旧金属回收成本不高,还有利于保护金属资源,故正确;
B、应禁止开采金属矿物,是不切合实际的,故错误;
C、严禁使用金属材料,是不切合实际的,故错误;
D、合理开采矿物,否则既浪费了资源,又损害了国家利益,故错误。
故选A。
3.A
【解析】
试题分析:擦拭保持洁净与干燥是除去金属表面的水,不属于覆盖保护膜。选A
考点:金属的防锈。
4.C
【解析】
试题分析:铁生锈的条件是铁与水、氧气同时接触。故试管3满足了铁生锈的条件,3中的铁钉会生锈,且乙处生锈最严重。故选C。
考点:铁生锈的条件的探究
5.D
【解析】
A.定期不应用清水冲洗,除去灰尘。故A错误。 B.不应放于体验区,更不要让观众触摸。故B错误。 C.用盐酸除去铁剑上的锈斑。故C错误。 D.放在充满氮气的展览柜中,氮气性质稳定。故D正确。故选D。
6.D
【解析】
人类最早利用的金属材料是铜;铁丝目前世界年产量最高的金属;少数金属元素如金、银在自然界中以单质形式存在,大多数以化合物的形式存在。
7.D
【解析】
试题分析:根据所学知识可知,A.硬铝片比纯铝片硬度大;B.钢的性能优良,是铁的合金;C.沙漠地区的铁制品锈蚀较慢,因为空气干燥;D.为防止钢铁生锈,可在其表面涂油,是正确的叙述,这样可以隔绝氧气;故答案选择D
考点:金属材料、金属的防护
8.B
【解析】
A.铁锈的主要成分是氧化铁,不溶于水,也不与水反应,故不能用水来除铁锈,错误;
B.在潮湿的空气中,铁与氧气、水同时接触,容易生锈,正确;
C.铁生锈是铁与氧气发生的缓慢氧化反应,错误;
D.铁生锈后可回收重新利用,错误。
9.B
【解析】
A、一氧化碳和木炭都能和氧化铜反应生成铜和二氧化碳,生成的气体是二氧化碳,二氧化碳无毒,A说法不正确;
B、木炭、一氧化碳有还原性,能将氧化铜还原为铜.所以,反应现象中都有试管内黑色粉末变成红色.故B正确;
C、一氧化碳和氧化铜反应生成铜和二氧化碳,反应物是两种化合物,所以该反应不属于置换反应,碳和氧化铜反应生成铜和二氧化碳,是一种单质和一种化合物生成另一种单质和另一种化合物属置换反应,C说法不正确;
D、一氧化碳和氧化铜反应生成铜和二氧化碳,碳和氧化铜反应生成铜和二氧化碳,生成物相同,D说法不正确;
故答案选B.
10.A
【解析】
一氧化碳与氧化铁反应生成铁和二氧化碳,反应的化学方程式为3CO+Fe2O32Fe+3CO2。
【详解】
A、生成的Fe能与盐酸反应生成氢气,有气泡,故A正确;
B、反应中红色的氧化铁变为黑色的铁,故B不正确;
C、不符合客观事实,故C不正确;
D、产生的尾气中含量未反应完的CO,有毒,需要进行尾气处理,故D不正确。故选A。
11.氧气 大 Fe+CuSO4═Cu+FeSO4 刷漆等
【解析】
(1)“真金不怕火炼”说明了金的性质很不活泼,金即使在高温下也不与氧气反应; (2)黄铜片(铜锌合金)和铜片相互刻画,在铜片上留下刻痕,说明黄铜片的硬度比铜片的硬度大; (3)铁制容器不能用来盛放农药波尔多液(主要成分是硫酸铜和氢氧化钙),原因是铁的活动性大于铜,用化学方程式表示其原因是:Fe+CuSO4═Cu+FeSO4; (4)防止铁制品生锈的方法有很多,例如:刷漆、涂油等。
12.3CO+Fe2O3 2Fe+3CO2 A、B Fe+2HCl=FeCl2+H2↑ 与空气中的氧气和水接触生锈而变质 A 、C
【解析】
(1)以赤铁矿(主要成分Fe2O3)为原料炼铁发生的反应是氧化铁与一氧化碳在高温条件下反应生成铁和二氧化碳,反应的化学方程式为3CO+Fe2O32Fe+3CO2;
(2)将不锈钢加工成柔软的金属丝,这是利用了不锈钢的耐腐蚀性和延展性,故选A、B;
(3)含铁粉的麦片在胃酸作用下将铁粉转化为人体可吸收的铁元素,反应的化学方程式为Fe+2HCl=FeCl2+H2↑。这种麦片必须真空保存,原因是其中的铁会与空气中的氧气和水接触生锈而变质;
(4)A、锌比铁活泼,和稀硫酸反应速率较快,反应需要时间短,最终铁和稀硫酸反应生成的氢气多,因此甲是铁,乙是锌,故A正确;
B、根据A选项分析可知,甲是铁,乙是锌,故B错误;
C、图?1?中金属锌与稀硫酸充分反应后,稀硫酸可能还有剩余(稀硫酸过量时),也可能没有剩余(锌和稀硫酸恰好完全反应),图1表示稀硫酸足量;图2中产生的氢气质量相等,表示稀硫酸不足量,金属足量,故C正确;
D、图?2中最终生成氢气质量相等,说明稀硫酸完全反应,铁一定有剩余,故D错误。故选AC。
13.不用时保持菜刀(或铁锅)的干燥或在菜刀(或铁锅)上涂一层植物油
【解析】
铁制品与氧气、水蒸气接触发生缓慢氧化而生锈,防止生锈就是要使铁制品与水、氧气隔绝。
【详解】
根据铁生锈的条件,破坏生锈的条件就可防止铁制品生锈。因此防止厨房里菜刀或者铁锅生锈的方法有:不用时保持菜刀(或铁锅)的干燥或在菜刀(或铁锅)上涂一层植物油。
14.防止金属锈蚀;回收利用废旧金属;寻找金属的代用品(或合理开采矿物等)
【解析】
根据金属资源保护的措施进行分析。
【详解】
保护金属资源的有效途径有:防止金属锈蚀、回收利用废旧金属、寻找金属的代用品、合理开采矿物等。任写三条即可。
15.氧气 水蒸气 试管内液面高度上升 除去水,防止生锈 铝易生成致密的氧化物薄膜,阻止铝进一步被氧化
【解析】
[实验结论]由实验③可知,铁与氧气和水充分接触时容易生锈;
[实验思考](1)因为氧气约占空气总体积的五分之一,当试管中的氧气被消耗完后,进入试管内的水的体积约占试管体积的五分之一;
(2)该实验创新之处在于:可根据铁丝表面的铁锈和试管内液面高度上升两种现象来判断铁丝反应进行的情况;
(3)在干燥的环境中可以防止菜刀生锈,故填:除去水,防止生锈;
(4)铝比铁活泼,但铝难腐蚀,原因是铝易与空气中的氧气反应生成一层致密的氧化物保护膜,阻止铝进一步反应。
【点睛】
解答本题要掌握铁生锈的条件,只有掌握了铁生锈的条件才能找出防止铁生锈的方法。
16.【实验结论】氧气和水蒸气
【实验思考】(1)1/5(21%)(2)试管内空气体积减小(或试管内液面上升)
(3)易生成一层致密的氧化物保护膜,阻止铝不再被氧化
(4)回收利用(有计划合理地开采矿物;废旧金属的回收利用;寻找金属的替代品等合理答案均可)
【解析】
试题分析:铁生锈实际上是铁与空气中的氧气和水分发生反应的结果.当铁丝足量,时间足够长,实验③进入试管内的水的体积约占试管容积的五分之一;该实验创新之处在于:可根据铁丝表面的铁锈和液面上升两种现象来判断铁丝反应进行的情况.铝比铁活泼,但铝难腐蚀,原因是铝在空气中与氧气反应,其表面生成一层致密的氧化铝薄膜,从而阻止铝进一步氧化;金属资源储量有限且不能再生,为了保护金属资源,除防止金属的腐蚀外,还有:废旧金属回收利用或有计划合理地开采矿物或寻找金属代用品。
考点:铁生锈的条件金属资源的保护
17.Al 水和氧气 6HCl+Fe2O3=2FeCl3+3H2O B C 二氧化碳 Fe2+ 铁、铜 Fe+CuSO4=Cu+FeSO4 55.5%
【解析】
(1)地壳中元素的含量用质量分数表达,由多到少的顺序是氧、硅、铝、铁、钙、……。含量最多的金属元素是铝;(2)铁生锈是铁与氧气、水共同作用的结果;铁锈的主要成分是氧化铁,与盐酸反应生成氯化铁和水,反应方程式为:Fe2O3+6HCl=2FeCl3+3H2O;据质量守恒定律可知反应前后物质的总质量不变,所以铁锈的质量等于反应前铁的质量与反应的氧气、水的质量和,所以锈蚀后的铁钉的质量大于原铁钉的质量;(3)金属活动顺序表:K Ca Na Mg Al Zn Fe Sn Pb H Cu Hg Ag Pt Au,在金属活动顺序表中,排在氢前边的金属能和酸发生置换反应生成盐和氢气。金属的位置越靠前,金属的活动性越强。位置靠前的金属能将位于其后的金属从它的盐溶液中置换出来。A.将铁粉放入硫酸锌溶液中,不反应,证明铁在锌后; B.将铁粉放入稀硫酸中,发生反应生成氢气,证明铁在氢前;C.将铁粉放入硫酸铜溶液中,发生反应,溶液由蓝色变成绿色,铁的表面有红色固体析出,证明铁在铜前; D.将铜片放入稀硫酸中,不反应证明铜在氢后,由ABD三组实验即可证明锌>铁>氢>铜,所以C实验不需要进行;(4)碱式碳酸铜和盐酸反应生成氯化铜、水、二氧化碳,氯化铜溶液是蓝色的,所以①A为二氧化碳,B为氯化铜;铁和氯化铜反应生成铜和氯化亚铁,所以溶液C中一定有亚铁离子;固体D中含有的物质是铜;②在氯化铜溶液中加入铁粉时,发生反应的化学方程式为Fe+ CuCl2== FeCl2 + Cu ③ 设Cu2(OH)2CO3的质量分数为X,固体F是铜,即生成的铜的质量是3.2g,10g×X×(128÷228×100%)=3.2g,X=55.5%.
1.铁在潮湿的空气里会发生锈蚀,证明氧气一定参加了反应必须要做的实验是
A.①② B.①③ C.②③ D.①②③
2.下列关于金属资源保护的做法,正确的是( )
A.及时回收废旧金属
B.禁止开采金属矿物
C.禁止使用金属材料
D.大力寻找并开采金属矿物
3.在金属表面覆盖保护膜是普遍采用的金属防锈措施之一。下列自行车的防锈措施中,不属于覆盖保护膜的是
A.擦拭保持洁净与干燥 B.链条上油
C.轮圈镀铬 D.车架喷漆
4.某学习小组用相同的洁净无锈的铁钉对铁制品锈蚀的条件进行探究,设计的实验如图所示,一周后观察。下列说法错误的是
A.①和②中的铁钉无明显变化,③中的铁钉明显生锈
B.②中加入的蒸馏水要事先煮沸,目的是除去水中溶解的氧气
C.③中铁钉的甲、乙、丙三处,甲处锈蚀最严重
D.探究发现铁生锈的主要条件是铁与空气和水(水蒸气)直接接触
5.某博物馆藏有一柄古代铁剑,为防止其生锈,下列做法合理的是
A.定期用清水冲洗,除去灰尘 B.放于体验区,让观众触摸
C.用盐水除去铁剑上的锈斑 D.放在充满氮气的展览柜中
6.下列说法正确的是( )
A.铝是人类最早利用的金属材料
B.铜是目前世界年产量最高的金属
C.大多数金属元素在自然界中以单质形式存在
D.日常使用的金属材料大多数是合金
7.下列有关金属材料的说法正确的是( )
A.硬铝片比纯铝片硬度小 B.钢的性能优良,是很纯的铁
C.沙漠地区的铁制品锈蚀较快 D.为防止钢铁生锈,可在其表面涂油漆
8.下列关于铁的说法,正确的是( )
A.用水可以除去铁锈 B.铁在潮湿空气中容易生锈
C.铁生锈不是缓慢氧化 D.铁部分锈蚀后没有回收价值
9.在一定条件下,一氧化碳、木炭都能与氧化铜发生反应,下列叙述正确的是
A.反应产生的气体都有毒 B.反应中都有红色固体生成
C.反应类型都是置换反应 D.反应的生成物不同
10.下图是“一氧化碳与氧化铁反应”的部分实验装置,关于该实验说法正确的是
A.充分反应后,向固体中加稀盐酸会产生气泡
B.在实验过程中,黑色的粉末会逐渐变成红色
C.该实验的反应原理为FeO+ COFe+ CO2
D.在实验过程中,产生的尾气可以直接排放到空气中
11.人们常说的“五金”是指:金、银、铜、铁、锡。根据所学知识回答:
(1)“真金不怕火炼”说明金即使在高温下也不与________反应。
(2)黄铜片(铜锌合金)和铜片相互刻画,在铜片上留下刻痕,说明黄铜片的硬度比铜片的硬度______(填“大” 或“小”)。
(3)铁制容器不能用来盛放农药波尔多液(主要成分是硫酸铜和氢氧化钙),用化学方程式表示其原因:____________________。
(4)防止金属腐蚀是保护金属资源的有效途经之一,写出一种防止铁制品生锈的具体方法:______ 。
12.) 钢铁是使用最多的金属材料。
⑴早在春秋战国时期,我国就开始生产和使用铁器。写出以赤铁矿(主要成分Fe2O3)为原料炼铁的化学方程式__________________________。
⑵利用新技术能将不锈钢加工成柔软的金属丝,用它和棉纤维一起编织成性能优良的劳保防护服,这是利用了不锈钢的________(填序号)。
A 耐腐蚀性 B 延展性 C 导热性 D 导电性
⑶市场上有一种含铁粉的麦片,食用后在胃酸作用下将铁粉转化为人体可吸收的铁元素,反应的化学方程式为________________________。这种麦片必须真空保存,原因是____________________________________________________。
(4)为探究铁和锌两种金属与酸反应的状况,将等质量的两种金属分别与等质量的溶质质量分数相同的稀硫酸反应,产生氢气的质量与反应时间的函数关系如图所示。下列相关判断中,正确的是_______
A 甲是铁,乙是锌
B 甲是锌,乙是铁
C 图1表示稀硫酸足量,图2表示稀硫酸不足量
D 图1表示金属一定有剩余,图2表示金属一定没有剩余
13.说出两种防止家中厨房里菜刀或者铁锅生锈的方法。______________
14.请列举保护金属资源的有效途径三条. ________________________
15.在研究“铁生锈的条件”的实验中,某兴趣小组对实验进行了创新设计,请把实验报告补充完整。
(实验目的)铁生锈条件的探究。
(实验内容)取3段光亮无锈的细铁丝,绕成螺旋状,放入3支干燥洁净的试管底部,进行下列实验,实验要保证有足够长的时间来观察现象。
(实验现象)实验①②无明显现象;实验③中铁丝生锈,且试管内空气体积减小。
(实验结论)铁生锈实际上是铁与空气中的________、________(填名称)发生反应的结果。
(实验思考)(1)当铁丝足量,时间足够长,实验③进入试管内的水的体积约占试管体积的________。
(2)该实验创新之处在于:可根据铁丝表面的铁锈和__________________________两种现象来判断铁丝反应进行的情况。
(3)用完的菜刀要擦干存放,理由是____________________。
(4)铝比铁活泼,但铝难腐蚀,原因是_______________________。
16.在研究“铁生锈的条件”的实验中,某兴趣小组对实验进行了创新设计,请把实验报告补充完整。取3段光亮无锈的细铁丝,绕成螺旋状,放入3支干燥洁净的试管底部,进行下列实验,实验要保证有足够长的时间来观察现象。实验①②无明显现象,实验③中铁丝生锈,且试管内空气体积减小。铁生锈实际上是铁与空气中的__________________________(填名称)发生反应的结果.
(1)当铁丝足量,时间足够长,实验③进入试管内的水的体积约占试管容积的__________________________
(2)该实验创新之处在于:可根据铁丝表面的铁锈和_____________两种现象来判断铁丝反应进行的情况.
(3)铝比铁活泼,但铝难腐蚀,原因是_______________________________________
(4)金属资源储量有限且不能再生,为了保护金属资源,除防止金属的腐蚀外,你还有什么合理的建议_________________________________________________________________(答一点即可)
17.金属是人类生活中的常用的材料。
(1)金属元素在自然界中分布很广,地壳中含量最多的金属元素是________。(填“元素符号”)
(2)铁钉在初中化学实验中多次出现,下图展示了光亮铁钉的一系列变化。
(ⅰ)变化②中,铁钉主要与空气中的_______发生反应。(ⅱ)变化③中除去铁锈的化学方程式为_______。
(ⅲ)如果用a、b分别代表光亮的铁钉和无锈铁钉,则它们的质量关系_______。
A.ab C.a=b D.无法比较
(3)为探究锌、铁、铜三种金属的活动性,以及它们和氢元素的位置关系,小明设计了如下实验,你认为不需要进行的实验是_______(填字母序号)。
A.将铁粉放入硫酸锌溶液 B.将铁粉放入稀硫酸 C.将铁粉放入硫酸铜溶液 D.将铜片放入稀硫酸
(4)该同学查阅资料得知,铜锈的主要成分是碱式碳酸铜(Cu2(OH)2CO3),他以铜锈为原料设计并完成如下实验(杂质不与稀硫酸反应,且不含铜元素。图中部分物质略去)。
①无色气体A是____,溶液C中所含的阳离子是______,固体D中含有的物质是______。
②在蓝色溶液B中加入铁粉时,发生反应的化学方程式为_______。
③已知铜锈样品的质量10g,固体F的质量是3.2g,则铜锈中含Cu2(OH)2CO3的质量分数是________。
参考答案
1.A
【解析】
铁生锈的条件是与水和氧气直接接触,要想证明铁生锈时,氧气一定参加了反应,就要进行铁在氧气和水共同作用下的反应实验和铁在只有水,没有氧气下的实验。
【详解】
实验①是铁在氧气和水共同作用下的反应,实验②是铁只与水接触的反应,实验③是铁只与氧气接触的反应。要想证明铁生锈时,氧气一定参加了反应,就要进行铁在氧气和水共同作用下的反应实验和铁在只有水,没有氧气下的实验,及控制变量氧气,其它量相同,所以选①②。故选A。
2.A
【解析】
A、废旧金属回收,能节约金属资源,有利于保护金属资源;废旧金属回收成本不高,还有利于保护金属资源,故正确;
B、应禁止开采金属矿物,是不切合实际的,故错误;
C、严禁使用金属材料,是不切合实际的,故错误;
D、合理开采矿物,否则既浪费了资源,又损害了国家利益,故错误。
故选A。
3.A
【解析】
试题分析:擦拭保持洁净与干燥是除去金属表面的水,不属于覆盖保护膜。选A
考点:金属的防锈。
4.C
【解析】
试题分析:铁生锈的条件是铁与水、氧气同时接触。故试管3满足了铁生锈的条件,3中的铁钉会生锈,且乙处生锈最严重。故选C。
考点:铁生锈的条件的探究
5.D
【解析】
A.定期不应用清水冲洗,除去灰尘。故A错误。 B.不应放于体验区,更不要让观众触摸。故B错误。 C.用盐酸除去铁剑上的锈斑。故C错误。 D.放在充满氮气的展览柜中,氮气性质稳定。故D正确。故选D。
6.D
【解析】
人类最早利用的金属材料是铜;铁丝目前世界年产量最高的金属;少数金属元素如金、银在自然界中以单质形式存在,大多数以化合物的形式存在。
7.D
【解析】
试题分析:根据所学知识可知,A.硬铝片比纯铝片硬度大;B.钢的性能优良,是铁的合金;C.沙漠地区的铁制品锈蚀较慢,因为空气干燥;D.为防止钢铁生锈,可在其表面涂油,是正确的叙述,这样可以隔绝氧气;故答案选择D
考点:金属材料、金属的防护
8.B
【解析】
A.铁锈的主要成分是氧化铁,不溶于水,也不与水反应,故不能用水来除铁锈,错误;
B.在潮湿的空气中,铁与氧气、水同时接触,容易生锈,正确;
C.铁生锈是铁与氧气发生的缓慢氧化反应,错误;
D.铁生锈后可回收重新利用,错误。
9.B
【解析】
A、一氧化碳和木炭都能和氧化铜反应生成铜和二氧化碳,生成的气体是二氧化碳,二氧化碳无毒,A说法不正确;
B、木炭、一氧化碳有还原性,能将氧化铜还原为铜.所以,反应现象中都有试管内黑色粉末变成红色.故B正确;
C、一氧化碳和氧化铜反应生成铜和二氧化碳,反应物是两种化合物,所以该反应不属于置换反应,碳和氧化铜反应生成铜和二氧化碳,是一种单质和一种化合物生成另一种单质和另一种化合物属置换反应,C说法不正确;
D、一氧化碳和氧化铜反应生成铜和二氧化碳,碳和氧化铜反应生成铜和二氧化碳,生成物相同,D说法不正确;
故答案选B.
10.A
【解析】
一氧化碳与氧化铁反应生成铁和二氧化碳,反应的化学方程式为3CO+Fe2O32Fe+3CO2。
【详解】
A、生成的Fe能与盐酸反应生成氢气,有气泡,故A正确;
B、反应中红色的氧化铁变为黑色的铁,故B不正确;
C、不符合客观事实,故C不正确;
D、产生的尾气中含量未反应完的CO,有毒,需要进行尾气处理,故D不正确。故选A。
11.氧气 大 Fe+CuSO4═Cu+FeSO4 刷漆等
【解析】
(1)“真金不怕火炼”说明了金的性质很不活泼,金即使在高温下也不与氧气反应; (2)黄铜片(铜锌合金)和铜片相互刻画,在铜片上留下刻痕,说明黄铜片的硬度比铜片的硬度大; (3)铁制容器不能用来盛放农药波尔多液(主要成分是硫酸铜和氢氧化钙),原因是铁的活动性大于铜,用化学方程式表示其原因是:Fe+CuSO4═Cu+FeSO4; (4)防止铁制品生锈的方法有很多,例如:刷漆、涂油等。
12.3CO+Fe2O3 2Fe+3CO2 A、B Fe+2HCl=FeCl2+H2↑ 与空气中的氧气和水接触生锈而变质 A 、C
【解析】
(1)以赤铁矿(主要成分Fe2O3)为原料炼铁发生的反应是氧化铁与一氧化碳在高温条件下反应生成铁和二氧化碳,反应的化学方程式为3CO+Fe2O32Fe+3CO2;
(2)将不锈钢加工成柔软的金属丝,这是利用了不锈钢的耐腐蚀性和延展性,故选A、B;
(3)含铁粉的麦片在胃酸作用下将铁粉转化为人体可吸收的铁元素,反应的化学方程式为Fe+2HCl=FeCl2+H2↑。这种麦片必须真空保存,原因是其中的铁会与空气中的氧气和水接触生锈而变质;
(4)A、锌比铁活泼,和稀硫酸反应速率较快,反应需要时间短,最终铁和稀硫酸反应生成的氢气多,因此甲是铁,乙是锌,故A正确;
B、根据A选项分析可知,甲是铁,乙是锌,故B错误;
C、图?1?中金属锌与稀硫酸充分反应后,稀硫酸可能还有剩余(稀硫酸过量时),也可能没有剩余(锌和稀硫酸恰好完全反应),图1表示稀硫酸足量;图2中产生的氢气质量相等,表示稀硫酸不足量,金属足量,故C正确;
D、图?2中最终生成氢气质量相等,说明稀硫酸完全反应,铁一定有剩余,故D错误。故选AC。
13.不用时保持菜刀(或铁锅)的干燥或在菜刀(或铁锅)上涂一层植物油
【解析】
铁制品与氧气、水蒸气接触发生缓慢氧化而生锈,防止生锈就是要使铁制品与水、氧气隔绝。
【详解】
根据铁生锈的条件,破坏生锈的条件就可防止铁制品生锈。因此防止厨房里菜刀或者铁锅生锈的方法有:不用时保持菜刀(或铁锅)的干燥或在菜刀(或铁锅)上涂一层植物油。
14.防止金属锈蚀;回收利用废旧金属;寻找金属的代用品(或合理开采矿物等)
【解析】
根据金属资源保护的措施进行分析。
【详解】
保护金属资源的有效途径有:防止金属锈蚀、回收利用废旧金属、寻找金属的代用品、合理开采矿物等。任写三条即可。
15.氧气 水蒸气 试管内液面高度上升 除去水,防止生锈 铝易生成致密的氧化物薄膜,阻止铝进一步被氧化
【解析】
[实验结论]由实验③可知,铁与氧气和水充分接触时容易生锈;
[实验思考](1)因为氧气约占空气总体积的五分之一,当试管中的氧气被消耗完后,进入试管内的水的体积约占试管体积的五分之一;
(2)该实验创新之处在于:可根据铁丝表面的铁锈和试管内液面高度上升两种现象来判断铁丝反应进行的情况;
(3)在干燥的环境中可以防止菜刀生锈,故填:除去水,防止生锈;
(4)铝比铁活泼,但铝难腐蚀,原因是铝易与空气中的氧气反应生成一层致密的氧化物保护膜,阻止铝进一步反应。
【点睛】
解答本题要掌握铁生锈的条件,只有掌握了铁生锈的条件才能找出防止铁生锈的方法。
16.【实验结论】氧气和水蒸气
【实验思考】(1)1/5(21%)(2)试管内空气体积减小(或试管内液面上升)
(3)易生成一层致密的氧化物保护膜,阻止铝不再被氧化
(4)回收利用(有计划合理地开采矿物;废旧金属的回收利用;寻找金属的替代品等合理答案均可)
【解析】
试题分析:铁生锈实际上是铁与空气中的氧气和水分发生反应的结果.当铁丝足量,时间足够长,实验③进入试管内的水的体积约占试管容积的五分之一;该实验创新之处在于:可根据铁丝表面的铁锈和液面上升两种现象来判断铁丝反应进行的情况.铝比铁活泼,但铝难腐蚀,原因是铝在空气中与氧气反应,其表面生成一层致密的氧化铝薄膜,从而阻止铝进一步氧化;金属资源储量有限且不能再生,为了保护金属资源,除防止金属的腐蚀外,还有:废旧金属回收利用或有计划合理地开采矿物或寻找金属代用品。
考点:铁生锈的条件金属资源的保护
17.Al 水和氧气 6HCl+Fe2O3=2FeCl3+3H2O B C 二氧化碳 Fe2+ 铁、铜 Fe+CuSO4=Cu+FeSO4 55.5%
【解析】
(1)地壳中元素的含量用质量分数表达,由多到少的顺序是氧、硅、铝、铁、钙、……。含量最多的金属元素是铝;(2)铁生锈是铁与氧气、水共同作用的结果;铁锈的主要成分是氧化铁,与盐酸反应生成氯化铁和水,反应方程式为:Fe2O3+6HCl=2FeCl3+3H2O;据质量守恒定律可知反应前后物质的总质量不变,所以铁锈的质量等于反应前铁的质量与反应的氧气、水的质量和,所以锈蚀后的铁钉的质量大于原铁钉的质量;(3)金属活动顺序表:K Ca Na Mg Al Zn Fe Sn Pb H Cu Hg Ag Pt Au,在金属活动顺序表中,排在氢前边的金属能和酸发生置换反应生成盐和氢气。金属的位置越靠前,金属的活动性越强。位置靠前的金属能将位于其后的金属从它的盐溶液中置换出来。A.将铁粉放入硫酸锌溶液中,不反应,证明铁在锌后; B.将铁粉放入稀硫酸中,发生反应生成氢气,证明铁在氢前;C.将铁粉放入硫酸铜溶液中,发生反应,溶液由蓝色变成绿色,铁的表面有红色固体析出,证明铁在铜前; D.将铜片放入稀硫酸中,不反应证明铜在氢后,由ABD三组实验即可证明锌>铁>氢>铜,所以C实验不需要进行;(4)碱式碳酸铜和盐酸反应生成氯化铜、水、二氧化碳,氯化铜溶液是蓝色的,所以①A为二氧化碳,B为氯化铜;铁和氯化铜反应生成铜和氯化亚铁,所以溶液C中一定有亚铁离子;固体D中含有的物质是铜;②在氯化铜溶液中加入铁粉时,发生反应的化学方程式为Fe+ CuCl2== FeCl2 + Cu ③ 设Cu2(OH)2CO3的质量分数为X,固体F是铜,即生成的铜的质量是3.2g,10g×X×(128÷228×100%)=3.2g,X=55.5%.
同课章节目录
