人教版化学九年级下册第九单元《溶液》测试题(含答案)
文档属性
| 名称 | 人教版化学九年级下册第九单元《溶液》测试题(含答案) |  | |
| 格式 | zip | ||
| 文件大小 | 228.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-03-06 18:27:43 | ||
图片预览




文档简介
第九单元《溶液》测试题
一、单选题(每小题只有一个正确答案)
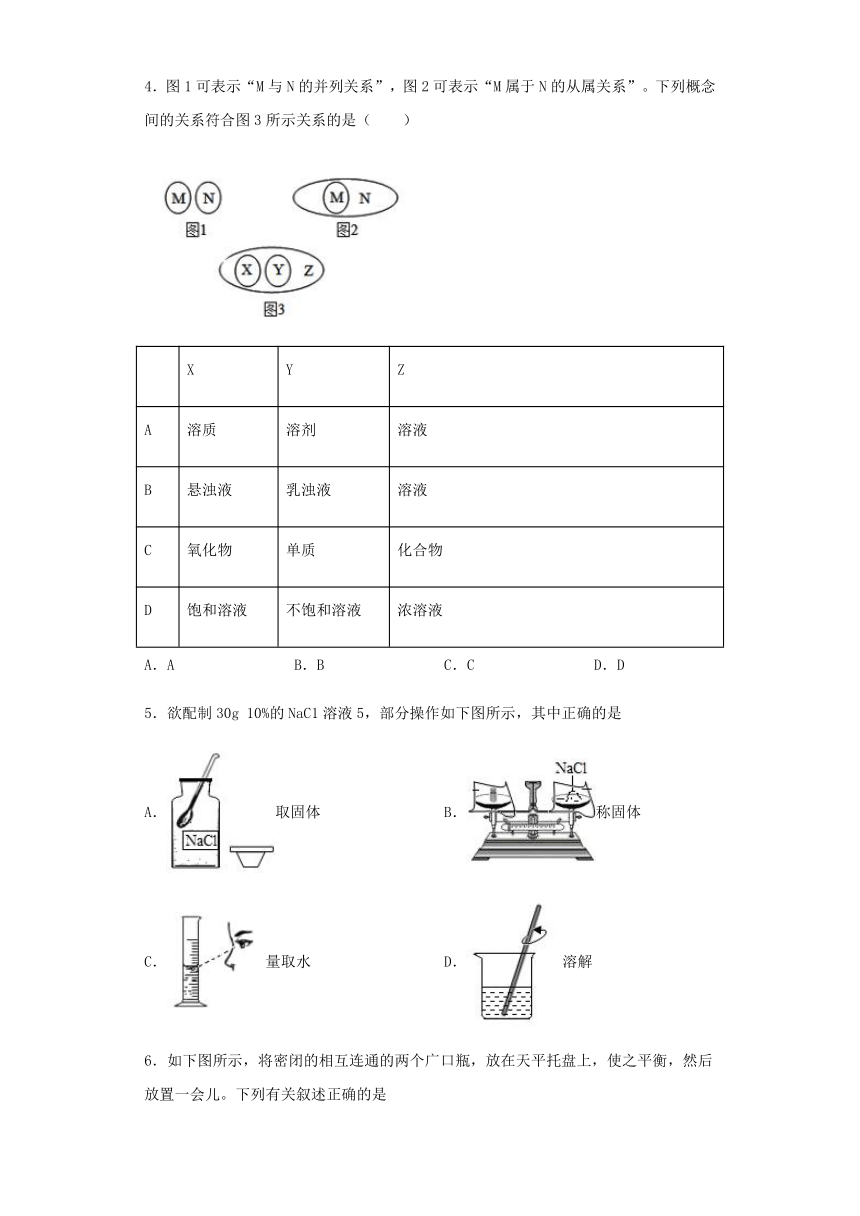
1.欲将80g质量分数为20%的NaOH溶液稀释到10%,需加水的质量为( )
A.800g B.80g C.8g D.0.8g
2.右图是固体物质R的溶解度曲线。将60 ℃ R的饱和溶液降温到20 ℃时,下列说法正确的是( )。
A.溶液中溶质的质量分数不变 B.溶液质量增加
C.溶液中溶质的溶解度减小 D.溶液变成不饱和溶液
3.如图是A、B、C三种固体物质的溶解度曲线,下列说法正确的是
A.t1℃时,A的饱和溶液中溶质质量分数为25%
B.t1℃时C的饱和溶液升温到t2℃,有晶体析出
C.A中含有少量B,要提纯A可采用蒸发结晶的方法
D.将t2℃时A、B、C的饱和溶液降温到t1℃,所得溶液中溶质质量分数大小关系为:B>A=C
4.图1可表示“M与N的并列关系”,图2可表示“M属于N的从属关系”。下列概念间的关系符合图3所示关系的是( )
X Y Z
A 溶质 溶剂 溶液
B 悬浊液 乳浊液 溶液
C 氧化物 单质 化合物
D 饱和溶液 不饱和溶液 浓溶液
A.A B.B C.C D.D
5.欲配制30g 10%的NaC1溶液5,部分操作如下图所示,其中正确的是
A.取固体 B.称固体
C.量取水 D.溶解
6.如下图所示,将密闭的相互连通的两个广口瓶,放在天平托盘上,使之平衡,然后放置一会儿。下列有关叙述正确的是
A.指针不偏,蔗糖溶液浓度不变 B.指针偏左,蔗糖溶液变浓
C.指针偏右,蔗糖溶液质量变大 D.指针偏左,生石灰部分变质
7.压强增大时,其在水中的溶解度不受影响的是(? )
A.NH3 B.SO2 C.CO2 D.KCl
8.各种溶液在生活中起着非常重要的作用。以下生活中常见的物质,不属于溶液的是( )
A.医用酒精 B.生理盐水 C.纯牛奶 D.矿泉水
9.甲、乙两物质的溶解度曲线如图所示,下列说法正确的( )
A.t1℃时,甲、乙两物质饱和溶液的质量一定相等
B.t2℃时,甲物质的溶质质量分数一定大于乙溶液
C.t2℃时,乙的饱和溶液的溶质质量分数一定小于33.3%
D.t2℃降温至t1℃,甲的溶液析出的溶质一定比乙的大
10.现有一杯的饱和硝酸钾溶液,欲改变其溶质质量分数,下列方法可行的是( )
A.加入一定量的硝酸钾 B.恒温蒸发部分水 C.升温到 D.降温到
11.如图是A、B、C三中物质的溶解曲线。下列说法不正确的是
A.A的溶解度随温度的升高而增大
B.t1 ℃时,B和C的饱和溶液中的溶质的质量分数相等
C.t2 ℃时,A和C的溶解度相同
D.A和C的饱和溶液从t2 ℃降到t1 ℃时,溶液都有晶体析出
12.下图是甲、乙两种固体物质(不含结晶水)的溶解度曲线,下列叙述正确的是( )
A.t2℃时等质量的甲乙饱和溶液降温到t1℃时两溶液中溶质质量相等
B.t2℃时,甲的溶解度是110
C.t1℃时分别将甲、乙的溶液恒温蒸发相等质量的水,析出甲、乙的质量相等
D.t2℃时,用210g甲的饱和溶液加水可以配制成550g20%的甲溶液
13.a、b两种物质的溶解度曲线如下图所示。下列说法不正确的是
A.t1℃时,a、b溶解度相等
B.t2℃时,a、b饱和溶液中溶质的质量分数a>b
C.将t2℃时的a、b饱和溶液降温至t1℃,两种溶液一定都是饱和溶液
D.t2℃时,取等质量a、b的饱和溶液,分别蒸发等质量水后恢复至t2℃,析出溶质的质量a>b
14.推理是学习化学的一种方法,但不合理的推理会得到错误结论。以下推理正确的是( )
A.分子可以构成物质——物质一定由分子构成
B.溶液具有均一性和稳定性——具有均一性、稳定性的液体一定是溶液
C.含碳元素的物质燃烧会生成二氧化碳——燃烧能生成二氧化碳的物质一定含有碳元素
D.化学反应常常伴随着能量变化——有能量释放的变化都是化学反应
15.下列实验设计不是利用控制变量法的是( )
A.探究铁生锈的条件 B.探究溶质在水中的溶解速率
C.探究条形磁铁周围磁场的分布 D.探究液体压强特点
二、填空题
16.2019年3月22日是第二十七届“世界水日”,水与人类的生活和生产密切相关,回答下列问题。
(1)电解水时,与电源负极相连的玻璃管内产生的气体为_____(填名称)。
(2)如图为a、b、c三种物质的溶解度曲线。
①t2℃时将30ga物质加入到50g水中,充分溶解,所得溶液的质量为_____。
②温度为_____时,a、c物质的溶解度关系为a>c。
③将t2℃时a、b、c三种物质的饱和溶液降温到t1℃,所得溶液中,溶质的质量分数由大到小为_____。
17.(1)工业生产中常用10%的稀盐酸来除铁制品表面的铁锈。请写出该反应的化学方程式 。
(2)实验室若要配制该盐酸溶液110g,则需要溶质质量分数为20%的浓盐酸(密度为1.1g/mL) mL。在配制10%的稀盐酸的过程中,除了用到烧杯、玻璃棒、胶头滴管外,还需要用到的仪器有 。
18.如图是小华配制100g溶质质量分数为5%的NaCl溶液的实验操作示意图:
(1)上图中的玻璃仪器分别是广口瓶、量筒、_____ 和玻璃棒,其中玻璃棒在此操作中的作用是_____。
(2)指出图②中的一处错误操作_____。
(3)通过计算确定需要水的质量是_____g,配制时应选择_____(填10、50或100)mL的量筒量取所需要的水。
(4)用上述图示的序号表示配制溶液的操作顺序_____。
19.请根据题意,选择下列词语填空:“饱和” “不饱和” “浓”“稀”“一定”或“不一定”。
已知: 20℃时,100g 水中最多溶解食盐和熟石灰的质量分别为36 g和0.17 g,现有甲、乙两只烧杯各盛100g水,在20℃时,分别进行如下实验:
(1)在甲烧杯中加入30g食盐,充分搅拌后,得到溶液甲,则甲为________溶液。由于此溶液中溶质含量较多,所以属于_____溶液。
(2)在乙烧杯中加入1g熟石灰,充分搅拌后得浑浊液体,过滤得到溶液乙,则乙为______溶液。由于此溶液中溶质含量较少,所以属于______ 溶液。
(3)由实验可知,对于不同溶质来说,浓溶液________ 是饱和溶液 ,稀溶液________ 是不饱和溶液。
20.下图是甲、乙两种固体物质的溶解度曲线,回答下列相关问题。
(1)t1℃时,甲物质的溶解度为18g;那么该温度下200g水中溶解 g乙,溶液达到饱和。
(2)t2℃时,比较甲、乙两物质的溶解度大小: 。
(3)若将t1℃ 时甲物质的饱和溶液100克和乙物质的饱和溶液200克分别升温到t2 ℃(不考虑水分蒸发),两物质的溶液中溶质的质量分数的关系是:甲 乙(填“大于”、“小于”或“等于”)。
三、推断题
21.同学们到实验室去进行“探究金属的性质”实验。将锌粉和铁粉的混合物加入到盛有一定量硝酸银溶液的烧杯中,充分反应后过滤,得到滤渣和滤液。请你填空。
(1)若将所得滤渣放入稀盐酸中,有气泡产生,则
①滤液里一定含有_____(填写化学式,下同),可能含有_____;
②滤渣中一定含有_____,可能含有_____。
(2)若反应后所得滤液呈无色,则滤渣中一定含有_____(填写化学式)。
(3)反应后所得滤液的溶质质量分数_____(选填“大于”、“等于”或“小于”)原硝酸银溶液的溶质质量分数。
22.A~H是初中化学中的常见物质,A、B、C含有相同的金属元素,B固体的溶解度随温度的升高而减小;C、D、E为氧化物; F、H为非金属单质,G、I为金属单质且I单质显红色。图中“﹣”表示两端的物质间能发生化学反应,“→”表示物质间存在转化关系,部分反应物或生成物已略去。
(1)写化学式:B_____、E_____。
(2)写出D﹣F反应的化学方程式_____,该反应过程_____热量(填“放出”或“吸收”)。
(3)写出G→I反应的化学方程式_____,该反应的基本类型是_____。
四、实验题
23.实验室配制50g5%的氯化钠溶液,现有①托盘天平,②量筒(10mL,50mL,100mL),③药匙。根据要求填空。
(1)完成本实验还需要的玻璃仪器是______。
(2)具体操作步骤可概括为______。
(3)本实验中量取蒸馏水时应选用__mL量筒。量筒读数时,如果俯视(其他操作无误),则配制的溶液中溶质的质量分数___(填“大于”“小于”或“等于”)5%。
24.氯化钠是一种重要的资源,在海水中储量很丰富。回答问题:
(1)海水晒盐是海水在常温下蒸发得到氯化钠的过程, 用氯化钠溶液模拟该过程 (如图1所示)。已知B溶液恰好是氯化钠的饱和溶液,与B溶液中溶质质量相等的溶液是___(填字母序号,下同),与B溶液中溶质的质量分数相等的溶液是___.
(2)图2为硒酸镉的溶解度曲线。t ℃时,将15g硒酸镉加入____g水中,完全溶解后,恰好得到饱和溶液。要进一步提高硒酸镉溶液中溶质的质量分数,进行的操作是_________ 。
五、计算题
25.向碳酸钠和氯化钠的混合物15.6g中加入100g稀盐酸,恰好完全反应后,得到111.2 g溶液。试计算:
(1)根据质量守恒定律得,产生二氧化碳质量为______;
(2)稀盐酸溶液中溶质的质量分数是________?(Na2CO3+2HCl=NaCl+H2O+CO2↑.相对原子质量Na:23 C:12 O:16 H:1 Cl:35.5)
26.实验室常用溶质质量分数为98%的浓硫酸(密度1.84g/cm3)来配制需要用的较稀的硫酸溶液。现要配制500mL溶质质量分数为20%(密度为1.14g/cm3)的稀硫酸溶液,需要多少毫升浓硫酸?_________________________需要加水多少毫升?______________
参考答案
1.B 2.C 3.B 4.A 5.D 6.C 7.D 8.C 9.C 10.D 11.D 12.D 13.C 14.C 15.C 16.氢气 75g 大于t1℃ b>a>c
17.(1)Fe2O3 + 6HCl 2FeCl3 + 3H2O
(2)50 量筒
18.烧杯 搅拌,加速溶解 药品与砝码放错位置 95 100 ④②①⑤③
19.不饱和 浓 饱和 稀 不一定 不一定
20.(1)36 。(2)甲 〉乙。(3)等于 。
21.Zn(NO3)2 Fe(NO3)2 Ag、Fe Zn Ag、Fe 小于
22.Ca(OH)2; H2O; CO2+C2CO; 吸收; Fe+CuSO4=Cu+FeSO4; 置换反应;
23.玻璃棒、烧杯、胶头滴管 计算、称量、量取、溶解 50 大于
24.A CD 50 降温并加入硒酸镉
25.4.4g 15%
26.63.22mL 453.67mL
同课章节目录
