人教版九年级下化学9.2溶解度教案
图片预览




文档简介
课题2 溶解度
第1课时
教学目标
一、知识目标
1. 理解饱和溶液和不饱和溶液的涵义。
2. 知道饱和溶液和不饱和溶液的相互转化关系。
3. 能举例说明结晶现象。
二、能力目标
通过实验探究培养学生实验现象的观察、分析,结论的推理归纳能力。
三、情感目标
通过实验条件的改变,让学生感受饱和溶液与不饱和溶液的存在和转化是有条件的,逐步建立辩证的、发展的思想观。
教学重点
理解饱和溶液和不饱和溶液的涵义。
教学难点
确定饱和溶液与不饱和溶液是有前提条件的。
教学过程
一、情景导入
教师手持一杯水,问:“我这些水能溶解多少食盐呢?一勺、两勺?”
过渡:一定量的水中究竟能不能无限制地溶解溶质呢?我们还是让事实说话。
二、新课教学
1. 实验9-5
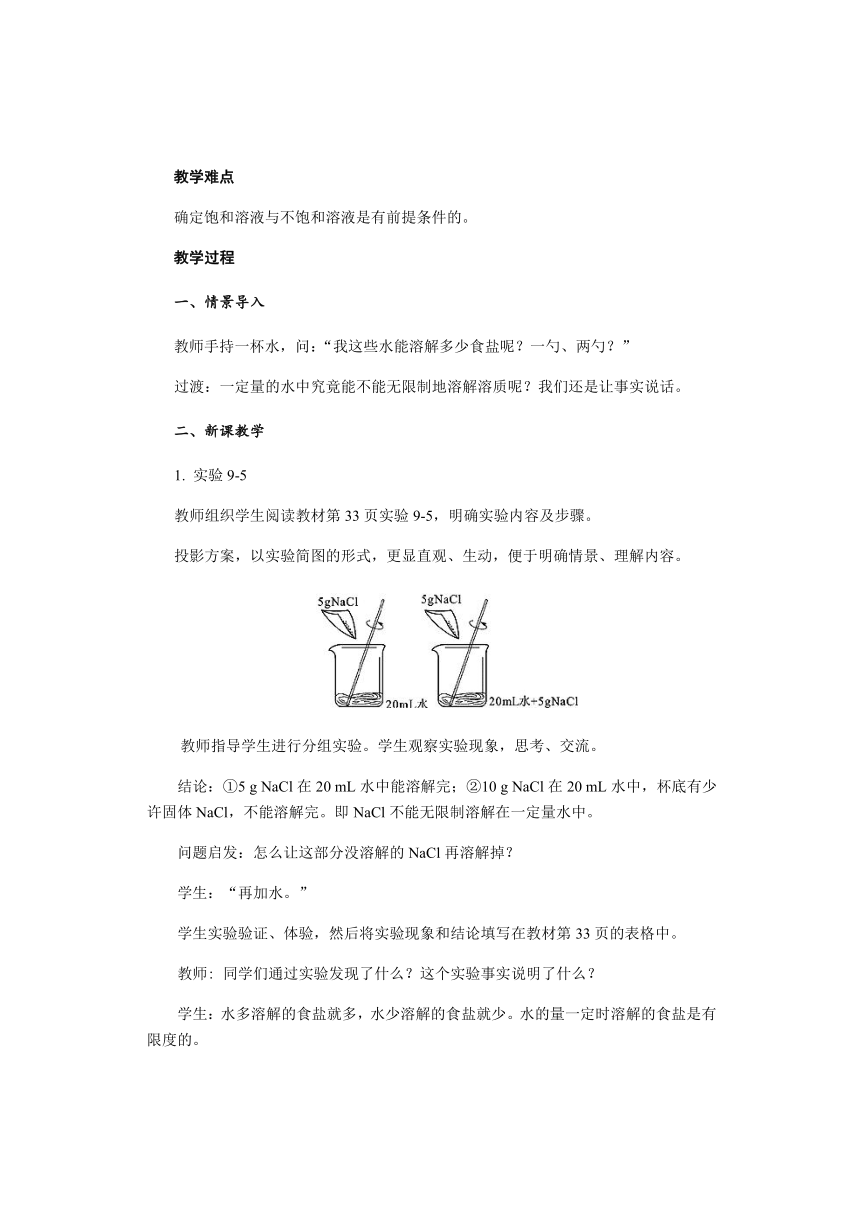
教师组织学生阅读教材第33页实验9-5,明确实验内容及步骤。
投影方案,以实验简图的形式,更显直观、生动,便于明确情景、理解内容。
教师指导学生进行分组实验。学生观察实验现象,思考、交流。
结论:①5 g NaCl在20 mL水中能溶解完;②10 g NaCl在20 mL水中,杯底有少许固体NaCl,不能溶解完。即NaCl不能无限制溶解在一定量水中。
问题启发:怎么让这部分没溶解的NaCl再溶解掉?
学生:“再加水。”
学生实验验证、体验,然后将实验现象和结论填写在教材第33页的表格中。
教师: 同学们通过实验发现了什么?这个实验事实说明了什么?
学生:水多溶解的食盐就多,水少溶解的食盐就少。水的量一定时溶解的食盐是有限度的。
过渡:KNO3为实验室里化学药品,它在一定量的水中能不能无限制溶解呢?
2. 实验9-6
教师引导学生阅读教材第33页实验9-6,明确实验情景,按步骤进行分组实验。然后提出实验中需思考的问题:
(1)溶剂量一定时,温度升高后硝酸钾到哪里去了?
(2)溶剂量一定时,温度升高,溶解溶质硝酸钾的量的变化?
(3)“在一定量的水中,食盐的溶解量是一定的。”我们从实验9-5得到的这个结论是否严密?如果也升高温度,溶解溶质食盐的量是否也会变?
(4)溶剂(水)的量一定、温度一定时,与其所溶解溶质的量有什么关系?所能溶解溶质硝酸钾的量是否有限?
教师指导学生进行分组实验,学生观察实验现象,思考、交流、体验,然后将实验现象和结论填写教材中的表格。
(冷却至有晶体析出,需要一段时间,在此过程中组织学生思考交流)
教师: 同学们通过实验发现了什么?这个实验事实说明了什么?
学生:升高温度,KNO3溶解的量增加。结合生活常识,热水比凉水溶解固体物质的能力强。水的量一定、温度也一定时,溶解的硝酸钾是有限度的。
结论:①5 g KNO3在20 mL水中能溶解完;②10 g KNO3在20 mL水中,杯底有少许固体不能溶解完。即KNO3在一定量水中,一定温度下,不能无限制溶解。
3. 饱和溶液
学生阅读理解教材第34页第一自然段,形成饱和溶液、不饱和溶液概念。
饱和溶液
(1)定义:在一定温度下,一定量的溶剂里,不能再溶解某种溶质的溶液叫饱和溶液,反之不饱和溶液。
引导学生分析:从以上两个实验中你还能得出什么结论?(从改变温度、溶剂的量引起溶解情况发生的改变上来分析)
小结:①实验证明在一定量的溶剂里是无法无限溶解某种溶质的。随着外界条件(温度、溶剂的量等)的改变,情况又发生了变化。
②只有指明“一定量溶剂里”和“在一定温度下”“饱和”和“不饱和”才有确定的意义。
③饱和与不饱和是相对而言的,在一定程度上它们是可以互相转变的。
引导学生思考:如何实现饱和溶液与不饱和溶液的相互转化?学生思考、交流、讨论、总结。
(2)相互转化
设计问题、深化概念:向你们在实验中得到的一定温度下的氯化钠的饱和溶液中再加入少量的其他固体,是否能再溶解?
投影演示实验:向饱和氯化钠溶液中加入高锰酸钾。观察现象、加深理解饱和溶液的概念
结论:饱和溶液在一定温度、一定量的溶剂里不能再溶解某种物质,是该物质的饱和溶液,再加入其他溶质能溶解,所以要强调是哪种物质的饱和溶液。
师举例讲述:生活中遇到的溶液,多数是由多种溶质组成的,如我们感冒输液时,输的液体中就有多种药物在里面。
让学生联想生活中的溶液,如汽水、各种饮料等,体会饱和溶液是相对于某种溶质而言的。
4. 结晶
深化探究:再让学生观察杯中KNO3晶体,参照教材第34页图9-10,阅读感悟,从而引出结晶的概念。
提出问题:除了降温结晶,还有什么方法可以使饱和溶液结晶?
蒸发溶剂也是一种获得晶体的常用方法。例如,用海水晒盐,就是利用涨潮将海水引入贮水池,待海水澄清后,先引入蒸发池,经过风吹和日晒使水分部分蒸发;到一定程度后再引入到结晶池中,继续风吹和日晒,海水就会慢慢成为食盐的饱和溶液;再晒,食盐晶体就会逐渐从海水中析出,得到粗盐,同时得到含有大量化工原料的母液(叫做苦卤)
播放视频:《闪闪的红星》片段。抛给学生问题:“如何得到棉袄中的盐?”
“儿童团员潘冬子,机智地穿着浸透盐水的棉袄,混过敌人检查,把盐水带到山上,然后获得盐水中的盐。”
学生联想生活、学以致用:炒菜时,菜汤在锅里蒸发,锅底上有白色斑迹;运动出汗衣服上会出现白色斑迹……
5. 巩固练习
(1)下面关于饱和溶液的说法中正确的是(??? )
A. 含有溶质很多的溶液
B. 还能继续溶解某种溶质的溶液
C. 不能继续溶解某种溶质的溶液
D. 在一定温度下,在一定量的溶剂里,不能再溶解某种溶质的溶液
(2)从1L氯化钠饱和溶液中取出100mL液体,则原溶液发生的变化是(??? )
A. 溶液由饱和变成了不饱和??????? B. 溶液中会析出晶体
C. 溶液中只有溶剂减少了????????? D. 溶液中溶剂和溶质都减少了
(3)20℃时,往50g硝酸钾溶液中加入5g硝酸钾晶体,充分搅拌后,尚有部分晶体未溶解.稍加热后,晶体全部溶解.下列说法正确的是(??? )
A.搅拌后加热前一定是饱和溶液 B.搅拌后加热前一定是不饱和溶液
C.加热后一定是饱和溶液 D.加热后一定是不饱和溶液
参考答案:(1)D (2)D (3)A
三、本课小结
学生总结本节课的收获,教师补充。
四、板书设计
一、饱和溶液
1. 定义
条件:一定温度、一定量溶剂
2. 转化
3. 结晶
降温结晶、蒸发结晶
第2课时
教学目标
一、知识目标
1. 了解溶解度的含义,能从溶解度曲线中获得相关信息。
2. 知道影响气体溶解度的因素,能利用气体溶解度曲线解释生活中的有关现象。
二、能力目标
初步学习运用数据、表格、图像等进行定量研究的方法。
三、情感目标
通过亲自绘图,体验成功的喜悦。
教学重点
固体物质溶解度的含义,利用溶解度曲线获得相关信息。
教学难点
溶解度概念的理解。
教学过程
一、新课导入
通过课题1的学习,我们知道:不同溶质在同种溶剂中的溶解性不同,这节课我们就来从量的角度研究物质的溶解性强弱。
设问:一位同学用一杯水和一盆水来分别溶解糖和食盐,发现一盆水溶解的食盐多,他说食盐的溶解性比糖强。你同意他的观点吗?
二、新课教学
1. 溶解度
展示问题,学生思考、交流、分组讨论。
(1) 50℃时,向20克水中加入氯化钠直至饱和时溶解氯化钠7.4克,向20克水中加入硝酸钾至饱和时溶解硝酸钾17.1克。比较二者的溶解性?
(2)20℃时,向20克水中加入氯化钠直至饱和时溶解氯化钠7.2克,向100克水中加入硝酸钾至饱和时溶解硝酸钾31.6克。比较二者的溶解性?
(3)50℃时,向100克水中加入氯化钠直至饱和时溶解氯化钠37克;20℃时,向100克水中加入硝酸钾至饱和时溶解硝酸钾31.6克。则说明氯化钠在水中的溶解性比硝酸钾强。这种说法对吗?
各小组汇报交流结果:
50℃时,氯化钠的溶解性比硝酸钾弱。
可以比较20克水中:最多溶解量,氯化钠7.2克、硝酸钾6.3克。
也可以比较100克水中:最多溶解量,氯化钠36克、硝酸钾31.6克。故说20℃氯化钠的溶解性比硝酸钾强。
无法比较。因为温度不同(条件不同,不具有可比性)
通过问题探究、互相交流,学生体会到要比较不同物质在同一种溶剂中的溶解能力必需有以下条件:①在同一温度下;②相同量的溶剂里;③比较达到饱和状态时所溶解溶质的质量。
教师总结:定量描述物质溶解能力的要素:①在一定温度下,②在等量溶剂里,人们统一规定:在100克溶剂里,③溶液为饱和状态,④通常我们规定比较溶质的质量大小。
引导学生思考、发言: 通过大家的总结我们知道必须满足四个条件才能定量地描述溶解能力的大小,也就是溶解度。请大家试着描述溶解度的概念(鼓励学生用自己的语言描述)。
溶解度定义:在一定温度下,某固态物质在100克溶剂里达到饱和状态时所溶解的质量。
四大要素:一定温度下、100克溶剂、饱和状态、溶质的质量。
巩固练习:
(1)20℃时硝酸钾的溶解度是31.6克的含义 。
(2)判断下列说法是否正确,并指明错误原因。
① 把20克某物质溶解在100克水里恰好制成饱和溶液,这种物质的溶解度是20克。( )
② 20℃时10克氯化钠溶解在水里制成饱和溶液,故20℃时氯化钠的溶解度是10克。( )
③ 20℃时10克氯化钠可溶解在100克水里,故20℃时氯化钠的溶解度是10克。( )
④ 20℃时36克食盐溶解在100克水中恰好饱和,故20℃时食盐的溶解度是36。( )
(3)已知氯化铵在30℃时的溶解度为45.8克。30℃时将68.7克氯化铵配制成400克的溶液,通过计算,判断溶液是否饱和?
参考答案:(1)20℃时100克水中最多能溶解硝酸钾31.6克。
(2)①×,未指明温度。②×,未指明溶剂的量。③×,未指明溶液的状态是饱和状态。④×.溶解度的单位应该是“克”。
(3)不饱和
过渡:理解了溶解度的概念,那你了解平时所说的“易溶”“难溶”与溶解度的关系吗?
请看第36页的资料卡片,了解溶解度与溶解性的关系。引导学生查看附录中的溶解性表。
巩固练习:
1.不溶物就是绝对不溶的物质。这句话是否正确?
2.20℃时碳酸钙的溶解度是0.0013克,所以碳酸钙是___________溶物质。
3.20℃时食盐的溶解度是36克,所以食盐属于________溶物质。
答案:1.不正确。通常所说的不溶物即难溶物,溶解度<0.01 g 2.难 3.易
过渡:我们知道,温度是影响固体物质溶解度大小的主要因素,同一物质在水中的溶解度随温度的变化而变化,这种变化关系是什么样的?
2.溶解曲线
组织学生活动与探究。结合表9-1,在图9-11中绘制物质溶解度曲线。
学生分组绘制:1、3组绘氯化钠的;5、7组绘氯化钾的;2、4组绘氯化铵的;6、8组绘硝酸钾的溶解度曲线。
教师巡回指导,然后结合学生绘制的溶解度曲线及教材第37页图9-12,分组讨论、交流。
让学生在自己绘制的曲线上查阅四种物质在25℃、85℃时的溶解度。再把绘制的曲线与教材中图9-12和9-13进行比较。学生思考交流,完成教材第37页探究3(1)(2)(3)。
教师引导学生阅读教材相关内容,让学生了解溶解曲线的含义、作用和规律。
巩固练习:教材第40页“习题与应用”第4题。
过渡:研究了固体物质的溶解度,那么气体物质的溶解度又该如何表示呢?
3.气体的溶解度
提出问题、引发讨论:
(1)打开汽水(或某些含有二氧化碳气体的饮料)盖时,气体会自动喷出来。说明气体在水中溶解度与什么有关?
(2)喝了汽水后常常会打嗝,这说明气体的溶解度还与什么有关?
(3)烧开水是随着水温升高不断有气泡冒出,这说明气体的溶解度与什么因素有关?
得出结论。
引导学生阅读教材,了解气体溶解度是怎样规定的。并引导学生将固体物质和气体的溶解度影响因素作对比,加深学生的认识。
气体的溶解度常用体积来表示。通常用的气体的溶解度,是指该气体的压强为101 kPa和一定温度时,在1体积水里溶解达到饱和状态时的气体体积。
影响气体的溶解度的因素是温度和压强。压强越大溶解度越大,温度越高溶解度越小。
让学生参阅教材第38页资料卡片,利用所学知识,解决生活问题。
三、本课小结
学生总结自己本节课的学习收获,教师回顾目标:
1. 溶解度的含义,能从溶解度曲线中获得相关信息。
2. 知道影响气体溶解度的因素,利用气体溶解度曲线解释生活中的有关现象。
四、板书设计
1. 溶解度
2. 溶解曲线
3. 气体的溶解度
压强越大溶解度越大,温度越高溶解度越小。
同课章节目录
