鲁教版第九单元到实验室去 探究金属的性质(共26张PPT)
文档属性
| 名称 | 鲁教版第九单元到实验室去 探究金属的性质(共26张PPT) |
|
|
| 格式 | zip | ||
| 文件大小 | 632.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-03-07 09:09:15 | ||
图片预览





文档简介
(共26张PPT)
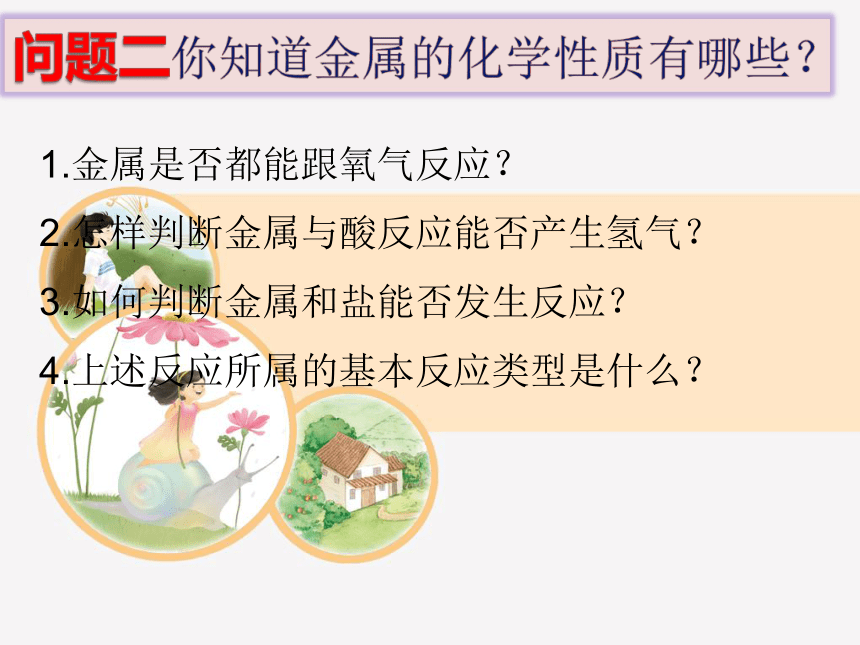
问题一你知道金属的物理性质有哪些?
有延展性
有金属光泽
密度较大
强度较大
热和电的导体
熔沸点较高
金属的物理性质
1.金属是否都能跟氧气反应?
2.怎样判断金属与酸反应能否产生氢气?
3.如何判断金属和盐能否发生反应?
4.上述反应所属的基本反应类型是什么?
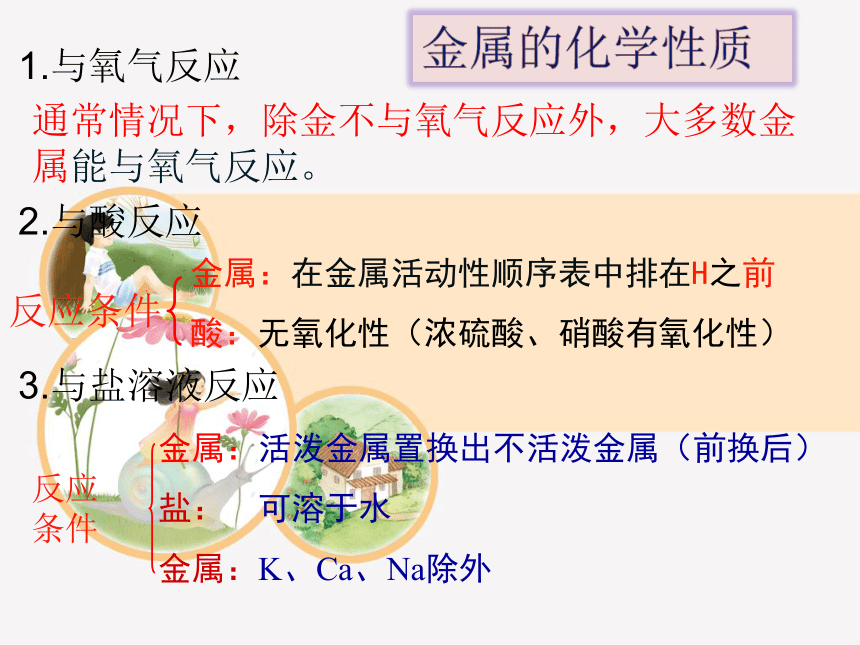
问题二你知道金属的化学性质有哪些?
1.与氧气反应
通常情况下,除金不与氧气反应外,大多数金属能与氧气反应。
2.与酸反应
金属:在金属活动性顺序表中排在H之前
酸:无氧化性(浓硫酸、硝酸有氧化性)
反应条件
3.与盐溶液反应
金属:活泼金属置换出不活泼金属(前换后)
盐: 可溶于水
金属:K、Ca、Na除外
反应
条件
金属的化学性质
第九单元 金属
到实验室去 探究金属的性质
明确任务
1. 探究金属的物理性质,认识金属材料在日常生活中的用途。
2. 探究金属的化学性质,认识金属活动性顺序,了解防止金属锈蚀的简单方法。
做好准备
你需要准备以下实验用品:
1. 一些生活中常用的物品:细铜丝、细铁丝、铁钉、铝箔、石棉网、白炽灯的灯丝、订书钉、易拉罐、铝合金制品、不锈钢餐具等;电池、小灯泡、导线、磁铁;砂纸、火柴、胶水。
2. 实验室中的试剂和仪器:铝粉、镁带、锌片、铁粉、稀盐酸、稀硫酸、硫酸亚铁溶液、硫酸铜溶液、硝酸银溶液、氯化钠溶液;坩埚钳、酒精灯、药匙、试管。
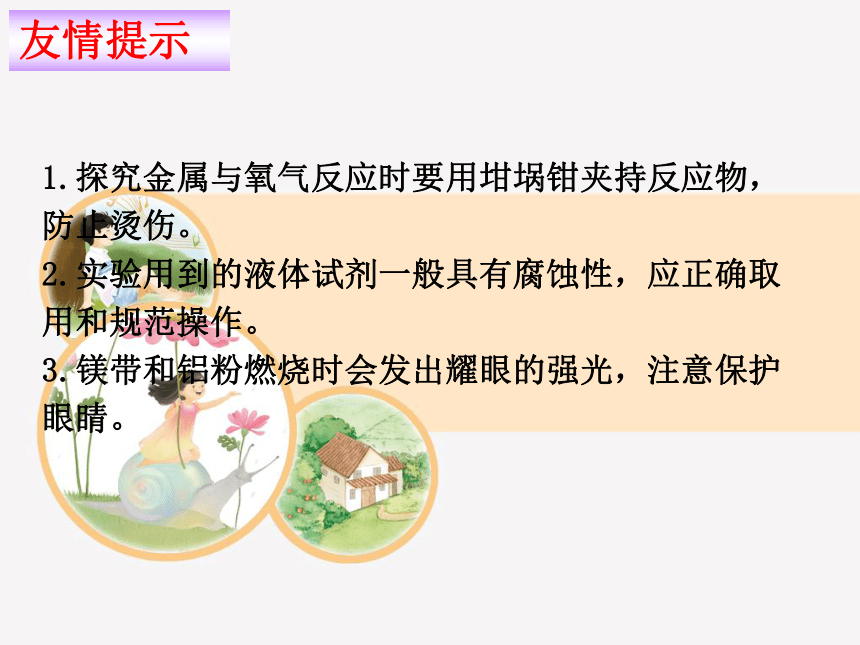
友情提示
1.探究金属与氧气反应时要用坩埚钳夹持反应物,防止烫伤。
2.实验用到的液体试剂一般具有腐蚀性,应正确取用和规范操作。
3.镁带和铝粉燃烧时会发出耀眼的强光,注意保护眼睛。
动手实验
请按照下表中的实验步骤进行实验,将你观察到的现象、得到的结果记录在表中,并尝试对实验现象和结果进行分析,进而得出结论。
一、金属的物理性质
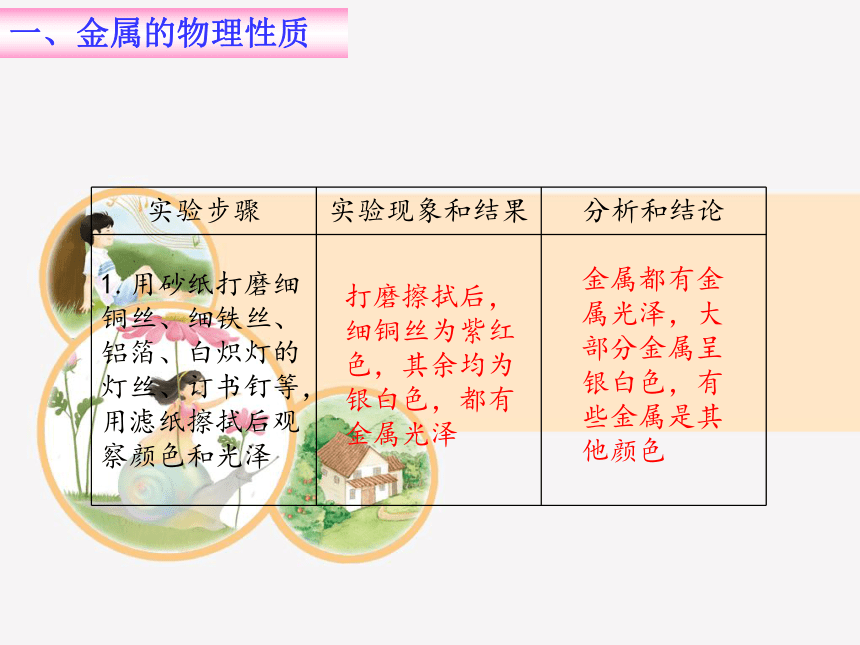
实验步骤 实验现象和结果 分析和结论
1.用砂纸打磨细铜丝、细铁丝、铝箔、白炽灯的灯丝、订书钉等,用滤纸擦拭后观察颜色和光泽
打磨擦拭后,细铜丝为紫红色,其余均为银白色,都有金属光泽
金属都有金属光泽,大部分金属呈银白色,有些金属是其他颜色
一、金属的物理性质
实验步骤 实验现象和结果 分析和结论
2.选择几种金属制品,尝试一下是否容易被弯曲、折断
大部分金属不易弯曲、折断
金属的硬度较大
一、金属的物理性质
实验步骤 实验现象和结果 分析和结论
3.选择铁丝、铝箔、铜丝,手持金属的一端,在酒精灯火焰上烘烤另一端(注意时间不要太长,以免烫伤!),试试金属的传热能力
手握的一端感到热,铜丝热的最快,铁丝最慢
金属都具有导热性,导热性:铜>铝>铁
一、金属的物理性质
实验步骤 实验现象和结果 分析和结论
4.利用电池、小灯泡试试步骤3中的三种金属的导电能力
小灯泡都亮,用铜丝时小灯泡最亮,铁丝最暗
金属都具有导电性,导电性:铜>铝>铁
一、金属的物理性质
实验步骤 实验现象和结果 分析和结论
5.用磁铁分别吸引上述金属材料
铁丝能被吸引,所测试的其他金属不能被磁铁吸引
铁可被磁铁吸引
二、金属的化学性质
1. 金属与氧气的反应
实验步骤 实验现象和结果 分析结论
(1)取少量铝粉,均匀地平摊在滤纸上,再将滤纸小心地卷起来,用坩埚钳夹持,在酒精灯上点燃。
剧烈燃烧,生成白色固体
铝粉能在空气中燃烧
二、金属的化学性质
1. 金属与氧气的反应
实验步骤 实验现象和结果 分析结论
剧烈燃烧,发出耀眼的强光,生成白色固体
(2)用坩埚钳夹取一段用砂纸打磨过的镁带,在酒精灯上点燃。
镁能在空气中燃烧
二、金属的化学性质
2. 设计实验探究锌、铁、铜三种金属的活动性顺序
实验步骤 实验现象和结果 分析结论
1.取1 mL~2 mL 硫酸亚铁溶液放于试管中,再将锌粒放入试管中,观察现象。
溶液由浅绿色变为无色,锌粒表面有黑色物质析出。
锌能将铁置换出来,锌比铁活泼
2.取1 mL~2 mL 硫酸亚铁溶液放于试管中,再将铜丝插入溶液中,观察现象。
无明显现象
铜不能将铁置换出来,铁比铜活泼
金属活动性顺序:锌>铁>铜
1.金属有哪些共性?金属的用途与性质之间有什么关系?
反思交流
金属的共性:大多数金属都具有金属光泽,密度和硬度较大,熔、沸点较高,具有良好的延展性和导电、导热性。
金属的性质和用途之间的关系:性质决定用途,用途反映性质。
反思交流
2.我国古代就发明了湿法冶金技术,其基本原理是什么?金属与盐溶液反应有什么规律?你能想到哪些化学方法来判断金属的活动性顺序?
湿法冶金技术是利用金属与盐溶液发生置换反应的原理。金属与盐溶液反应的规律:活动性强的金属(K、Ca、Na除外)可以把活动性弱的金属从其盐溶液中置换出来。
判断金属活动性顺序的方法:根据金属与氧气反应的难易程度;根据金属能否与酸反应及反应的剧烈程度;根据一种金属能否与另一种金属的盐溶液反应。
课堂小结
一、金属的物理性质
具有金属光泽、导电性、导热性、延展性
二、金属的化学性质
金属与氧气的反应
金属与酸的反应
金属与盐溶液的反应
挑战自我
C
1.(2019年常州中考题)铜能被加工成7微米厚的超薄铜箔,说明铜具有良好的( )
A. 导电性 B. 导热性
C. 延展性 D. 耐酸性
挑战自我
2.冬天在公共汽车上,抓住金属把手比抓住塑料把手要冷得多,这是因为( )
A.金属易导电 B.金属易导热
C.金属有金属光泽 D.金属温度低
B
挑战自我
A
3.(2019年南宁中考题)下列金属不能跟稀盐酸反应产生氢气的是( )
A.银 B.锡 C.铝 D.镁
挑战自我
4.(2019年滨州中考题)有甲、乙、丙三种金属,如果将甲、乙、丙分别放入硫酸铜溶液中,一段时间后,乙、丙表面出现红色物质,甲没有明显现象;再将大小相同的乙、丙分别放入相同溶质质量分数的稀盐酸中,乙、丙均产生气泡,但丙产生气泡的速度明显快于乙,则甲、乙、丙三种金属的活动性顺序是( )
A. 丙乙甲 B. 甲丙乙 C. 丙甲乙 D. 甲乙丙
A
挑战自我
作业布置
完成练习册中本课时的习题。
欢迎指导
谢谢大家
再见!
问题一你知道金属的物理性质有哪些?
有延展性
有金属光泽
密度较大
强度较大
热和电的导体
熔沸点较高
金属的物理性质
1.金属是否都能跟氧气反应?
2.怎样判断金属与酸反应能否产生氢气?
3.如何判断金属和盐能否发生反应?
4.上述反应所属的基本反应类型是什么?
问题二你知道金属的化学性质有哪些?
1.与氧气反应
通常情况下,除金不与氧气反应外,大多数金属能与氧气反应。
2.与酸反应
金属:在金属活动性顺序表中排在H之前
酸:无氧化性(浓硫酸、硝酸有氧化性)
反应条件
3.与盐溶液反应
金属:活泼金属置换出不活泼金属(前换后)
盐: 可溶于水
金属:K、Ca、Na除外
反应
条件
金属的化学性质
第九单元 金属
到实验室去 探究金属的性质
明确任务
1. 探究金属的物理性质,认识金属材料在日常生活中的用途。
2. 探究金属的化学性质,认识金属活动性顺序,了解防止金属锈蚀的简单方法。
做好准备
你需要准备以下实验用品:
1. 一些生活中常用的物品:细铜丝、细铁丝、铁钉、铝箔、石棉网、白炽灯的灯丝、订书钉、易拉罐、铝合金制品、不锈钢餐具等;电池、小灯泡、导线、磁铁;砂纸、火柴、胶水。
2. 实验室中的试剂和仪器:铝粉、镁带、锌片、铁粉、稀盐酸、稀硫酸、硫酸亚铁溶液、硫酸铜溶液、硝酸银溶液、氯化钠溶液;坩埚钳、酒精灯、药匙、试管。
友情提示
1.探究金属与氧气反应时要用坩埚钳夹持反应物,防止烫伤。
2.实验用到的液体试剂一般具有腐蚀性,应正确取用和规范操作。
3.镁带和铝粉燃烧时会发出耀眼的强光,注意保护眼睛。
动手实验
请按照下表中的实验步骤进行实验,将你观察到的现象、得到的结果记录在表中,并尝试对实验现象和结果进行分析,进而得出结论。
一、金属的物理性质
实验步骤 实验现象和结果 分析和结论
1.用砂纸打磨细铜丝、细铁丝、铝箔、白炽灯的灯丝、订书钉等,用滤纸擦拭后观察颜色和光泽
打磨擦拭后,细铜丝为紫红色,其余均为银白色,都有金属光泽
金属都有金属光泽,大部分金属呈银白色,有些金属是其他颜色
一、金属的物理性质
实验步骤 实验现象和结果 分析和结论
2.选择几种金属制品,尝试一下是否容易被弯曲、折断
大部分金属不易弯曲、折断
金属的硬度较大
一、金属的物理性质
实验步骤 实验现象和结果 分析和结论
3.选择铁丝、铝箔、铜丝,手持金属的一端,在酒精灯火焰上烘烤另一端(注意时间不要太长,以免烫伤!),试试金属的传热能力
手握的一端感到热,铜丝热的最快,铁丝最慢
金属都具有导热性,导热性:铜>铝>铁
一、金属的物理性质
实验步骤 实验现象和结果 分析和结论
4.利用电池、小灯泡试试步骤3中的三种金属的导电能力
小灯泡都亮,用铜丝时小灯泡最亮,铁丝最暗
金属都具有导电性,导电性:铜>铝>铁
一、金属的物理性质
实验步骤 实验现象和结果 分析和结论
5.用磁铁分别吸引上述金属材料
铁丝能被吸引,所测试的其他金属不能被磁铁吸引
铁可被磁铁吸引
二、金属的化学性质
1. 金属与氧气的反应
实验步骤 实验现象和结果 分析结论
(1)取少量铝粉,均匀地平摊在滤纸上,再将滤纸小心地卷起来,用坩埚钳夹持,在酒精灯上点燃。
剧烈燃烧,生成白色固体
铝粉能在空气中燃烧
二、金属的化学性质
1. 金属与氧气的反应
实验步骤 实验现象和结果 分析结论
剧烈燃烧,发出耀眼的强光,生成白色固体
(2)用坩埚钳夹取一段用砂纸打磨过的镁带,在酒精灯上点燃。
镁能在空气中燃烧
二、金属的化学性质
2. 设计实验探究锌、铁、铜三种金属的活动性顺序
实验步骤 实验现象和结果 分析结论
1.取1 mL~2 mL 硫酸亚铁溶液放于试管中,再将锌粒放入试管中,观察现象。
溶液由浅绿色变为无色,锌粒表面有黑色物质析出。
锌能将铁置换出来,锌比铁活泼
2.取1 mL~2 mL 硫酸亚铁溶液放于试管中,再将铜丝插入溶液中,观察现象。
无明显现象
铜不能将铁置换出来,铁比铜活泼
金属活动性顺序:锌>铁>铜
1.金属有哪些共性?金属的用途与性质之间有什么关系?
反思交流
金属的共性:大多数金属都具有金属光泽,密度和硬度较大,熔、沸点较高,具有良好的延展性和导电、导热性。
金属的性质和用途之间的关系:性质决定用途,用途反映性质。
反思交流
2.我国古代就发明了湿法冶金技术,其基本原理是什么?金属与盐溶液反应有什么规律?你能想到哪些化学方法来判断金属的活动性顺序?
湿法冶金技术是利用金属与盐溶液发生置换反应的原理。金属与盐溶液反应的规律:活动性强的金属(K、Ca、Na除外)可以把活动性弱的金属从其盐溶液中置换出来。
判断金属活动性顺序的方法:根据金属与氧气反应的难易程度;根据金属能否与酸反应及反应的剧烈程度;根据一种金属能否与另一种金属的盐溶液反应。
课堂小结
一、金属的物理性质
具有金属光泽、导电性、导热性、延展性
二、金属的化学性质
金属与氧气的反应
金属与酸的反应
金属与盐溶液的反应
挑战自我
C
1.(2019年常州中考题)铜能被加工成7微米厚的超薄铜箔,说明铜具有良好的( )
A. 导电性 B. 导热性
C. 延展性 D. 耐酸性
挑战自我
2.冬天在公共汽车上,抓住金属把手比抓住塑料把手要冷得多,这是因为( )
A.金属易导电 B.金属易导热
C.金属有金属光泽 D.金属温度低
B
挑战自我
A
3.(2019年南宁中考题)下列金属不能跟稀盐酸反应产生氢气的是( )
A.银 B.锡 C.铝 D.镁
挑战自我
4.(2019年滨州中考题)有甲、乙、丙三种金属,如果将甲、乙、丙分别放入硫酸铜溶液中,一段时间后,乙、丙表面出现红色物质,甲没有明显现象;再将大小相同的乙、丙分别放入相同溶质质量分数的稀盐酸中,乙、丙均产生气泡,但丙产生气泡的速度明显快于乙,则甲、乙、丙三种金属的活动性顺序是( )
A. 丙乙甲 B. 甲丙乙 C. 丙甲乙 D. 甲乙丙
A
挑战自我
作业布置
完成练习册中本课时的习题。
欢迎指导
谢谢大家
再见!
同课章节目录
- 第七单元 常见的酸和碱
- 第一节 酸及其性质
- 第二节 碱及其性质
- 第三节 溶液的酸碱性
- 第四节 酸碱中和反应
- 到实验室去:探究酸和碱的化学性质
- 第八单元 海水中的化学
- 第一节 海洋化学资源
- 第二节 海水“晒盐“
- 第三节 海水“制碱“
- 到实验室去:粗盐中难溶性杂质的去除
- 第九单元 金属
- 第一节 常见的金属材料
- 第二节 金属的化学性质
- 第三节 钢铁的锈蚀与防护
- 到实验室去 探究金属的性质
- 第十单元 化学与健康
- 第一节 食物中的有机物
- 第二节 化学元素与人体健康
- 第三节 远离有毒物质
- 第十一单元 化学与社会发展
- 第一节 化学与能源开发
- 第二节 化学与材料研制
- 第三节 化学与农业生产
- 第四节 化学与环境保护
