人教版高中化学选修4第三章第一节-弱电解质的电离--课件(共21张PPT)
文档属性
| 名称 | 人教版高中化学选修4第三章第一节-弱电解质的电离--课件(共21张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 1.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-03-07 00:00:00 | ||
图片预览








文档简介
(共21张PPT)
第三章 水溶液中的离子平衡
第一节 弱电解质的电离
知识回顾:
电解质:
非电解质:
在水溶液中或熔融状态时能够导电的化合物。
在水溶液中和熔融状态时都不能导电的化合物。
①NaCl溶液 ②NaOH ③HCl
④Cu ⑤CH3COOH ⑥NH3·H2O
⑦CO2 ⑧乙醇 ⑨水
⑦⑧
市地税稽查局长述职工作汇报
各位领导、同志们:
20xx年10月,在市局党组和全体地税干部的真情支持下,我有
幸被**地税局聘任担任廉江市地方税务局稽查局长局长职务。这些
年来,在市局党组和上级稽查局的正确领导下,在机关各职能部门和基
层各单位领导配合帮助下,特别是在分管稽查市局副局长具体领导下,
认真履行稽查局长职责, 以科学发展观和构建和谐社会重要思想为
指导,围绕廉江地税工作心,以努力实现、全力履行稽查工作职
责为主题,以查处税收违法案件和组织税收专项检查为重点,完善
稽查制度,强化稽查管理工作,创新稽查工作方式,全局上下团结
奋进,开拓创新,做大量扎实、细致的工作,比较园满地完成了局
党组交给的工作任务,认认真真地兑现竟职报告时对上级组织、本级
组织及全体地税干部所做出的承诺。现将任职三年的工作述职如
下:
一、强化政治理论和税务知识学习,与时俱进。
坚持用邓小平理论、“三个代表”重要思想和科学发展观
指导稽查工作,与时俱进。无论工作多忙,我都尽量做到新闻必看、法规必学、两刊(《国税务》和《国税务研究》)必读,用以认清形势和汲取新鲜经验,提高政治理论和税收政策法律水平,改进
领
(2) 清洁厕所常用盐酸,为什么不用较安全的醋酸?
因为盐酸的去污能力比醋酸强。
等浓度的盐酸、醋酸溶液中的H+浓度的大小?
醋酸和盐酸是常见的两种酸,根据你的经
验,你认为它们的电离程度有无差异?
你能设计实验验证你的猜想吗?请写出实
验方案并与大家交流。
实验探究1:
分别实验等体积、等浓度的盐酸、醋酸与等量镁条的反应。
【实验要点】
盐酸和醋酸浓度均为1mol/L;
镁条用砂纸打磨、长度相同(表面积相同);
观察、比较气球鼓起的快慢等现象。
镁与等浓度的盐酸、醋酸反应
的速率, 前者快于后者。
镁与盐酸反应非常剧烈,产生大量的气泡,气球鼓起很快。
等浓度的盐酸中c(H+)比醋酸大.
镁与醋酸反应较快,产生气泡,
气球鼓起较慢。
实验探究2:
用pH试纸测定0.1mol/L的盐酸、醋酸pH.
【实验数据】 pH(HCl) = 1
pH(CH3COOH) = 3
【数据处理】
【结 论】
盐酸完全电离, 电离程度(即电离度)为100%;
醋酸不完全电离, 电离程度较小,且小于100%,
即醋酸的电离是可逆的。
0.1mol/LHCl c(H+) = 0.1mol/L
0.1mol/LCH3COOH c(H+) = 0.001mol/L
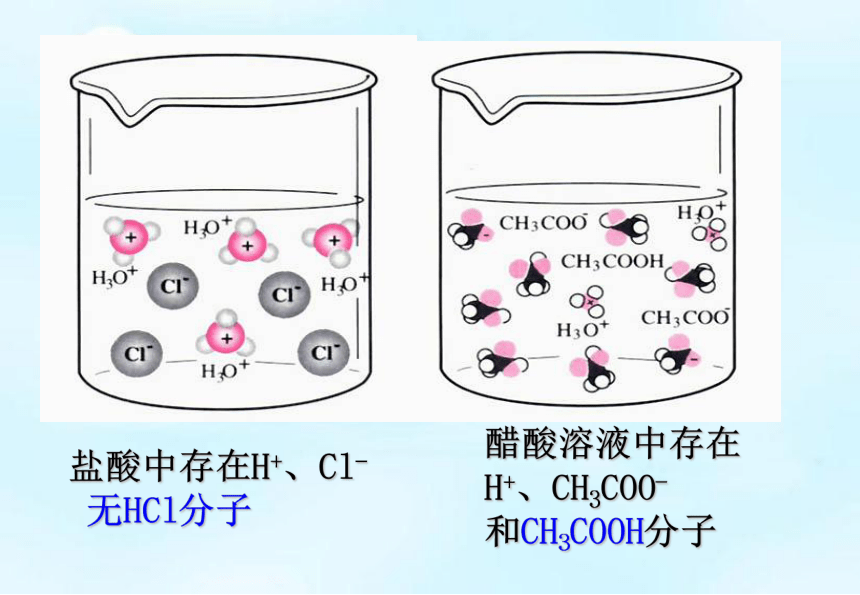
盐酸中存在H+、Cl-
无HCl分子
醋酸溶液中存在
H+、CH3COO-
和CH3COOH分子
强电解质:
包括:强酸、强碱、大多数盐类
包括: 弱酸 (如CH3COOH)、
弱碱 (如NH3·H2O) 、水
HCl = H+ + Cl–
能全部电离的电解质称强电解质.
不完全电离的电解质称弱电解质.
CH3COOH H+ + CH3COO–
弱电解质:
1、概念
一、强弱电解质
2.强电解质与弱电解质的比较
完全电离
部分电离
离子
分子、离子
强酸、强碱、多数盐、
活泼金属氧化物
弱酸、弱碱、水
电离方程式用“ ”
电离方程式用 “=”
在水溶液中或熔化状态下都能电离。
盐酸与醋酸在水中的电离示意图
观察两种溶液中溶质微粒有多少种?
盐酸在水中的电离示意图
醋酸在水中的电离示意图
【说明】HCl分子在水中完全电离
醋酸分子在水中部分电离
思考与交流:
(1)当醋酸溶于水后, V(电离)和 V(结合) 怎样变化?
CH3COOH CH3COO - + H+
二、弱电解质的电离平衡
(2) 当V(电离) = V(结合) 时,可逆过程达到一种怎样的状态?请画出V~t图。
CH3COO - + H+ → CH3COOH
CH3COOH → CH3COO - + H+
V(速率)
t (时间)
V电离
V结合
V电离=V结合≠ 0
t1
电离平衡状态
弱电解质电离的V-t图像
在一定条件下(如温度、浓度等)的弱电解质的溶液中,
弱电解质分子电离成离子的速率和离子重新结合成分子的速率相等,
溶液中各分子、离子的浓度保持不变的状态。
前提
实质
标志
1、定 义:
2、特 点:
电离平衡是一种动态平衡
条件不变,溶液中各分子、离子的浓度不变,溶液里既有离子又有分子
条件改变时,电离平衡发生移动。
弱电解质的电离是可逆过程
V电离=V结合≠0
①逆:
②动:
③等: ④定:
⑤变:
0
0
最大
最大
0
不变
不变
不变
最大
达到电离平衡时
思考与交流(教材p41)
下列几种情况能否引起电离平衡移动?
向哪个方向移动?
①加热 ②加氨气 ③水
④ NH4Cl固体 ⑤NaOH溶液
⑥加HCl气体 ⑦加压
【思考与讨论】
NH3·H2O NH4 + + OH -
(1)内因:电解质自身性质
(2)外因:
①温度:弱电解质的电离为吸热,升温有利于电离
②浓度: 稀释溶液促进电离。
③其他条件:
a、加入与弱电解质具有相同离子的强电解质,将 抑制弱电解质的电离;
b、加入能与弱电解质电离产生的某种离子反应的物 质时,可以使电离平衡向电离方向移动
4.影响因素:
5.电离方程式的书写
(1)强电解质电离 ,不可逆, 用“ = ”号。
弱电解质电离,可逆, 用“ ”号。
(2)多元弱酸分步电离;多元弱碱一步电离
如:
(3)注意原子守恒和电荷守恒
随堂练习:
1.请写出下列物质在水溶液中的电离方程式。
①H2SO4 ②H2CO3 ③NaHCO3
④NaHSO4 ⑤HClO ⑥Cu(OH)2
2.对于0.1mol/L CH3COOH溶液,下列叙述正确的是( B )
A、加入水时,平衡逆反应方向移动
B、加入少量的NaOH固体,平衡向正反应方向移动
C、加入少量0.1 mol/L HCl溶液,溶液中C(H+)减少
D、加入少量CH3COONa 固体,平衡向正反应方向移动
讨论完成表格:
CH3COOH CH3COO-- + H+
正向
增大
增大
减小
逆向
增大
减小
增大
正向
减小
增大
减小
逆向
减小
增大
增大
正向
增大
增大
增大
正向
减小
减小
减小
增大
减小
增大
增大
减小
减小
第三章 水溶液中的离子平衡
第一节 弱电解质的电离
知识回顾:
电解质:
非电解质:
在水溶液中或熔融状态时能够导电的化合物。
在水溶液中和熔融状态时都不能导电的化合物。
①NaCl溶液 ②NaOH ③HCl
④Cu ⑤CH3COOH ⑥NH3·H2O
⑦CO2 ⑧乙醇 ⑨水
⑦⑧
市地税稽查局长述职工作汇报
各位领导、同志们:
20xx年10月,在市局党组和全体地税干部的真情支持下,我有
幸被**地税局聘任担任廉江市地方税务局稽查局长局长职务。这些
年来,在市局党组和上级稽查局的正确领导下,在机关各职能部门和基
层各单位领导配合帮助下,特别是在分管稽查市局副局长具体领导下,
认真履行稽查局长职责, 以科学发展观和构建和谐社会重要思想为
指导,围绕廉江地税工作心,以努力实现、全力履行稽查工作职
责为主题,以查处税收违法案件和组织税收专项检查为重点,完善
稽查制度,强化稽查管理工作,创新稽查工作方式,全局上下团结
奋进,开拓创新,做大量扎实、细致的工作,比较园满地完成了局
党组交给的工作任务,认认真真地兑现竟职报告时对上级组织、本级
组织及全体地税干部所做出的承诺。现将任职三年的工作述职如
下:
一、强化政治理论和税务知识学习,与时俱进。
坚持用邓小平理论、“三个代表”重要思想和科学发展观
指导稽查工作,与时俱进。无论工作多忙,我都尽量做到新闻必看、法规必学、两刊(《国税务》和《国税务研究》)必读,用以认清形势和汲取新鲜经验,提高政治理论和税收政策法律水平,改进
领
(2) 清洁厕所常用盐酸,为什么不用较安全的醋酸?
因为盐酸的去污能力比醋酸强。
等浓度的盐酸、醋酸溶液中的H+浓度的大小?
醋酸和盐酸是常见的两种酸,根据你的经
验,你认为它们的电离程度有无差异?
你能设计实验验证你的猜想吗?请写出实
验方案并与大家交流。
实验探究1:
分别实验等体积、等浓度的盐酸、醋酸与等量镁条的反应。
【实验要点】
盐酸和醋酸浓度均为1mol/L;
镁条用砂纸打磨、长度相同(表面积相同);
观察、比较气球鼓起的快慢等现象。
镁与等浓度的盐酸、醋酸反应
的速率, 前者快于后者。
镁与盐酸反应非常剧烈,产生大量的气泡,气球鼓起很快。
等浓度的盐酸中c(H+)比醋酸大.
镁与醋酸反应较快,产生气泡,
气球鼓起较慢。
实验探究2:
用pH试纸测定0.1mol/L的盐酸、醋酸pH.
【实验数据】 pH(HCl) = 1
pH(CH3COOH) = 3
【数据处理】
【结 论】
盐酸完全电离, 电离程度(即电离度)为100%;
醋酸不完全电离, 电离程度较小,且小于100%,
即醋酸的电离是可逆的。
0.1mol/LHCl c(H+) = 0.1mol/L
0.1mol/LCH3COOH c(H+) = 0.001mol/L
盐酸中存在H+、Cl-
无HCl分子
醋酸溶液中存在
H+、CH3COO-
和CH3COOH分子
强电解质:
包括:强酸、强碱、大多数盐类
包括: 弱酸 (如CH3COOH)、
弱碱 (如NH3·H2O) 、水
HCl = H+ + Cl–
能全部电离的电解质称强电解质.
不完全电离的电解质称弱电解质.
CH3COOH H+ + CH3COO–
弱电解质:
1、概念
一、强弱电解质
2.强电解质与弱电解质的比较
完全电离
部分电离
离子
分子、离子
强酸、强碱、多数盐、
活泼金属氧化物
弱酸、弱碱、水
电离方程式用“ ”
电离方程式用 “=”
在水溶液中或熔化状态下都能电离。
盐酸与醋酸在水中的电离示意图
观察两种溶液中溶质微粒有多少种?
盐酸在水中的电离示意图
醋酸在水中的电离示意图
【说明】HCl分子在水中完全电离
醋酸分子在水中部分电离
思考与交流:
(1)当醋酸溶于水后, V(电离)和 V(结合) 怎样变化?
CH3COOH CH3COO - + H+
二、弱电解质的电离平衡
(2) 当V(电离) = V(结合) 时,可逆过程达到一种怎样的状态?请画出V~t图。
CH3COO - + H+ → CH3COOH
CH3COOH → CH3COO - + H+
V(速率)
t (时间)
V电离
V结合
V电离=V结合≠ 0
t1
电离平衡状态
弱电解质电离的V-t图像
在一定条件下(如温度、浓度等)的弱电解质的溶液中,
弱电解质分子电离成离子的速率和离子重新结合成分子的速率相等,
溶液中各分子、离子的浓度保持不变的状态。
前提
实质
标志
1、定 义:
2、特 点:
电离平衡是一种动态平衡
条件不变,溶液中各分子、离子的浓度不变,溶液里既有离子又有分子
条件改变时,电离平衡发生移动。
弱电解质的电离是可逆过程
V电离=V结合≠0
①逆:
②动:
③等: ④定:
⑤变:
0
0
最大
最大
0
不变
不变
不变
最大
达到电离平衡时
思考与交流(教材p41)
下列几种情况能否引起电离平衡移动?
向哪个方向移动?
①加热 ②加氨气 ③水
④ NH4Cl固体 ⑤NaOH溶液
⑥加HCl气体 ⑦加压
【思考与讨论】
NH3·H2O NH4 + + OH -
(1)内因:电解质自身性质
(2)外因:
①温度:弱电解质的电离为吸热,升温有利于电离
②浓度: 稀释溶液促进电离。
③其他条件:
a、加入与弱电解质具有相同离子的强电解质,将 抑制弱电解质的电离;
b、加入能与弱电解质电离产生的某种离子反应的物 质时,可以使电离平衡向电离方向移动
4.影响因素:
5.电离方程式的书写
(1)强电解质电离 ,不可逆, 用“ = ”号。
弱电解质电离,可逆, 用“ ”号。
(2)多元弱酸分步电离;多元弱碱一步电离
如:
(3)注意原子守恒和电荷守恒
随堂练习:
1.请写出下列物质在水溶液中的电离方程式。
①H2SO4 ②H2CO3 ③NaHCO3
④NaHSO4 ⑤HClO ⑥Cu(OH)2
2.对于0.1mol/L CH3COOH溶液,下列叙述正确的是( B )
A、加入水时,平衡逆反应方向移动
B、加入少量的NaOH固体,平衡向正反应方向移动
C、加入少量0.1 mol/L HCl溶液,溶液中C(H+)减少
D、加入少量CH3COONa 固体,平衡向正反应方向移动
讨论完成表格:
CH3COOH CH3COO-- + H+
正向
增大
增大
减小
逆向
增大
减小
增大
正向
减小
增大
减小
逆向
减小
增大
增大
正向
增大
增大
增大
正向
减小
减小
减小
增大
减小
增大
增大
减小
减小
