鲁教版(五四制)化学九年级全册第一单元 溶液溶液单元复习课件(21张PPT)
文档属性
| 名称 | 鲁教版(五四制)化学九年级全册第一单元 溶液溶液单元复习课件(21张PPT) |  | |
| 格式 | ppt | ||
| 文件大小 | 2.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版(五四学制) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-03-07 17:20:39 | ||
图片预览






文档简介
(共21张PPT)
鲁教版义务教育教科书九年级化学
《溶液 》复习课
学化学 用化学
实验技能考试完毕后,在整理回收药品的时候,老师发现了三只烧杯的标签脱落了,它们可能是“回收稀盐酸”、“4%的氯化钠溶液”、“蒸馏水”,你有办法识别它们吗?
甲
乙
丙
复习目标
1.通过复习,进一步理解溶液的概念、组成、基本特性、微观过程及能量变化,知道乳化现象,认识饱和溶液不饱和溶液的概念及相互转化条件。
2.通过复习,进一步理解溶液组成的定量表示及相关计算。
3.通过复习,进一步认识定量表示溶解性的方法—溶解度及其影响因素,会使用溶解度曲线并能判断结晶的方法及使用对象。
4.通过复习,熟悉研究物质的一般过程:从定性研究到定量研究,学会从微粒的角度分析身边的物质及其变化,构建微粒观。
再识溶液
学习任务一
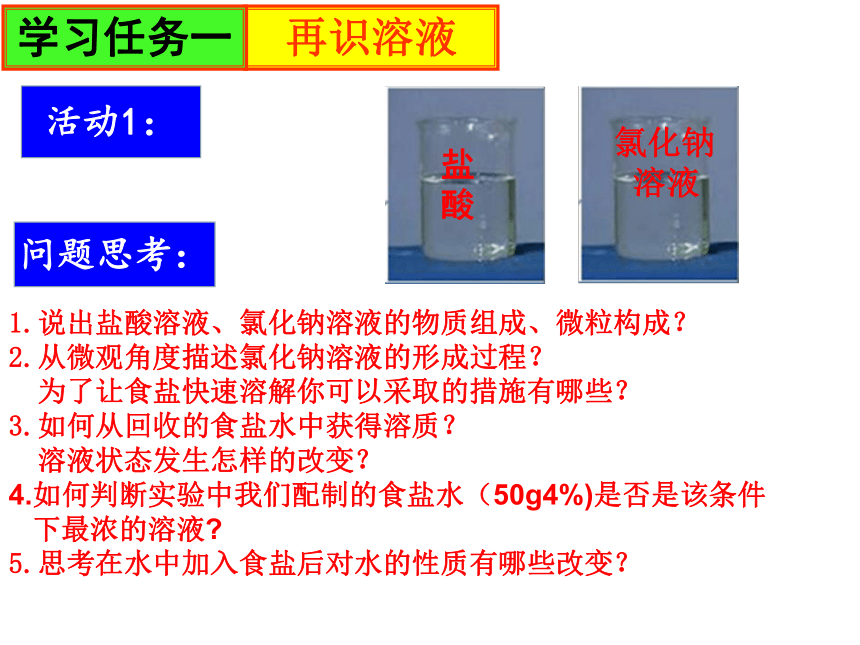
1.说出盐酸溶液、氯化钠溶液的物质组成、微粒构成?
2.从微观角度描述氯化钠溶液的形成过程?
为了让食盐快速溶解你可以采取的措施有哪些?
3.如何从回收的食盐水中获得溶质?
溶液状态发生怎样的改变?
4.如何判断实验中我们配制的食盐水(50g4%)是否是该条件
下最浓的溶液
5.思考在水中加入食盐后对水的性质有哪些改变?
盐酸
氯化钠
溶液
活动1:
问题思考:
再识溶液
学习任务一
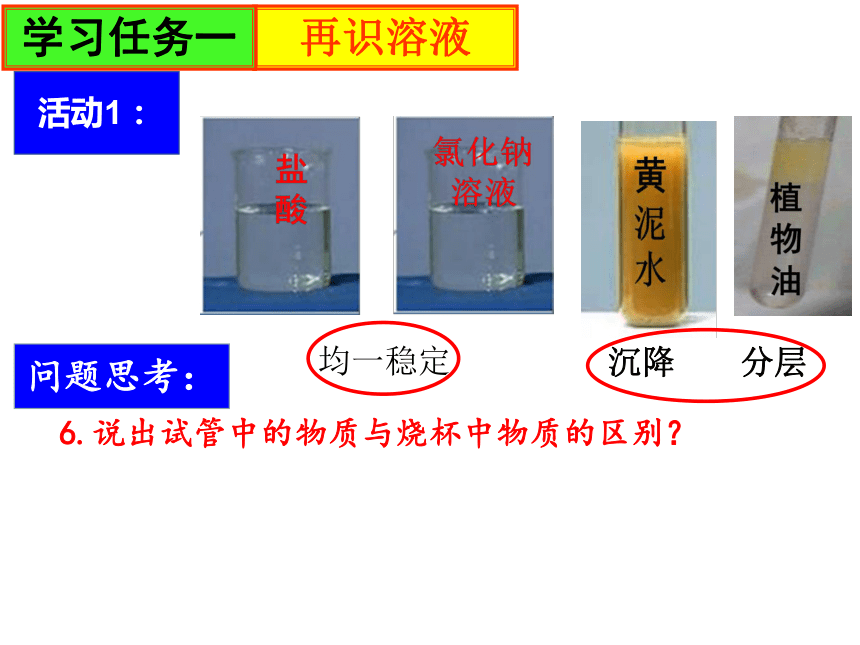
6.说出试管中的物质与烧杯中物质的区别?
活动1:
问题思考:
沉降 分层
均一稳定
再识溶液
学习任务一
1、大雪纷飞,环卫工人在忙着往公路上撒融雪剂(主要是含氯离子的盐),目的是加快冰雪融化,防止道路结冰,原理是 。
2、某混合物其组成特点是“各成分彼此完全混合,处处相同”,这种混合物不可能是
A食盐水 B、黄泥水 C、空气 D、不锈钢
3、溶液是一种重要的混合物,下列有关溶液的说法正确的是
A溶液具有均一性和稳定性,因为溶液中的各种粒子保持静止状态
B、饱和溶液是一定温度下不能再溶解该物质的溶液
C、不饱和溶液通过降低温度一定变成饱和溶液
D、一种物质分散到另一种物质里一定能形成溶液
链接中考
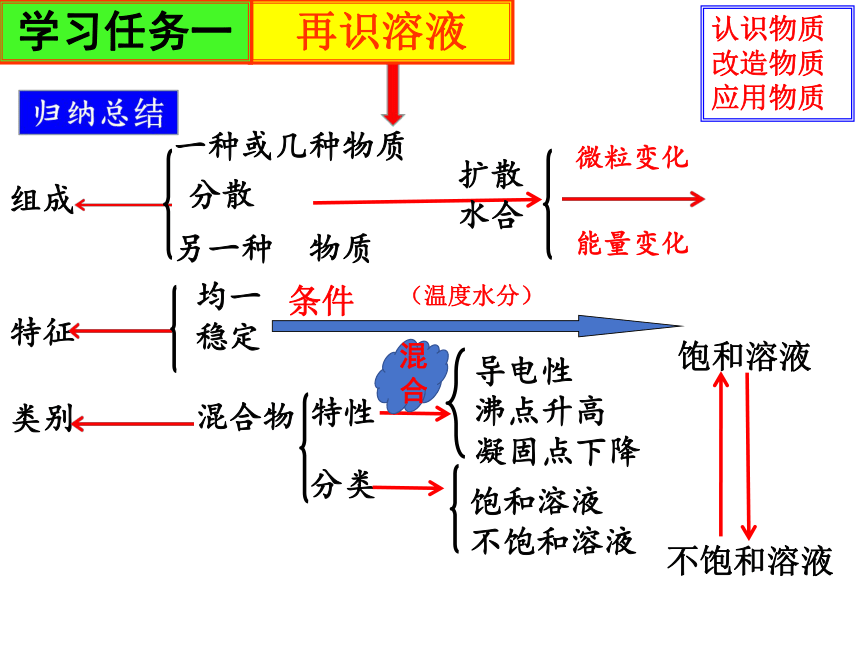
一种或几种物质
分散
另一种 物质
均一
稳定
混合物
类别
特征
组成
扩散
水合
特性
分类
再识溶液
学习任务一
导电性
沸点升高
凝固点下降
饱和溶液
不饱和溶液
微粒变化
能量变化
混合
饱和溶液
不饱和溶液
条件
认识物质
改造物质
应用物质
(温度水分)
溶液组成的定量
学习任务二
溶液组成的定量表示
学习任务二
活动2:
1、实验时我们配制的4%的食盐水能够给病人进行生理盐水的注射?
2、实验时我们用到的稀盐酸是用浓盐酸和水按照体积比1:3进行配制的,你能计算出配好后稀盐酸的溶质质量分数么?(已知:浓盐酸的溶质质量分数为37%,密度为1.179g/cm 3 、 水的密度为1g/cm3,只需列出计算式,不求结果)
实验用品:75%酒精溶液、蒸馏水、小烧杯、胶头滴管、量筒(20 mL、10 mL)、蒸发皿、玻璃棒、火柴。
(1)实验时,用75%酒精溶液配制IO mL60%的酒精溶液。
①最好选用___ mL量简,使周量筒量取液体读数时应注意 。
②配制该溶液的操作方法是________。
溶液组成的定量表示
学习任务二
链接中考
归纳总结
溶液组成的定量表示
学习任务二
溶液组成
体积分数
质量分数
定量表示
定性表示——溶质、溶剂
溶液配制
计算——用数学方法解决化学问题
实验 称量(量取)
溶解(稀释)
贴标签保存(药品名称,质量分数)
定性定量表示物质的溶解性
学习任务三
活动3:
1.粗盐提纯的实验中,我们看到食盐易溶于水,而泥沙难溶于水,不同物质在同一溶剂中的溶解性不同,物质的溶解性受哪些因素的影响?
2.二氧化碳的性质与制取实验中,收集二氧化碳用了向上排空气法,为什么不用排水法?
3.如何定性描述固体物质的溶解性?分类依据是什么?
4. 定量表示某种物质在某种溶剂中的溶解性的量是什么?
定性定量表示物质的溶解性
学习任务三
活动3:
5.影响固体物质溶解度的因素? 影响气体溶解度的因素?
6.表示物质溶解度随温度变化而变化的方法有哪些?
7.已知20℃时氯化钠的溶解度为36g,那么20℃时能否配得质量分数为27%的食盐水?
定性定量表示物质的溶解性
学习任务三
20℃ 40℃
水 109g 129g
酒精 17.3g 40g
1.小龙同学在工具书中查到NaOH在水和酒精中的溶解度
(见下表)。通过分析她得出以下结论,其中不正确的是
A.温度和溶剂种类对NaOH的溶觯度都有影响
B.NaOH易溶于水,也易溶于酒精
C.40℃,40 gNaOH溶解在l00 g酒精中达到饱和
D.将等质量40℃的饱和NaOH水溶液和饱和NaOH
酒精溶液降温至20C,析出的晶体前者比后者多
链接中考
定性定量表示物质的溶解性
学习任务三
2.下列关于溶解度的说法,不正确的是
A.溶解度能够表示物质溶解性的强弱程度
B.溶解度能够表示溶质在溶剂中溶解的程度
C.溶解度能够表示某种物质在某种溶剂中的溶解限量
D.在相同温度、相同溶剂的条件下,要判断不同物质的溶解度相对大小,可以根据其饱和溶液的溶质质量分数
3.一定温度下,一定质量的氢氧化钠固体溶于水制成溶液。下列有关的量不随水的质量改变而改变的是
A.溶液质量分数 B.溶液的pH
C.氢氧化钠的溶解度 D.最多能吸收二氧化碳的质量
链接中考
问题思考
定性定量表示物质的溶解性
学习任务三
物质溶解性
定性表示
定量表示
气体
固体
压强
温度
前提
标准
状态
单位
表示
方法
列表法
曲线法
归纳总结
结晶方法
适用对象
易溶、可溶、微溶、难溶
学习溶液的意义及其用途
学习任务四
问题思考
1、日常生活生产中我们运用混合这种方法对物质进行创造和生产的事例有很多,你能列举几种么?
2、利用温度对溶解度的影响不同进行混合物的分离提纯,若硝酸钾中混有氯化钠,可以用的分离方法是?
总结提升
溶液
研究物质的
一般过程
科学方法
定性与定量
宏观与微观
定量实验的作用、
方法、注意事项
从定性到定量
本单元的作用
从微观角度分析物质及其变化
设计实验方案、控制实验条件、观察图表
实验方法
承上启下
化学理念
构建本单元知识的思维导图
回顾提高
达标检测
盘点收获
1、③⑥ Ca(OH)2 CuSO4
2、D
3、C
4、(1)甲
(2)N,30℃时MN的溶解度相等
完成学案中的问题解答:
课后作业
1.完善本单元的思维导图
2.完成学案问题的巩固
鲁教版义务教育教科书九年级化学
《溶液 》复习课
学化学 用化学
实验技能考试完毕后,在整理回收药品的时候,老师发现了三只烧杯的标签脱落了,它们可能是“回收稀盐酸”、“4%的氯化钠溶液”、“蒸馏水”,你有办法识别它们吗?
甲
乙
丙
复习目标
1.通过复习,进一步理解溶液的概念、组成、基本特性、微观过程及能量变化,知道乳化现象,认识饱和溶液不饱和溶液的概念及相互转化条件。
2.通过复习,进一步理解溶液组成的定量表示及相关计算。
3.通过复习,进一步认识定量表示溶解性的方法—溶解度及其影响因素,会使用溶解度曲线并能判断结晶的方法及使用对象。
4.通过复习,熟悉研究物质的一般过程:从定性研究到定量研究,学会从微粒的角度分析身边的物质及其变化,构建微粒观。
再识溶液
学习任务一
1.说出盐酸溶液、氯化钠溶液的物质组成、微粒构成?
2.从微观角度描述氯化钠溶液的形成过程?
为了让食盐快速溶解你可以采取的措施有哪些?
3.如何从回收的食盐水中获得溶质?
溶液状态发生怎样的改变?
4.如何判断实验中我们配制的食盐水(50g4%)是否是该条件
下最浓的溶液
5.思考在水中加入食盐后对水的性质有哪些改变?
盐酸
氯化钠
溶液
活动1:
问题思考:
再识溶液
学习任务一
6.说出试管中的物质与烧杯中物质的区别?
活动1:
问题思考:
沉降 分层
均一稳定
再识溶液
学习任务一
1、大雪纷飞,环卫工人在忙着往公路上撒融雪剂(主要是含氯离子的盐),目的是加快冰雪融化,防止道路结冰,原理是 。
2、某混合物其组成特点是“各成分彼此完全混合,处处相同”,这种混合物不可能是
A食盐水 B、黄泥水 C、空气 D、不锈钢
3、溶液是一种重要的混合物,下列有关溶液的说法正确的是
A溶液具有均一性和稳定性,因为溶液中的各种粒子保持静止状态
B、饱和溶液是一定温度下不能再溶解该物质的溶液
C、不饱和溶液通过降低温度一定变成饱和溶液
D、一种物质分散到另一种物质里一定能形成溶液
链接中考
一种或几种物质
分散
另一种 物质
均一
稳定
混合物
类别
特征
组成
扩散
水合
特性
分类
再识溶液
学习任务一
导电性
沸点升高
凝固点下降
饱和溶液
不饱和溶液
微粒变化
能量变化
混合
饱和溶液
不饱和溶液
条件
认识物质
改造物质
应用物质
(温度水分)
溶液组成的定量
学习任务二
溶液组成的定量表示
学习任务二
活动2:
1、实验时我们配制的4%的食盐水能够给病人进行生理盐水的注射?
2、实验时我们用到的稀盐酸是用浓盐酸和水按照体积比1:3进行配制的,你能计算出配好后稀盐酸的溶质质量分数么?(已知:浓盐酸的溶质质量分数为37%,密度为1.179g/cm 3 、 水的密度为1g/cm3,只需列出计算式,不求结果)
实验用品:75%酒精溶液、蒸馏水、小烧杯、胶头滴管、量筒(20 mL、10 mL)、蒸发皿、玻璃棒、火柴。
(1)实验时,用75%酒精溶液配制IO mL60%的酒精溶液。
①最好选用___ mL量简,使周量筒量取液体读数时应注意 。
②配制该溶液的操作方法是________。
溶液组成的定量表示
学习任务二
链接中考
归纳总结
溶液组成的定量表示
学习任务二
溶液组成
体积分数
质量分数
定量表示
定性表示——溶质、溶剂
溶液配制
计算——用数学方法解决化学问题
实验 称量(量取)
溶解(稀释)
贴标签保存(药品名称,质量分数)
定性定量表示物质的溶解性
学习任务三
活动3:
1.粗盐提纯的实验中,我们看到食盐易溶于水,而泥沙难溶于水,不同物质在同一溶剂中的溶解性不同,物质的溶解性受哪些因素的影响?
2.二氧化碳的性质与制取实验中,收集二氧化碳用了向上排空气法,为什么不用排水法?
3.如何定性描述固体物质的溶解性?分类依据是什么?
4. 定量表示某种物质在某种溶剂中的溶解性的量是什么?
定性定量表示物质的溶解性
学习任务三
活动3:
5.影响固体物质溶解度的因素? 影响气体溶解度的因素?
6.表示物质溶解度随温度变化而变化的方法有哪些?
7.已知20℃时氯化钠的溶解度为36g,那么20℃时能否配得质量分数为27%的食盐水?
定性定量表示物质的溶解性
学习任务三
20℃ 40℃
水 109g 129g
酒精 17.3g 40g
1.小龙同学在工具书中查到NaOH在水和酒精中的溶解度
(见下表)。通过分析她得出以下结论,其中不正确的是
A.温度和溶剂种类对NaOH的溶觯度都有影响
B.NaOH易溶于水,也易溶于酒精
C.40℃,40 gNaOH溶解在l00 g酒精中达到饱和
D.将等质量40℃的饱和NaOH水溶液和饱和NaOH
酒精溶液降温至20C,析出的晶体前者比后者多
链接中考
定性定量表示物质的溶解性
学习任务三
2.下列关于溶解度的说法,不正确的是
A.溶解度能够表示物质溶解性的强弱程度
B.溶解度能够表示溶质在溶剂中溶解的程度
C.溶解度能够表示某种物质在某种溶剂中的溶解限量
D.在相同温度、相同溶剂的条件下,要判断不同物质的溶解度相对大小,可以根据其饱和溶液的溶质质量分数
3.一定温度下,一定质量的氢氧化钠固体溶于水制成溶液。下列有关的量不随水的质量改变而改变的是
A.溶液质量分数 B.溶液的pH
C.氢氧化钠的溶解度 D.最多能吸收二氧化碳的质量
链接中考
问题思考
定性定量表示物质的溶解性
学习任务三
物质溶解性
定性表示
定量表示
气体
固体
压强
温度
前提
标准
状态
单位
表示
方法
列表法
曲线法
归纳总结
结晶方法
适用对象
易溶、可溶、微溶、难溶
学习溶液的意义及其用途
学习任务四
问题思考
1、日常生活生产中我们运用混合这种方法对物质进行创造和生产的事例有很多,你能列举几种么?
2、利用温度对溶解度的影响不同进行混合物的分离提纯,若硝酸钾中混有氯化钠,可以用的分离方法是?
总结提升
溶液
研究物质的
一般过程
科学方法
定性与定量
宏观与微观
定量实验的作用、
方法、注意事项
从定性到定量
本单元的作用
从微观角度分析物质及其变化
设计实验方案、控制实验条件、观察图表
实验方法
承上启下
化学理念
构建本单元知识的思维导图
回顾提高
达标检测
盘点收获
1、③⑥ Ca(OH)2 CuSO4
2、D
3、C
4、(1)甲
(2)N,30℃时MN的溶解度相等
完成学案中的问题解答:
课后作业
1.完善本单元的思维导图
2.完成学案问题的巩固
同课章节目录
- 第一单元 溶液
- 1 溶液的形成
- 2 溶液组成的定量表示
- 3物质的溶解性
- 到实验室去:配制一定溶质质量分数的溶液
- 第二单元 常见的酸和碱
- 1 酸及其性质
- 2 碱及其性质
- 3 溶液的酸碱性
- 4 酸碱中和反应
- 到实验室去:探究酸和碱的化学性质
- 到图书馆去:分子变成离子
- 第三单元 海水中的化学
- 1 海洋化学资源
- 2 海水“晒盐”
- 3 海水“制碱”
- 到实验室去:粗盐中难溶性杂质的去除
- 第四单元 金属
- 1 常见的金属材料
- 2 金属的化学性质
- 3 钢铁的锈蚀与防护
- 到实验室去:探究金属的性质
- 第五单元 化学与健康
- 1 食物中的有机物
- 2 化学元素与人体健康
- 3 远离有毒物质
- 第六单元 化学与社会发展
- 1 化学与能源开发
- 2 化学与材料研制
- 3 化学与农业生产
- 4 化学与环境保护
