到实验室去:粗盐中难溶性杂质的去除 课件(17张PPT)
文档属性
| 名称 | 到实验室去:粗盐中难溶性杂质的去除 课件(17张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 743.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版(五四学制) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-03-07 18:03:43 | ||
图片预览






文档简介
(共17张PPT)
实验活动
粗盐
精盐
1.体验固体混合物初步提纯的实验过程。
2.学习蒸发操作技能,巩固溶解、过滤操作技能。
【思考】
粗盐中含有可溶性杂质(MgCl2,CaCl2等)和不溶性杂质(泥沙等),要将粗盐初步提纯,可以通过什么方法将不溶性杂质——泥沙除去呢?
除去粗盐中泥沙的方法主要是:
过滤法
从滤液中提取氯化钠的方法是:
蒸发结晶
粗盐提纯的操作步骤
①溶解
②过滤
③蒸发
④计算产率
选择实验用品:
1.溶解仪器:
2.过滤仪器:
3.蒸发仪器:
4.其他实验用品:
托盘天平、药匙、 烧杯、 玻璃棒、 量筒(10mL)、 胶头滴管
铁架台(带铁圈)、漏斗、(烧杯、 玻璃棒)
蒸发皿、坩埚钳、酒精灯、(玻璃棒)
粗盐、水、火柴
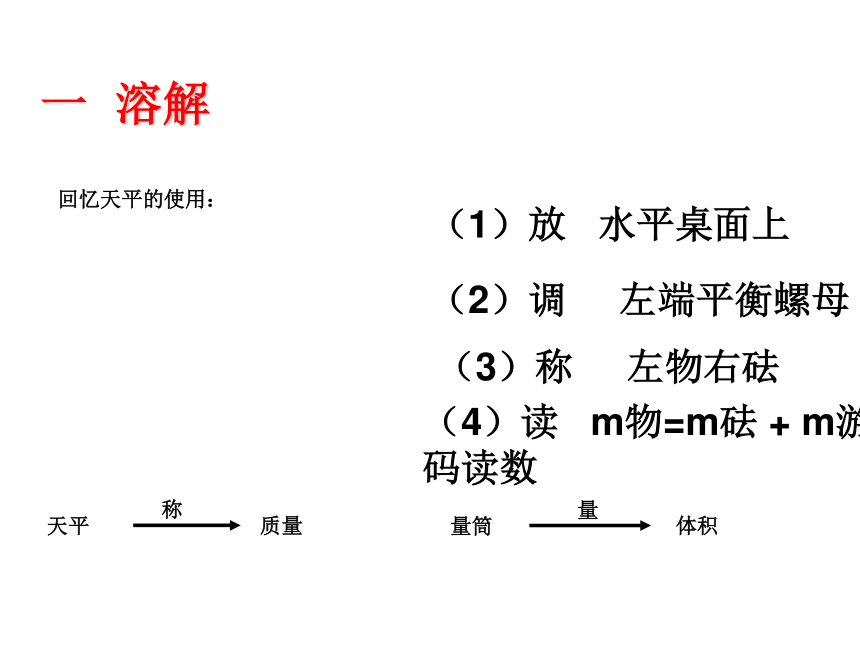
回忆天平的使用:
(1)放 水平桌面上
(2)调 左端平衡螺母
(3)称 左物右砝
(4)读 m物=m砝 + m游码读数
体积
质量
量
量筒
一 溶解
用托盘天平称取3.0 g粗盐。用量筒量取 ____mL水倒入烧杯中。将称取的粗盐逐渐加入烧杯里的水中,并用玻璃棒不断搅拌,直至粗盐不再溶解为止。称量剩余的粗盐。
【思考】溶解操作应该注意什么?
1、粗盐一次不宜加的太多,以免加多了溶解不了。
2、溶解搅拌时,应控制玻璃棒,尽量不要碰烧杯壁。
滤纸紧贴漏斗
滤纸边缘比
漏斗口稍低
滤液液面低于
滤纸的边缘
烧杯嘴靠玻璃棒
玻璃棒靠
三层滤纸
漏斗末端靠
烧杯内壁
二 过滤(复习巩固)
三、蒸发 蒸发操作应该注意什么?
1.蒸发皿应放在铁圈上,停止加热时,不要立即把蒸发皿直接放在实验台上,以免烫坏实验台。
2.加热过程中,用玻璃棒不断搅动,防止由于局部温度过高,造成液滴飞溅。
3.当蒸发皿中出现较多量固体时,即停止加热,利用余热使滤液蒸干。
四、计算产率
用玻璃棒把固体转移到纸上,并计算精盐的产率
精盐的产率=精盐的质量/溶解的粗盐质量
??
溶解粗盐/g 精盐/g 精盐产率/﹪
实践 : (看看哪组最棒)
各小组同心协力,把粗盐中难溶性杂质去除,并完成学案。(注意操作规范)
(1)溶解 (2)过滤 (3)蒸发 (4)计算产率
偏低的原因:
偏高的原因:
溶解时未充分溶解;过滤时有液体洒落;蒸发时液体(或盐粒)溅出蒸发皿;转移固体时氯化钠可能洒出等
称量时称多了;蒸发时未蒸干等。
①溶解
②过滤
③蒸发
三次使用玻璃棒的作用
①溶解:搅拌,加速溶解
②过滤:引流,防止液体溅出
③蒸发:搅拌,防止液滴飞溅
④转移时玻璃棒是将固体转移到滤纸上的作用。
【思考】粗盐提纯中:溶解、过滤、蒸发操作都用到了玻璃棒,玻璃棒分别起了什么作用?
④
计
算
产
率
粗盐溶液过滤后,如果滤液仍然浑浊,可能是什么原因?
1、滤纸破损。
2、过滤时,漏斗内的液面高于滤纸的边缘。
3、承接滤液的烧杯不干净。
粗盐初步提取后的"精盐"是我们的食用盐吗?
海水?粗盐?精盐?食用盐
粗盐的提纯步骤:
(1)溶解
(2)过滤
(3)蒸发
(4)计算产率
实验活动
粗盐
精盐
1.体验固体混合物初步提纯的实验过程。
2.学习蒸发操作技能,巩固溶解、过滤操作技能。
【思考】
粗盐中含有可溶性杂质(MgCl2,CaCl2等)和不溶性杂质(泥沙等),要将粗盐初步提纯,可以通过什么方法将不溶性杂质——泥沙除去呢?
除去粗盐中泥沙的方法主要是:
过滤法
从滤液中提取氯化钠的方法是:
蒸发结晶
粗盐提纯的操作步骤
①溶解
②过滤
③蒸发
④计算产率
选择实验用品:
1.溶解仪器:
2.过滤仪器:
3.蒸发仪器:
4.其他实验用品:
托盘天平、药匙、 烧杯、 玻璃棒、 量筒(10mL)、 胶头滴管
铁架台(带铁圈)、漏斗、(烧杯、 玻璃棒)
蒸发皿、坩埚钳、酒精灯、(玻璃棒)
粗盐、水、火柴
回忆天平的使用:
(1)放 水平桌面上
(2)调 左端平衡螺母
(3)称 左物右砝
(4)读 m物=m砝 + m游码读数
体积
质量
量
量筒
一 溶解
用托盘天平称取3.0 g粗盐。用量筒量取 ____mL水倒入烧杯中。将称取的粗盐逐渐加入烧杯里的水中,并用玻璃棒不断搅拌,直至粗盐不再溶解为止。称量剩余的粗盐。
【思考】溶解操作应该注意什么?
1、粗盐一次不宜加的太多,以免加多了溶解不了。
2、溶解搅拌时,应控制玻璃棒,尽量不要碰烧杯壁。
滤纸紧贴漏斗
滤纸边缘比
漏斗口稍低
滤液液面低于
滤纸的边缘
烧杯嘴靠玻璃棒
玻璃棒靠
三层滤纸
漏斗末端靠
烧杯内壁
二 过滤(复习巩固)
三、蒸发 蒸发操作应该注意什么?
1.蒸发皿应放在铁圈上,停止加热时,不要立即把蒸发皿直接放在实验台上,以免烫坏实验台。
2.加热过程中,用玻璃棒不断搅动,防止由于局部温度过高,造成液滴飞溅。
3.当蒸发皿中出现较多量固体时,即停止加热,利用余热使滤液蒸干。
四、计算产率
用玻璃棒把固体转移到纸上,并计算精盐的产率
精盐的产率=精盐的质量/溶解的粗盐质量
??
溶解粗盐/g 精盐/g 精盐产率/﹪
实践 : (看看哪组最棒)
各小组同心协力,把粗盐中难溶性杂质去除,并完成学案。(注意操作规范)
(1)溶解 (2)过滤 (3)蒸发 (4)计算产率
偏低的原因:
偏高的原因:
溶解时未充分溶解;过滤时有液体洒落;蒸发时液体(或盐粒)溅出蒸发皿;转移固体时氯化钠可能洒出等
称量时称多了;蒸发时未蒸干等。
①溶解
②过滤
③蒸发
三次使用玻璃棒的作用
①溶解:搅拌,加速溶解
②过滤:引流,防止液体溅出
③蒸发:搅拌,防止液滴飞溅
④转移时玻璃棒是将固体转移到滤纸上的作用。
【思考】粗盐提纯中:溶解、过滤、蒸发操作都用到了玻璃棒,玻璃棒分别起了什么作用?
④
计
算
产
率
粗盐溶液过滤后,如果滤液仍然浑浊,可能是什么原因?
1、滤纸破损。
2、过滤时,漏斗内的液面高于滤纸的边缘。
3、承接滤液的烧杯不干净。
粗盐初步提取后的"精盐"是我们的食用盐吗?
海水?粗盐?精盐?食用盐
粗盐的提纯步骤:
(1)溶解
(2)过滤
(3)蒸发
(4)计算产率
同课章节目录
- 第一单元 溶液
- 1 溶液的形成
- 2 溶液组成的定量表示
- 3物质的溶解性
- 到实验室去:配制一定溶质质量分数的溶液
- 第二单元 常见的酸和碱
- 1 酸及其性质
- 2 碱及其性质
- 3 溶液的酸碱性
- 4 酸碱中和反应
- 到实验室去:探究酸和碱的化学性质
- 到图书馆去:分子变成离子
- 第三单元 海水中的化学
- 1 海洋化学资源
- 2 海水“晒盐”
- 3 海水“制碱”
- 到实验室去:粗盐中难溶性杂质的去除
- 第四单元 金属
- 1 常见的金属材料
- 2 金属的化学性质
- 3 钢铁的锈蚀与防护
- 到实验室去:探究金属的性质
- 第五单元 化学与健康
- 1 食物中的有机物
- 2 化学元素与人体健康
- 3 远离有毒物质
- 第六单元 化学与社会发展
- 1 化学与能源开发
- 2 化学与材料研制
- 3 化学与农业生产
- 4 化学与环境保护
