课题2 金属的化学性质 第1课时课件(30张PPT)
文档属性
| 名称 | 课题2 金属的化学性质 第1课时课件(30张PPT) |
|
|
| 格式 | zip | ||
| 文件大小 | 4.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-03-07 00:00:00 | ||
图片预览







文档简介
(共30张PPT)
课题2 金属的化学性质
(第1课时)
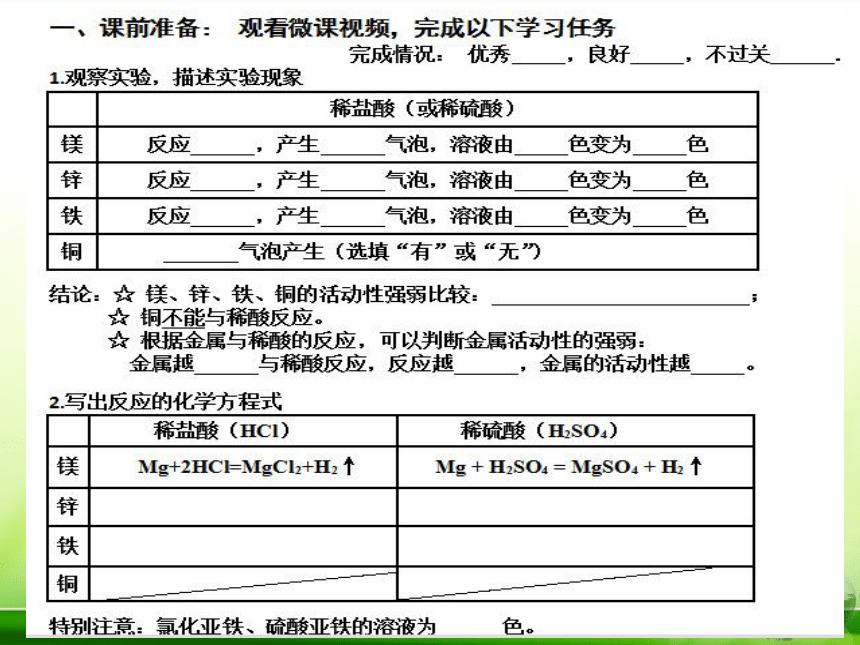
1. 通过自主合作探究,知道镁、铁、铝、铜等常见金属与氧气的反应
2. 通过课前微课导学、课堂实验探究,认识常见金属与盐酸、稀硫酸的反应
3. 通过小组讨论,建构置换反应的概念,并初步学会判断金属活动性的强弱
4. 通过实验探究归纳金属活动性顺序
学习目标
从海昏侯古墓中出土的马蹄金和金饼历经两千多年依然金光闪闪。但是平常出土的金属文物中,铜器表面会有锈迹,铁器锈迹斑斑甚至出土很少。
马蹄金
金 饼
学习活动一 :探究部分金属与氧气的反应
1.知识储备:我们已经知道,镁、铁都能和氧气发生反应
(1) 镁与氧气的反应方程式:2Mg+O2 2MgO,
条件:点燃,现象:发出强烈白光,放热,生成白色固体
(2) 铁与氧气的反应方程式:3Fe+2O2 Fe3O4,
条件:点燃,现象:剧烈燃烧火星四射,放热,生成黑色固体
2.各小组查阅资料,设计方案,探究Mg、Fe、Al、Cu与O2反应的难易。
实验操作 实验现象 结 论
学习成果汇报
探究成果:
在相同条件下,镁、铝、铁、铜与氧气反应从易到难依次是: 。
实验操作 实验现象 结 论
因为有氧化铝的保护,所以铝锅不易生锈。
为什么铝锅不易生锈?
4Al +3O2 = 2Al2O3
思考:铝锅是否适宜用钢丝刷来擦洗?
用钢丝刷来擦洗铝锅会破坏铝锅表面的氧化铝薄膜,
所以铝锅不宜用钢丝刷来擦洗。
2.判断金属活动性强弱的方法一:
(根据金属与氧气反应的难易来判断)
探究成果:在相同条件下,镁、铁、铝、铜与氧气反应从易到难依次是
镁、铝、铁、铜
1.镁、铝、铁、铜、金的金属活动性强弱:
> > >
镁
铁
铜
> 金
铝
学习活动一总结
在相同条件下,金属越容易与氧气反应,它的活动性就越强。
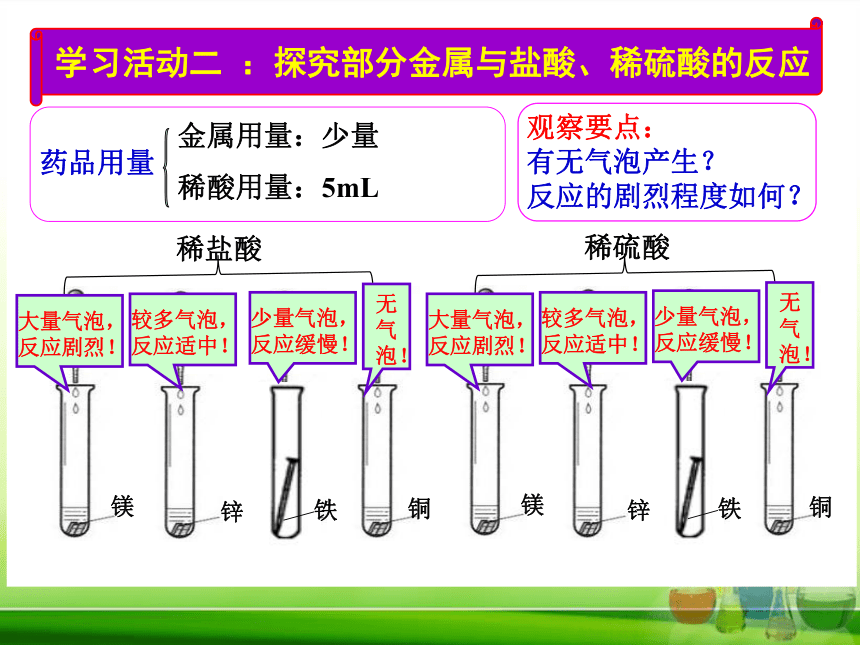
学习活动二 :探究部分金属与盐酸、稀硫酸的反应
观察要点:
有无气泡产生?
反应的剧烈程度如何?
大量气泡,
反应剧烈!
较多气泡,
反应适中!
少量气泡,
反应缓慢!
无
气
泡!
大量气泡,
反应剧烈!
较多气泡,
反应适中!
少量气泡,
反应缓慢!
无
气
泡!
1.镁锌铁铜的金属活动性强弱:
> > >
镁
锌
铁
铜
3.铜不能与稀酸反应
2.判断金属活动性强弱的方法二:
(根据金属与稀酸反应的剧烈程度判断)
在相同条件下,金属与稀酸反应越剧烈,
它的活动性就越强。
学习活动二总结
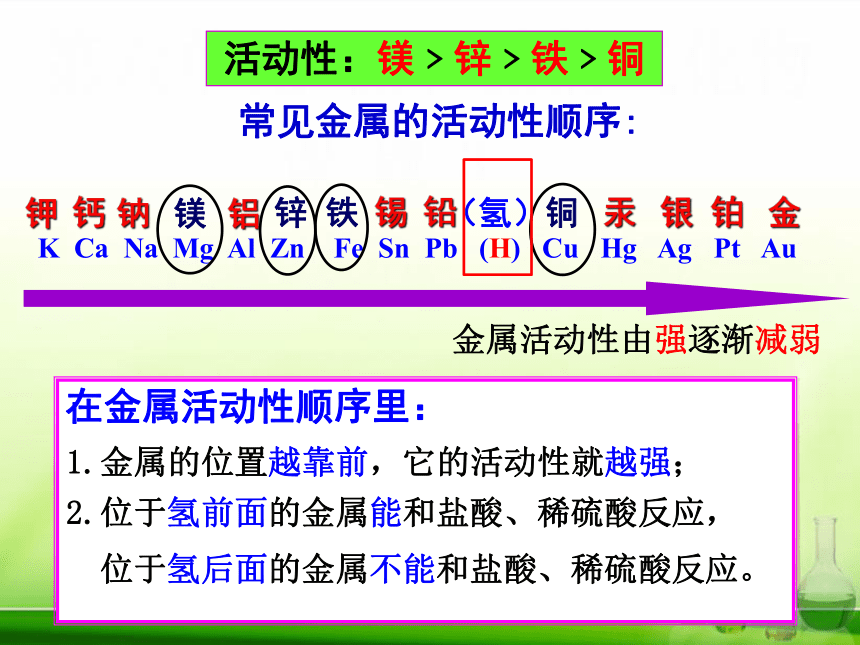
常见金属的活动性顺序:
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
金属活动性由强逐渐减弱
钾
钙
钠
镁
铝
锌
铁
锡
铅
(氢)
铜
汞
银
铂
金
活动性:镁﹥锌﹥铁﹥铜
在金属活动性顺序里:
2.位于氢前面的金属能和盐酸、稀硫酸反应,
位于氢后面的金属不能和盐酸、稀硫酸反应。
1.金属的位置越靠前,它的活动性就越强;
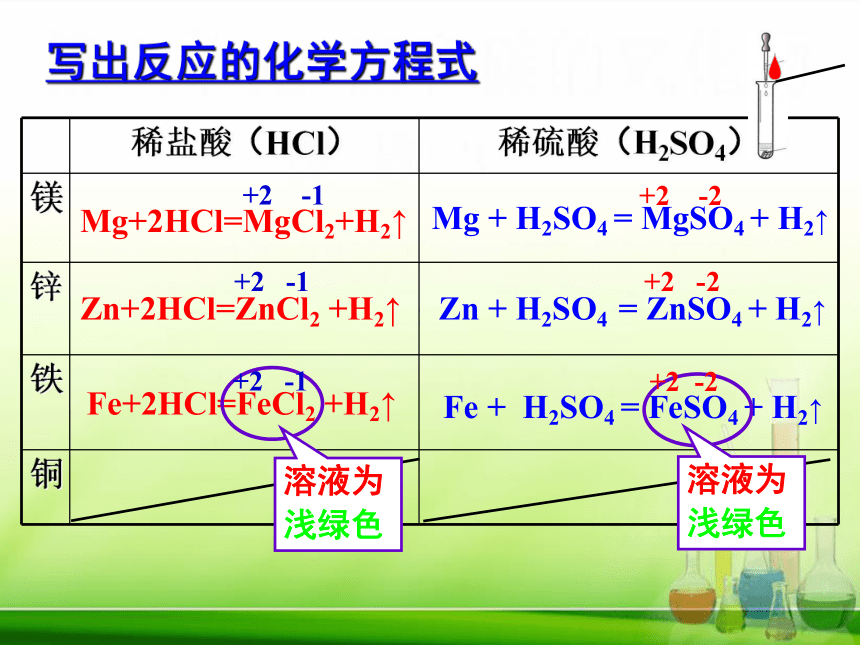
写出反应的化学方程式
Zn + H2SO4 = ZnSO4 + H2↑
Mg+2HCl=MgCl2+H2↑
+2 -1
+2 -1
+2 -1
+2 -2
+2 -2
+2 -2
溶液为
浅绿色
溶液为
浅绿色
稀盐酸(HCl) 稀硫酸(H2SO4)
镁
锌
铁
铜
Mg + 2HCl H2 + MgCl2
Zn + 2HCl H2 + ZnCl2
Fe + 2HCl H2 + FeCl2
Mg + H2SO4 H2 + MgSO4
Zn + H2SO4 H2 + ZnSO4
Fe + H2SO4 H2 + FeSO4
单质
单质
化合物
化合物
硫酸亚铁
氯化亚铁
学习活动三 :建构置换反应的概念
从物质分类的角度分析以下反应的特点
单质 + 化合物 == 新单质 + 新化合物
置换反应:
A + BC → + AC
B
镁、锌、铁能置换出盐酸、稀硫酸中的氢,铜不能
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
钾
钙
钠
镁
铝
锌
铁
锡
铅
(氢)
铜
汞
银
铂
金
在金属活动性顺序里:
2.位于氢前面的金属能置换出盐酸、稀硫酸中的氢
学习活动三总结
思考:你还能找到其他的方法来判断金属的活动性强弱吗?
判断金属活动性强弱的方法有:
① 根据金属与氧气反应的难易程度判断
② 根据金属与稀酸反应的剧烈程度判断
金属与氧气的反应
金属与盐酸、稀硫酸的反应
Mg+2HCl = MgCl2+H2↑, Mg+H2SO4 = MgSO4+H2↑
Zn+2HCl = ZnCl2+H2↑,
Zn+H2SO4 = ZnSO4+H2↑
Fe+2HCl=FeCl2+H2↑ , Fe+H2SO4=FeSO4+H2↑
判断金属活动性强弱的方法
强
弱
通过本节课的学习,你有何收获
请回顾学习目标,检查你的达标情况
1. 通过自主合作探究,知道镁、铁、铝、铜等常见金属与氧气的反应
2. 通过课前微课导学、课堂实验探究认识常见金属与稀盐酸、稀硫酸的反应
3. 通过合作讨论,建构置换反应的概念,并初步学会判断金属活动性的强弱
4. 通过实验探究归纳金属活动性顺序
闯关大比拼
闯关大比拼
1.出土的文物中,金器保存很好,铜器表面有锈迹,而铁器表面锈迹斑斑,这表明金、铜、铁的活泼性顺序由强到弱为( )
A.金、铜、铁 B.铁、金、铜
C.铜、铁、金 D.铁,铜,金
D
A. 氯化亚铁溶液(浅绿色)
B. 硫酸铜溶液(蓝色)
C. 稀硫酸(白色)
D. 硫酸亚铁粉(浅绿色)
2.下列有关物质的颜色中,不正确的是( )
C
3.将X、Y、Z三块大小相同的金属片分别投入到10%的稀盐酸中,
X表面无明显现象,
Y表面缓慢地产生气泡,
Z表面迅速产生大量气泡。
则X、Y、Z的金属活动性顺序为:( )
A.X>Z>Y? ???B.Z>Y>X ???
? C.X>Y>Z? ???D.Z>X>Y
B
4.把一根铁钉放入稀盐酸中,产生现象正确的是( )
A. ②④⑥ B. ②③④
C. ②⑤⑥ D. ②④⑤
① 铁表面有一层红色物质 ② 有气泡产生
③ 溶液由无色变成蓝色 ④ 铁逐渐溶解
⑤ 溶液由无色变成浅绿色 ⑥ 生成氯化亚铁
D
5.小兰家中收藏一件清末的铝制佛像,该佛像至今保存十分完好。其主要原因是( )
A.铝不易发生化学反应
B.铝的氧化物容易发生还原反应
C.铝易氧化,但致密的氧化铝薄膜具有保护内部铝的作用
D.铝不易被氧化
C
6.下列反应不属于置换反应的是( )
A
7.下列酸跟金属反应的化学方程式,
不正确的是( )
D
A.Fe+2HCl==FeCl2+ H2↑ B.Fe+H2SO4==FeSO4+H2↑
C.Fe+ CuSO4==FeSO4+Cu D.4Fe+3O2==2Fe2O3
答:酸菜鲜鱼汤中的酸类物质会与铝锅发生反应,大大缩短铝锅的使用寿命。
8.“酸菜鲜鱼汤”是某家饭店的招牌菜,店老板反映盛汤的铝锅很不耐用,没用多久锅底就漏洞了。请你分析一下这主要是为什么?
9.下列物质不能由酸和金属直接反应得到的是( )
A. FeSO4 B.MgSO4
C.FeCl3 D.ZnSO4
C
现在有两只金戒指,其中一只是假的(属于锌铜合金),你有哪些方法可以辨别出来?请选择所需仪器和药品设计方案,你也可以选择其他的仪器和药品。
仪器:试管、烧杯、镊子、酒精灯、火柴;
药品:稀盐酸、稀硫酸
编号 操作 现象 结论
方案一
方案二
方案三
......
因为金的活动性很弱,不和其他物质发生反应!铜和铁的活动性都比金强,铜器放置久了表面会生成铜锈,铁器也会生成铁锈!
课题2 金属的化学性质
(第1课时)
1. 通过自主合作探究,知道镁、铁、铝、铜等常见金属与氧气的反应
2. 通过课前微课导学、课堂实验探究,认识常见金属与盐酸、稀硫酸的反应
3. 通过小组讨论,建构置换反应的概念,并初步学会判断金属活动性的强弱
4. 通过实验探究归纳金属活动性顺序
学习目标
从海昏侯古墓中出土的马蹄金和金饼历经两千多年依然金光闪闪。但是平常出土的金属文物中,铜器表面会有锈迹,铁器锈迹斑斑甚至出土很少。
马蹄金
金 饼
学习活动一 :探究部分金属与氧气的反应
1.知识储备:我们已经知道,镁、铁都能和氧气发生反应
(1) 镁与氧气的反应方程式:2Mg+O2 2MgO,
条件:点燃,现象:发出强烈白光,放热,生成白色固体
(2) 铁与氧气的反应方程式:3Fe+2O2 Fe3O4,
条件:点燃,现象:剧烈燃烧火星四射,放热,生成黑色固体
2.各小组查阅资料,设计方案,探究Mg、Fe、Al、Cu与O2反应的难易。
实验操作 实验现象 结 论
学习成果汇报
探究成果:
在相同条件下,镁、铝、铁、铜与氧气反应从易到难依次是: 。
实验操作 实验现象 结 论
因为有氧化铝的保护,所以铝锅不易生锈。
为什么铝锅不易生锈?
4Al +3O2 = 2Al2O3
思考:铝锅是否适宜用钢丝刷来擦洗?
用钢丝刷来擦洗铝锅会破坏铝锅表面的氧化铝薄膜,
所以铝锅不宜用钢丝刷来擦洗。
2.判断金属活动性强弱的方法一:
(根据金属与氧气反应的难易来判断)
探究成果:在相同条件下,镁、铁、铝、铜与氧气反应从易到难依次是
镁、铝、铁、铜
1.镁、铝、铁、铜、金的金属活动性强弱:
> > >
镁
铁
铜
> 金
铝
学习活动一总结
在相同条件下,金属越容易与氧气反应,它的活动性就越强。
学习活动二 :探究部分金属与盐酸、稀硫酸的反应
观察要点:
有无气泡产生?
反应的剧烈程度如何?
大量气泡,
反应剧烈!
较多气泡,
反应适中!
少量气泡,
反应缓慢!
无
气
泡!
大量气泡,
反应剧烈!
较多气泡,
反应适中!
少量气泡,
反应缓慢!
无
气
泡!
1.镁锌铁铜的金属活动性强弱:
> > >
镁
锌
铁
铜
3.铜不能与稀酸反应
2.判断金属活动性强弱的方法二:
(根据金属与稀酸反应的剧烈程度判断)
在相同条件下,金属与稀酸反应越剧烈,
它的活动性就越强。
学习活动二总结
常见金属的活动性顺序:
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
金属活动性由强逐渐减弱
钾
钙
钠
镁
铝
锌
铁
锡
铅
(氢)
铜
汞
银
铂
金
活动性:镁﹥锌﹥铁﹥铜
在金属活动性顺序里:
2.位于氢前面的金属能和盐酸、稀硫酸反应,
位于氢后面的金属不能和盐酸、稀硫酸反应。
1.金属的位置越靠前,它的活动性就越强;
写出反应的化学方程式
Zn + H2SO4 = ZnSO4 + H2↑
Mg+2HCl=MgCl2+H2↑
+2 -1
+2 -1
+2 -1
+2 -2
+2 -2
+2 -2
溶液为
浅绿色
溶液为
浅绿色
稀盐酸(HCl) 稀硫酸(H2SO4)
镁
锌
铁
铜
Mg + 2HCl H2 + MgCl2
Zn + 2HCl H2 + ZnCl2
Fe + 2HCl H2 + FeCl2
Mg + H2SO4 H2 + MgSO4
Zn + H2SO4 H2 + ZnSO4
Fe + H2SO4 H2 + FeSO4
单质
单质
化合物
化合物
硫酸亚铁
氯化亚铁
学习活动三 :建构置换反应的概念
从物质分类的角度分析以下反应的特点
单质 + 化合物 == 新单质 + 新化合物
置换反应:
A + BC → + AC
B
镁、锌、铁能置换出盐酸、稀硫酸中的氢,铜不能
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
钾
钙
钠
镁
铝
锌
铁
锡
铅
(氢)
铜
汞
银
铂
金
在金属活动性顺序里:
2.位于氢前面的金属能置换出盐酸、稀硫酸中的氢
学习活动三总结
思考:你还能找到其他的方法来判断金属的活动性强弱吗?
判断金属活动性强弱的方法有:
① 根据金属与氧气反应的难易程度判断
② 根据金属与稀酸反应的剧烈程度判断
金属与氧气的反应
金属与盐酸、稀硫酸的反应
Mg+2HCl = MgCl2+H2↑, Mg+H2SO4 = MgSO4+H2↑
Zn+2HCl = ZnCl2+H2↑,
Zn+H2SO4 = ZnSO4+H2↑
Fe+2HCl=FeCl2+H2↑ , Fe+H2SO4=FeSO4+H2↑
判断金属活动性强弱的方法
强
弱
通过本节课的学习,你有何收获
请回顾学习目标,检查你的达标情况
1. 通过自主合作探究,知道镁、铁、铝、铜等常见金属与氧气的反应
2. 通过课前微课导学、课堂实验探究认识常见金属与稀盐酸、稀硫酸的反应
3. 通过合作讨论,建构置换反应的概念,并初步学会判断金属活动性的强弱
4. 通过实验探究归纳金属活动性顺序
闯关大比拼
闯关大比拼
1.出土的文物中,金器保存很好,铜器表面有锈迹,而铁器表面锈迹斑斑,这表明金、铜、铁的活泼性顺序由强到弱为( )
A.金、铜、铁 B.铁、金、铜
C.铜、铁、金 D.铁,铜,金
D
A. 氯化亚铁溶液(浅绿色)
B. 硫酸铜溶液(蓝色)
C. 稀硫酸(白色)
D. 硫酸亚铁粉(浅绿色)
2.下列有关物质的颜色中,不正确的是( )
C
3.将X、Y、Z三块大小相同的金属片分别投入到10%的稀盐酸中,
X表面无明显现象,
Y表面缓慢地产生气泡,
Z表面迅速产生大量气泡。
则X、Y、Z的金属活动性顺序为:( )
A.X>Z>Y? ???B.Z>Y>X ???
? C.X>Y>Z? ???D.Z>X>Y
B
4.把一根铁钉放入稀盐酸中,产生现象正确的是( )
A. ②④⑥ B. ②③④
C. ②⑤⑥ D. ②④⑤
① 铁表面有一层红色物质 ② 有气泡产生
③ 溶液由无色变成蓝色 ④ 铁逐渐溶解
⑤ 溶液由无色变成浅绿色 ⑥ 生成氯化亚铁
D
5.小兰家中收藏一件清末的铝制佛像,该佛像至今保存十分完好。其主要原因是( )
A.铝不易发生化学反应
B.铝的氧化物容易发生还原反应
C.铝易氧化,但致密的氧化铝薄膜具有保护内部铝的作用
D.铝不易被氧化
C
6.下列反应不属于置换反应的是( )
A
7.下列酸跟金属反应的化学方程式,
不正确的是( )
D
A.Fe+2HCl==FeCl2+ H2↑ B.Fe+H2SO4==FeSO4+H2↑
C.Fe+ CuSO4==FeSO4+Cu D.4Fe+3O2==2Fe2O3
答:酸菜鲜鱼汤中的酸类物质会与铝锅发生反应,大大缩短铝锅的使用寿命。
8.“酸菜鲜鱼汤”是某家饭店的招牌菜,店老板反映盛汤的铝锅很不耐用,没用多久锅底就漏洞了。请你分析一下这主要是为什么?
9.下列物质不能由酸和金属直接反应得到的是( )
A. FeSO4 B.MgSO4
C.FeCl3 D.ZnSO4
C
现在有两只金戒指,其中一只是假的(属于锌铜合金),你有哪些方法可以辨别出来?请选择所需仪器和药品设计方案,你也可以选择其他的仪器和药品。
仪器:试管、烧杯、镊子、酒精灯、火柴;
药品:稀盐酸、稀硫酸
编号 操作 现象 结论
方案一
方案二
方案三
......
因为金的活动性很弱,不和其他物质发生反应!铜和铁的活动性都比金强,铜器放置久了表面会生成铜锈,铁器也会生成铁锈!
同课章节目录
