第一节 原子的构成 课件(31张PPT)
文档属性
| 名称 | 第一节 原子的构成 课件(31张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 6.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版(五四学制) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-03-07 22:39:31 | ||
图片预览










文档简介
(共31张PPT)
第1节 原子的构成
在电解水的过程中,发生变化的粒子是 ,
保持不变的粒子是 ,
生成的新粒子是 ,
该实验证明在化学反应中 可分,而 不可分.
即原子是化学变化中的 .
水分子
氢原子氧原子
分子
原子
最小粒子
氢分子氧分子
温故知新:
在化学变化中,原子是不可分的,那么,原子本身到底能不能分呢?
1.通过原子结构的发现史的学习,学会用历史唯物主义的观点来评价科学家在科学上的贡献,形成化学科学是不断发展的认识;体会科学研究的一般方法和科学态度。
3.通过“原子核由质子和中子构成”的结论,结合质子、中子及电子的电性、电量和质量的数据,推证“质子数=核外电子数=核电荷数”
2.通过卢瑟福α粒子轰击金箔实验,知道原子是由原子核和核外电子构成的。
学习目标
课堂活动 1
沿着历史的足迹,
打开原子世界的大门
近代化学之父
---道尔顿
1803年
实心球模型
原子是不可再分的实心球体
---实心球模型
1.道尔顿原子模型
汤姆森
“葡萄干布丁”模型
---“葡萄干布丁”模型
2.汤姆森原子模型
1897年
汤姆森发现电子
原子可以再分
α粒子源
3.卢瑟福--α粒子轰击金箔实验
卢瑟福
1911年
课堂活动 2
探究卢瑟福的原子模型
卢瑟福实验
α粒子发射源
用一速带正电的质量比电子大很多的高速运动的α粒子轰击金箔
金
箔
观看视频,总结现象
自主探究
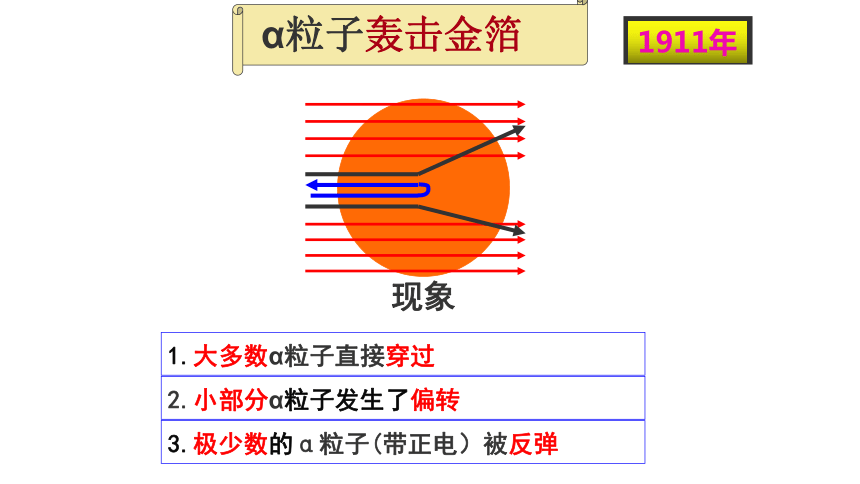
α粒子轰击金箔
1911年
探测版
α粒子源
小部分α粒子发生了偏转
现象
3.极少数的α粒子(带正电)被反弹回来
2.小部分α粒子发生了偏转
1.大多数α粒子直接穿过金箔
α 粒子束(带正电)
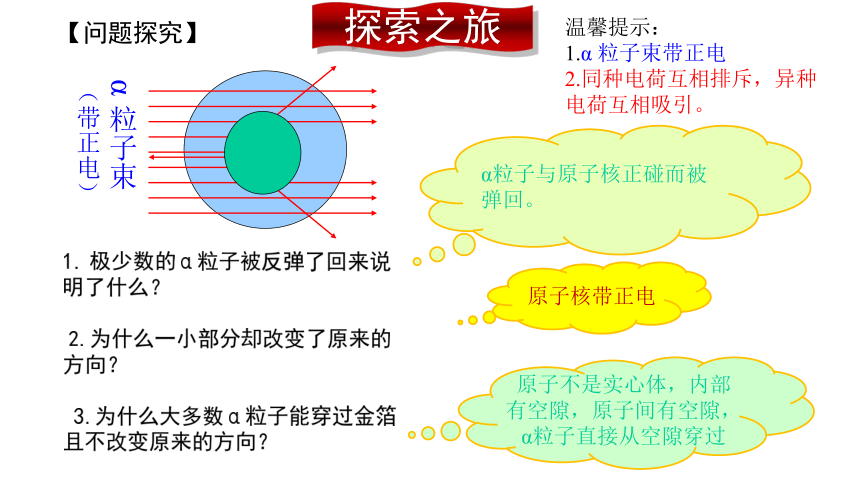
1.?极少数的α粒子被反弹了回来说明了什么?
?2.为什么一小部分却改变了原来的方向?
3.为什么大多数α粒子能穿过金箔且不改变原来的方向?
α粒子与原子核正碰而被弹回。
原子核带正电
原子不是实心体,内部有空隙,原子间有空隙,α粒子直接从空隙穿过
【问题探究】
温馨提示:
1.α 粒子束带正电
2.同种电荷互相排斥,异种电荷互相吸引。
探索之旅
原子内部的空间“很大”
原子
原子核
科学家探索原子结构的历程
敢于质疑
大胆探索
…
原子的结构
原子
核外电子(带负电)
原子为什么不显电性?
(核电荷数)=核外电子数
原子核带的正电荷数=核外电子带的负电荷数
原子核(带正电)
质子(一个质子带一个单位正电荷)
中子(不带电)
下面请看老师表演的小魔术
1.一百多年来,化学家借助构建原子结构模型,逐渐揭开了原子构成的神秘面纱,并通过不断提出新的原子结构模型,逐步形成了今天的原子结构理论。
右图两种模型是汤姆森和卢瑟福分别于
1897年和1911年提出的,其中(填代号,下同)
是由汤姆森提出的。
下列关于原子结构理论的学说中,汤姆
森的观点是(填代号,下同) ,
卢瑟福的观点是 。
A.原子是不可分的
B.原子是可分的
C.原子呈球形
D.在球体内充斥着正电荷,电子镶嵌其中。
E.带正电荷的原子核居于原子的中心
F.带正电荷的原子核很小,但集中了原子的大部分质量
G.电子带负电
H.电子在原子核外很大的空间内高速运动
A
BCDG
BCEFGH
1、将①分子②原子③质子④中子⑤电子等粒子用序号分别填入下列适当空格中:
(1)构成物质的基本粒子是________________
(2)构成原子的基本粒子是________________
(3)显示电中性的粒子是________________
(4)带正电的粒子是________________
(5)参加化学反应一定发生变化的粒子是_______________
①②
③④⑤
①②④
③
①
牛刀小试
课堂活动 3
探寻原子构成的规律
原子
名称 符号 质子
数 中子
数 核外电子
数
氢 H 1 0 1
氧 O 8 8 8
钠 Na 11 12 11
氯 Cl 17 18 17
原子
名称 符号 质子
数 中子
数 核外电子
数
碳-12 C-12 6 6 6
碳-13 C-13 6 7 6
碳-14 C-14 6 8 6
小组合作:
横看:原子中
______________________________________
竖看:不同类原子中
_________________________
同类原子中___________________________
质子数=电子数,不一定等于中子数
有的原子没有中子
质子数相同、电子数相同、中子数不同
质子数不同 ,电子数不同
中子数可能相同
不同类原子
同类原子
质子数决定原子种类
在原子中:
核电荷数=质子数=核外电子数
1、下列对原子构成的理解错误的是( )
A.原子整体不显电性是因为质子数等于电子数
B.原子核比原子小得多
C.原子核都是由质子和中子构成的
D.原子质量主要集中在原子核上
2.已知原子的质子数,可以确定它的?( ?)
A.相对原子质量? B.核电荷数?
C.中子数? D.电子数
3.某些花岗岩石材中含有放射性元素氡。一种氡原子的质子数为86,中子数为136,这种氡原子核外电子数为( )
A.50 B.86 C.136 D.222
C
BD
B
课堂活动 4
原子的性质
由原子直接构成的
原子是构成物质的一种基本粒子
金原子
碳原子
氦原子
金属
大多数非金属固体
稀有气体
分子和原子都是构成物质的基本微粒,那么它们之间
有什么区别和联系呢?
? 分 子 原 子
区别 ? ?
相似点 ?
联系 ?
在化学变化中可分
在化学变化中不可分
质量和体积都很小、有间隔、不断运动、有能量
分子都是由原子构成的
1.在下面的空格中填写微粒名称:
铁丝是由 构成的;二氧化碳是由 ____构成的;二氧化碳分子是由 ______构成的;
铁原子
二氧化碳分子
碳原子和氧原子
现 象 性 质
报纸上的一个墨点就含有1018个碳原子。
长时间一起放置的铁 块与铅块会融合在一起。
原子很小。
原子自身有能量,总在不停的运动,之间有间隔。
原子之间有间隔。
下列现象说明原子具有哪些性质?
水银温度计中的水银受热时体积会增大,遇冷时体积会减小。
我会解释
你的收获
2.原子是由居于原子中心、带正电荷的原子核和核外带负电荷的电子构成的,原子不显电性。原子核所带电荷数称为核电荷数,它是由质子数决定的。
3.在原子中:核电荷数=质子数=核外电子数
1.原子是构成物质的一种基本粒子,
具有微观粒子的一般性质。
布置作业
如果你是氧原子中的一个电子,请用拟人化的第一人称描述:
“我在原子大家庭中的所见所闻”
1.描述出原子核、质子、中子的特点。
2.字数:100字左右。
科学是一步一个脚印的向前发展,每个人都要依赖前人的成果。
——卢瑟福
2019
[ 谢谢大家]
广西苍梧县木双镇初级中学
第1节 原子的构成
在电解水的过程中,发生变化的粒子是 ,
保持不变的粒子是 ,
生成的新粒子是 ,
该实验证明在化学反应中 可分,而 不可分.
即原子是化学变化中的 .
水分子
氢原子氧原子
分子
原子
最小粒子
氢分子氧分子
温故知新:
在化学变化中,原子是不可分的,那么,原子本身到底能不能分呢?
1.通过原子结构的发现史的学习,学会用历史唯物主义的观点来评价科学家在科学上的贡献,形成化学科学是不断发展的认识;体会科学研究的一般方法和科学态度。
3.通过“原子核由质子和中子构成”的结论,结合质子、中子及电子的电性、电量和质量的数据,推证“质子数=核外电子数=核电荷数”
2.通过卢瑟福α粒子轰击金箔实验,知道原子是由原子核和核外电子构成的。
学习目标
课堂活动 1
沿着历史的足迹,
打开原子世界的大门
近代化学之父
---道尔顿
1803年
实心球模型
原子是不可再分的实心球体
---实心球模型
1.道尔顿原子模型
汤姆森
“葡萄干布丁”模型
---“葡萄干布丁”模型
2.汤姆森原子模型
1897年
汤姆森发现电子
原子可以再分
α粒子源
3.卢瑟福--α粒子轰击金箔实验
卢瑟福
1911年
课堂活动 2
探究卢瑟福的原子模型
卢瑟福实验
α粒子发射源
用一速带正电的质量比电子大很多的高速运动的α粒子轰击金箔
金
箔
观看视频,总结现象
自主探究
α粒子轰击金箔
1911年
探测版
α粒子源
小部分α粒子发生了偏转
现象
3.极少数的α粒子(带正电)被反弹回来
2.小部分α粒子发生了偏转
1.大多数α粒子直接穿过金箔
α 粒子束(带正电)
1.?极少数的α粒子被反弹了回来说明了什么?
?2.为什么一小部分却改变了原来的方向?
3.为什么大多数α粒子能穿过金箔且不改变原来的方向?
α粒子与原子核正碰而被弹回。
原子核带正电
原子不是实心体,内部有空隙,原子间有空隙,α粒子直接从空隙穿过
【问题探究】
温馨提示:
1.α 粒子束带正电
2.同种电荷互相排斥,异种电荷互相吸引。
探索之旅
原子内部的空间“很大”
原子
原子核
科学家探索原子结构的历程
敢于质疑
大胆探索
…
原子的结构
原子
核外电子(带负电)
原子为什么不显电性?
(核电荷数)=核外电子数
原子核带的正电荷数=核外电子带的负电荷数
原子核(带正电)
质子(一个质子带一个单位正电荷)
中子(不带电)
下面请看老师表演的小魔术
1.一百多年来,化学家借助构建原子结构模型,逐渐揭开了原子构成的神秘面纱,并通过不断提出新的原子结构模型,逐步形成了今天的原子结构理论。
右图两种模型是汤姆森和卢瑟福分别于
1897年和1911年提出的,其中(填代号,下同)
是由汤姆森提出的。
下列关于原子结构理论的学说中,汤姆
森的观点是(填代号,下同) ,
卢瑟福的观点是 。
A.原子是不可分的
B.原子是可分的
C.原子呈球形
D.在球体内充斥着正电荷,电子镶嵌其中。
E.带正电荷的原子核居于原子的中心
F.带正电荷的原子核很小,但集中了原子的大部分质量
G.电子带负电
H.电子在原子核外很大的空间内高速运动
A
BCDG
BCEFGH
1、将①分子②原子③质子④中子⑤电子等粒子用序号分别填入下列适当空格中:
(1)构成物质的基本粒子是________________
(2)构成原子的基本粒子是________________
(3)显示电中性的粒子是________________
(4)带正电的粒子是________________
(5)参加化学反应一定发生变化的粒子是_______________
①②
③④⑤
①②④
③
①
牛刀小试
课堂活动 3
探寻原子构成的规律
原子
名称 符号 质子
数 中子
数 核外电子
数
氢 H 1 0 1
氧 O 8 8 8
钠 Na 11 12 11
氯 Cl 17 18 17
原子
名称 符号 质子
数 中子
数 核外电子
数
碳-12 C-12 6 6 6
碳-13 C-13 6 7 6
碳-14 C-14 6 8 6
小组合作:
横看:原子中
______________________________________
竖看:不同类原子中
_________________________
同类原子中___________________________
质子数=电子数,不一定等于中子数
有的原子没有中子
质子数相同、电子数相同、中子数不同
质子数不同 ,电子数不同
中子数可能相同
不同类原子
同类原子
质子数决定原子种类
在原子中:
核电荷数=质子数=核外电子数
1、下列对原子构成的理解错误的是( )
A.原子整体不显电性是因为质子数等于电子数
B.原子核比原子小得多
C.原子核都是由质子和中子构成的
D.原子质量主要集中在原子核上
2.已知原子的质子数,可以确定它的?( ?)
A.相对原子质量? B.核电荷数?
C.中子数? D.电子数
3.某些花岗岩石材中含有放射性元素氡。一种氡原子的质子数为86,中子数为136,这种氡原子核外电子数为( )
A.50 B.86 C.136 D.222
C
BD
B
课堂活动 4
原子的性质
由原子直接构成的
原子是构成物质的一种基本粒子
金原子
碳原子
氦原子
金属
大多数非金属固体
稀有气体
分子和原子都是构成物质的基本微粒,那么它们之间
有什么区别和联系呢?
? 分 子 原 子
区别 ? ?
相似点 ?
联系 ?
在化学变化中可分
在化学变化中不可分
质量和体积都很小、有间隔、不断运动、有能量
分子都是由原子构成的
1.在下面的空格中填写微粒名称:
铁丝是由 构成的;二氧化碳是由 ____构成的;二氧化碳分子是由 ______构成的;
铁原子
二氧化碳分子
碳原子和氧原子
现 象 性 质
报纸上的一个墨点就含有1018个碳原子。
长时间一起放置的铁 块与铅块会融合在一起。
原子很小。
原子自身有能量,总在不停的运动,之间有间隔。
原子之间有间隔。
下列现象说明原子具有哪些性质?
水银温度计中的水银受热时体积会增大,遇冷时体积会减小。
我会解释
你的收获
2.原子是由居于原子中心、带正电荷的原子核和核外带负电荷的电子构成的,原子不显电性。原子核所带电荷数称为核电荷数,它是由质子数决定的。
3.在原子中:核电荷数=质子数=核外电子数
1.原子是构成物质的一种基本粒子,
具有微观粒子的一般性质。
布置作业
如果你是氧原子中的一个电子,请用拟人化的第一人称描述:
“我在原子大家庭中的所见所闻”
1.描述出原子核、质子、中子的特点。
2.字数:100字左右。
科学是一步一个脚印的向前发展,每个人都要依赖前人的成果。
——卢瑟福
2019
[ 谢谢大家]
广西苍梧县木双镇初级中学
同课章节目录
- 第一单元 步入化学殿堂
- 第一节 化学真奇妙
- 第二节 体验化学探究
- 到实验室去:化学实验基本技能训练(一)
- 第二单元 探秘水世界
- 第一节 运动的水分子
- 第二节 自然界中的水
- 第三节 水分子的变化
- 到实验室去:化学实验基本技能训练(二)
- 第三单元 物质构成的奥秘
- 第一节 原子的构成
- 第二节 元素
- 第三节 物质组成的表示
- 第四单元 我们周围的空气
- 第一节 空气的成分
- 第二节 氧气
- 到实验室去:氧气的实验室制取与性质
- 第五单元 定量研究化学反应
- 第一节 化学反应中的质量守恒
- 第二节 化学反应的表示
- 第三节 化学反应中的有关计算
- 到实验室去:探究燃烧的条件
- 第六单元 燃烧与燃料
- 第一节 燃烧与灭火
- 第二节 化石燃料的利用
- 第三节 大自然中的二氧化碳
- 到实验室去 二氧化碳的实验室制取与性质
