第一节 化学反应中的质量守恒 课件(31张PPT)
文档属性
| 名称 | 第一节 化学反应中的质量守恒 课件(31张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 3.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版(五四学制) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-03-08 09:04:47 | ||
图片预览







文档简介
(共31张PPT)
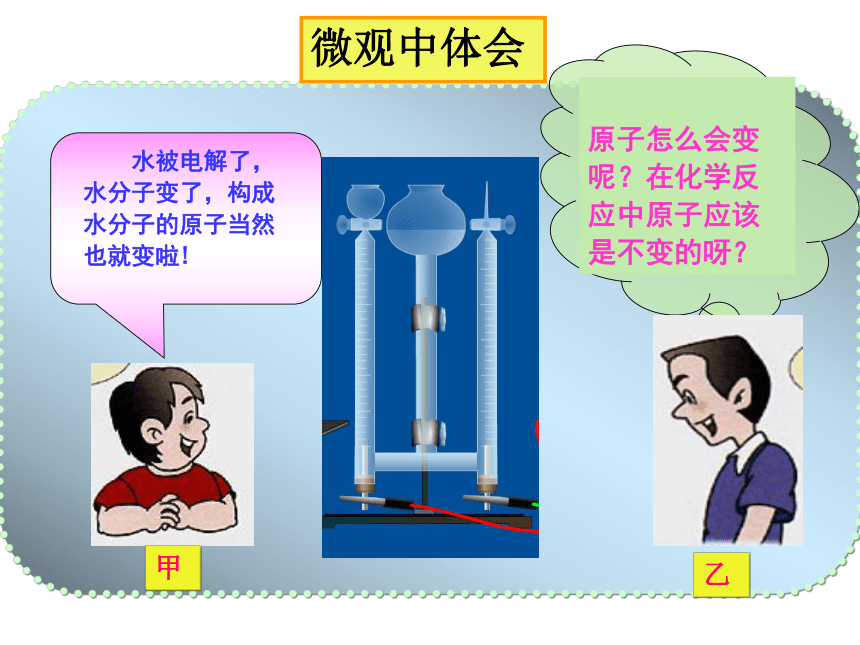
化学反应中的
质量守恒
微观中体会
甲
乙
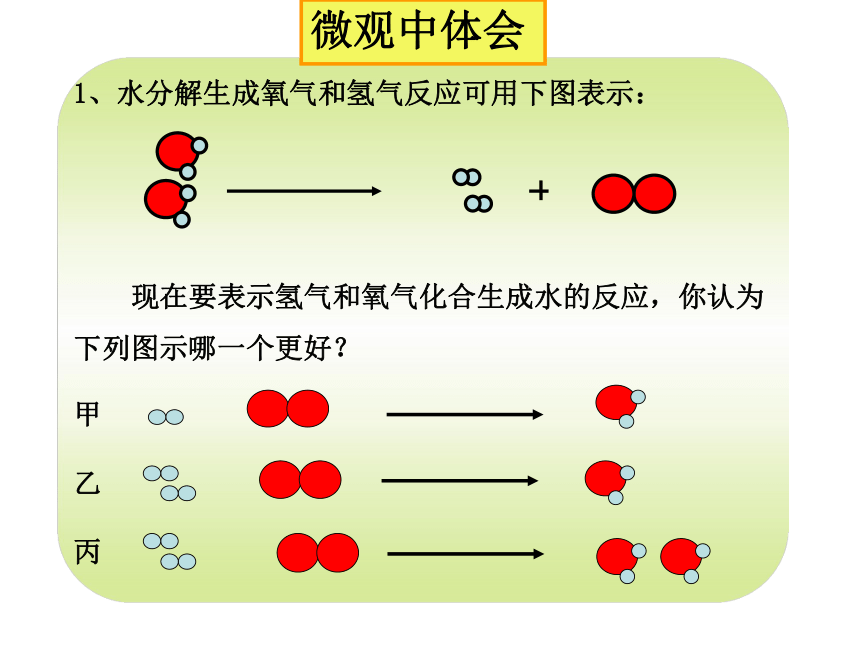
1、水分解生成氧气和氢气反应可用下图表示:
现在要表示氢气和氧气化合生成水的反应,你认为下列图示哪一个更好?
甲
乙
丙
微观中体会
水电解过程中,参加反应的水的质量与生成的氢气和氧气的质量总和有怎样的关系?
猜想?
大胆设想
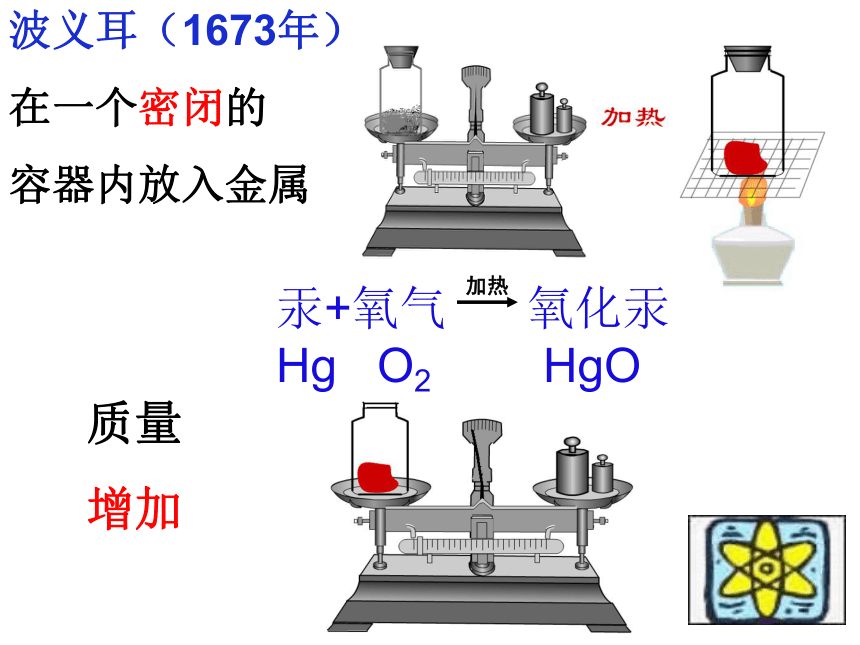
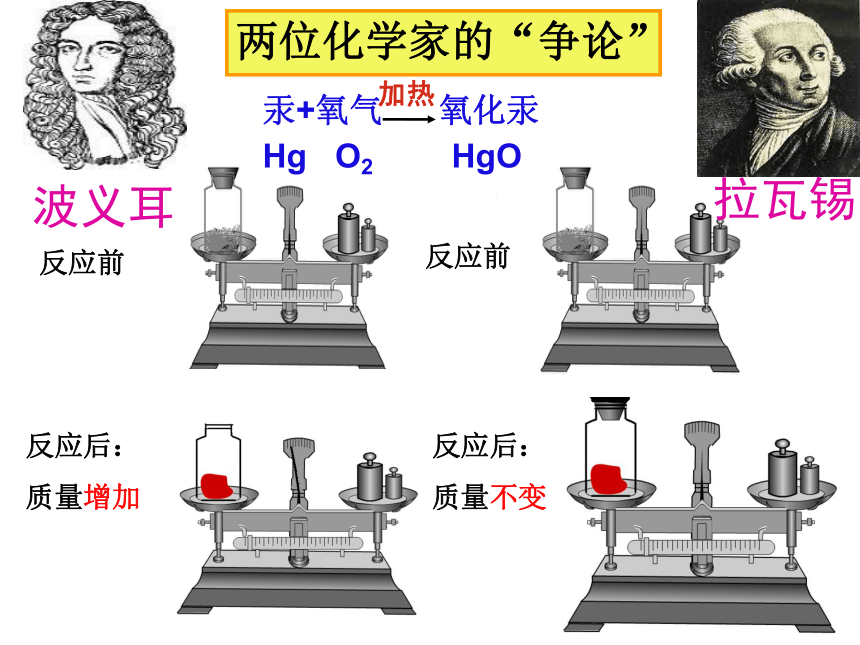
波义耳
拉瓦锡
两位化学家的“争论”
波义耳(1673年)
在一个密闭的
容器内放入金属
质量
增加
加热
汞+氧气 氧化汞Hg O2 HgO
质量不变
拉瓦锡(1777年)
在一个密闭的
容器内放入金属
加热
汞+氧气 氧化汞Hg O2 HgO
反应前
反应后:
质量增加
反应前
反应后:
质量不变
汞+氧气 氧化汞
Hg O2 HgO
加热
波义耳
拉瓦锡
两位化学家的“争论”
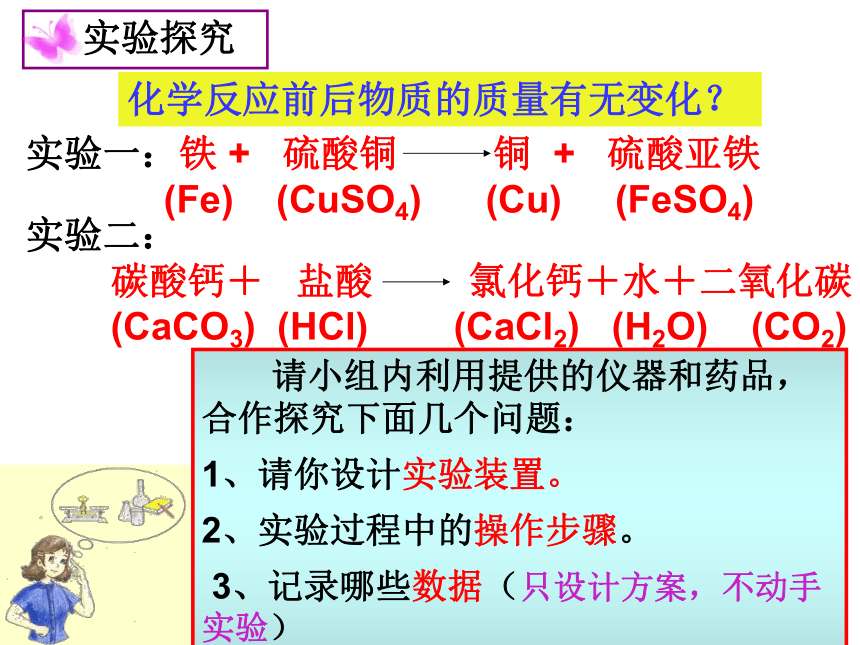
实验一:铁 + 硫酸铜 铜 + 硫酸亚铁
(Fe) (CuSO4) (Cu) (FeSO4)
化学反应前后物质的质量有无变化?
实验二:
碳酸钙+ 盐酸 氯化钙+水+二氧化碳
(CaCO3) (HCl) (CaCl2) (H2O) (CO2)
请小组内利用提供的仪器和药品,合作探究下面几个问题:
1、请你设计实验装置。
2、实验过程中的操作步骤。
3、记录哪些数据(只设计方案,不动手实验)
实验一:铁 + 硫酸铜 铜 + 硫酸亚铁
(Fe) (CuSO4) (Cu) (FeSO4)
实验二:
碳酸钙+ 盐酸 氯化钙+水+二氧化碳
(CaCO3) (HCl) (CaCl2) (H2O) (CO2)
友情提示:
1.液体取试管容积的二分之一,大理石取2---3块,铁丝用前要用砂纸打磨。
2.及时地将实验现象和实验数据记录在学案中相应的表格内。
3.将橡皮塞旋转塞进锥形瓶中,注意塞紧,防止逸出气体。
化学反应前后物质的质量有无变化?
注意:
1.电子秤需放于平稳的桌面上称量,以确保准确性。
2.按红色开关,3秒后自动显示为0后,再将物品放到台面上称量。
铁 + 硫酸铜 铜 + 硫酸亚铁
(Fe) (CuSO4) (Cu) (FeSO4)
红色
铁丝表面有红色物质生成
实验名称 铁跟硫酸铜溶液反应前后质量的测定
观察的实验
现象
记录的数据 反应前 反应后
反应前后物质总质量是否变化
有大量气泡产生,小气球鼓起来
碳酸钙+ 盐酸 氯化钙+水+二氧化碳
(CaCO3) (HCl) (CaCl2) (H2O) (CO2)
实验名称 大理石(主要成分是碳酸钙)和稀盐酸反应前后质量的测定
观察的实验
现象
记录的数据 反应前 反应后
反应前后物质总质量是否变化
★ 1673年,英国化学家波义耳在密闭容器中加热金属,冷却后打开瓶塞称量,结果发现反应后质量增加了,因此他认为化学反应前后物质
总质量不相等。
★ 1777年,法国化学家拉瓦锡在密闭容器中研究氧化汞的分解和合成时,却发现化学反应前后各物质的
总质量相等。
拉瓦锡
波义耳
两位化学家的“争论”
总质量
反应前
烧杯的质量
试管的质量
硫酸铜的质量
铁钉的质量
水的质量
铁 + 硫酸铜 铜 + 硫酸亚铁
(Fe) (CuSO4) (Cu) (FeSO4)
红色
反应后
总质量
烧杯的质量
试管的质量
水的质量
铜的质量
硫酸亚铁的质量
没参加反应的铁的质量
铁 + 硫酸铜 铜 + 硫酸亚铁
(Fe) (CuSO4) (Cu) (FeSO4)
红色
反应前总质量
烧杯的质量
试管的质量
硫酸铜的质量
铁钉的质量
水的质量
反应后总质量
烧杯的质量
试管的质量
水的质量
铜的质量
硫酸亚铁的质量
没参加反应的铁的质量
=
硫酸亚铁的质量
硫酸铜的质量
铁的质量
=
反应的铁的质量
没反应的铁的质量
没反应的铁的质量
生成的铜的质量
铁 + 硫酸铜 铜 + 硫酸亚铁
质量守恒定律
参加化学反应的各物质的质量总和,等于反应后生成的各物质的质量总和.
适用范围:一切化学变化
有同学做了两个实验:
一是氧化汞受热分解生成汞和氧气;
二是镁条在氧气中燃烧生成固体氧化镁。
他认真收集反应的生成物,并准确称量了这些反应物和生成物的质量,得到数据如下:
仔细分析数据后他认为:在实验1中生成物的质量减少了,在实验2中生成物的质量增加了,这两个反应都不符合质量守恒定律。你认为他的看法对吗?
加热
氧化汞 汞 + 氧气
镁 + 氧气 氧化镁
点燃
实验1 氧化汞1.083g 汞1.003g
实验2 金属镁0.486g 氧化镁0.806g
1.必须是真正参加反应的物质。
2.各物质的质量总和相等。
1号
3号
2号
砸金蛋,点收获,你准备好了吗?
3、大量实验证明12g碳和32g氧气恰好完全反应生成了44g二氧化碳,则12g碳放在40g氧气中充分反应生成了52g二氧化碳.( )
试一试:相信你定会有不同的收获
×
试一试:相信你定会有不同的收获
2、10g黄泥水过滤后得到了7g水和3g泥,这符合质量守恒定律。( )
×
1、根据质量守恒定律,2体积的氢气和1体积的氧气在点燃的条件下,能生成3体积的水。 ( )
试一试:相信你定会有不同的收获
×
定量研究方法是科学研究的重要方法之一。化学家们用定量的方法对化学变化进行研究,发现了许多化学变化的重要规律,质量守恒定律就是其中之一。
那么“定量”与“定性”有何区别呢?
光的传播需不需要时间,金子会不会生锈?蚂蚁有没有思维能力?这些都属于定性的问题;光从太阳到达地球需要多长时间?石墨在多高的温度和压强下转化为金刚石?燃烧1L汽油能放出多少热量?这些都属于定量的问题。定性是定量的基础,定量是定性的精确化。定量研究是科学家研究的重要方法之一,它需要精密的计量仪器。1774年,法国科学家拉瓦锡就是依靠比较精密的天平,经过反复测定和分析,发现了质量守恒定律。
请大家查阅发现“质量守恒定律”的相关资料,写一篇“质量守恒定律”的发展简史。
课后作业
拉瓦锡在反复实验氧化汞的受热分解和合成时,他发现每45份质量的氧化汞加热分解,都会得到41.5份质量的汞和3.5份质量的氧气。
HgO Hg + O2
45 41.5 3.5
加热
无涯学海
祝福同学们—
百尺竿头更进一步
化学反应中的
质量守恒
微观中体会
甲
乙
1、水分解生成氧气和氢气反应可用下图表示:
现在要表示氢气和氧气化合生成水的反应,你认为下列图示哪一个更好?
甲
乙
丙
微观中体会
水电解过程中,参加反应的水的质量与生成的氢气和氧气的质量总和有怎样的关系?
猜想?
大胆设想
波义耳
拉瓦锡
两位化学家的“争论”
波义耳(1673年)
在一个密闭的
容器内放入金属
质量
增加
加热
汞+氧气 氧化汞Hg O2 HgO
质量不变
拉瓦锡(1777年)
在一个密闭的
容器内放入金属
加热
汞+氧气 氧化汞Hg O2 HgO
反应前
反应后:
质量增加
反应前
反应后:
质量不变
汞+氧气 氧化汞
Hg O2 HgO
加热
波义耳
拉瓦锡
两位化学家的“争论”
实验一:铁 + 硫酸铜 铜 + 硫酸亚铁
(Fe) (CuSO4) (Cu) (FeSO4)
化学反应前后物质的质量有无变化?
实验二:
碳酸钙+ 盐酸 氯化钙+水+二氧化碳
(CaCO3) (HCl) (CaCl2) (H2O) (CO2)
请小组内利用提供的仪器和药品,合作探究下面几个问题:
1、请你设计实验装置。
2、实验过程中的操作步骤。
3、记录哪些数据(只设计方案,不动手实验)
实验一:铁 + 硫酸铜 铜 + 硫酸亚铁
(Fe) (CuSO4) (Cu) (FeSO4)
实验二:
碳酸钙+ 盐酸 氯化钙+水+二氧化碳
(CaCO3) (HCl) (CaCl2) (H2O) (CO2)
友情提示:
1.液体取试管容积的二分之一,大理石取2---3块,铁丝用前要用砂纸打磨。
2.及时地将实验现象和实验数据记录在学案中相应的表格内。
3.将橡皮塞旋转塞进锥形瓶中,注意塞紧,防止逸出气体。
化学反应前后物质的质量有无变化?
注意:
1.电子秤需放于平稳的桌面上称量,以确保准确性。
2.按红色开关,3秒后自动显示为0后,再将物品放到台面上称量。
铁 + 硫酸铜 铜 + 硫酸亚铁
(Fe) (CuSO4) (Cu) (FeSO4)
红色
铁丝表面有红色物质生成
实验名称 铁跟硫酸铜溶液反应前后质量的测定
观察的实验
现象
记录的数据 反应前 反应后
反应前后物质总质量是否变化
有大量气泡产生,小气球鼓起来
碳酸钙+ 盐酸 氯化钙+水+二氧化碳
(CaCO3) (HCl) (CaCl2) (H2O) (CO2)
实验名称 大理石(主要成分是碳酸钙)和稀盐酸反应前后质量的测定
观察的实验
现象
记录的数据 反应前 反应后
反应前后物质总质量是否变化
★ 1673年,英国化学家波义耳在密闭容器中加热金属,冷却后打开瓶塞称量,结果发现反应后质量增加了,因此他认为化学反应前后物质
总质量不相等。
★ 1777年,法国化学家拉瓦锡在密闭容器中研究氧化汞的分解和合成时,却发现化学反应前后各物质的
总质量相等。
拉瓦锡
波义耳
两位化学家的“争论”
总质量
反应前
烧杯的质量
试管的质量
硫酸铜的质量
铁钉的质量
水的质量
铁 + 硫酸铜 铜 + 硫酸亚铁
(Fe) (CuSO4) (Cu) (FeSO4)
红色
反应后
总质量
烧杯的质量
试管的质量
水的质量
铜的质量
硫酸亚铁的质量
没参加反应的铁的质量
铁 + 硫酸铜 铜 + 硫酸亚铁
(Fe) (CuSO4) (Cu) (FeSO4)
红色
反应前总质量
烧杯的质量
试管的质量
硫酸铜的质量
铁钉的质量
水的质量
反应后总质量
烧杯的质量
试管的质量
水的质量
铜的质量
硫酸亚铁的质量
没参加反应的铁的质量
=
硫酸亚铁的质量
硫酸铜的质量
铁的质量
=
反应的铁的质量
没反应的铁的质量
没反应的铁的质量
生成的铜的质量
铁 + 硫酸铜 铜 + 硫酸亚铁
质量守恒定律
参加化学反应的各物质的质量总和,等于反应后生成的各物质的质量总和.
适用范围:一切化学变化
有同学做了两个实验:
一是氧化汞受热分解生成汞和氧气;
二是镁条在氧气中燃烧生成固体氧化镁。
他认真收集反应的生成物,并准确称量了这些反应物和生成物的质量,得到数据如下:
仔细分析数据后他认为:在实验1中生成物的质量减少了,在实验2中生成物的质量增加了,这两个反应都不符合质量守恒定律。你认为他的看法对吗?
加热
氧化汞 汞 + 氧气
镁 + 氧气 氧化镁
点燃
实验1 氧化汞1.083g 汞1.003g
实验2 金属镁0.486g 氧化镁0.806g
1.必须是真正参加反应的物质。
2.各物质的质量总和相等。
1号
3号
2号
砸金蛋,点收获,你准备好了吗?
3、大量实验证明12g碳和32g氧气恰好完全反应生成了44g二氧化碳,则12g碳放在40g氧气中充分反应生成了52g二氧化碳.( )
试一试:相信你定会有不同的收获
×
试一试:相信你定会有不同的收获
2、10g黄泥水过滤后得到了7g水和3g泥,这符合质量守恒定律。( )
×
1、根据质量守恒定律,2体积的氢气和1体积的氧气在点燃的条件下,能生成3体积的水。 ( )
试一试:相信你定会有不同的收获
×
定量研究方法是科学研究的重要方法之一。化学家们用定量的方法对化学变化进行研究,发现了许多化学变化的重要规律,质量守恒定律就是其中之一。
那么“定量”与“定性”有何区别呢?
光的传播需不需要时间,金子会不会生锈?蚂蚁有没有思维能力?这些都属于定性的问题;光从太阳到达地球需要多长时间?石墨在多高的温度和压强下转化为金刚石?燃烧1L汽油能放出多少热量?这些都属于定量的问题。定性是定量的基础,定量是定性的精确化。定量研究是科学家研究的重要方法之一,它需要精密的计量仪器。1774年,法国科学家拉瓦锡就是依靠比较精密的天平,经过反复测定和分析,发现了质量守恒定律。
请大家查阅发现“质量守恒定律”的相关资料,写一篇“质量守恒定律”的发展简史。
课后作业
拉瓦锡在反复实验氧化汞的受热分解和合成时,他发现每45份质量的氧化汞加热分解,都会得到41.5份质量的汞和3.5份质量的氧气。
HgO Hg + O2
45 41.5 3.5
加热
无涯学海
祝福同学们—
百尺竿头更进一步
同课章节目录
- 第一单元 步入化学殿堂
- 第一节 化学真奇妙
- 第二节 体验化学探究
- 到实验室去:化学实验基本技能训练(一)
- 第二单元 探秘水世界
- 第一节 运动的水分子
- 第二节 自然界中的水
- 第三节 水分子的变化
- 到实验室去:化学实验基本技能训练(二)
- 第三单元 物质构成的奥秘
- 第一节 原子的构成
- 第二节 元素
- 第三节 物质组成的表示
- 第四单元 我们周围的空气
- 第一节 空气的成分
- 第二节 氧气
- 到实验室去:氧气的实验室制取与性质
- 第五单元 定量研究化学反应
- 第一节 化学反应中的质量守恒
- 第二节 化学反应的表示
- 第三节 化学反应中的有关计算
- 到实验室去:探究燃烧的条件
- 第六单元 燃烧与燃料
- 第一节 燃烧与灭火
- 第二节 化石燃料的利用
- 第三节 大自然中的二氧化碳
- 到实验室去 二氧化碳的实验室制取与性质
