课题2 溶解度 导学案课件(含答案)
图片预览










文档简介
(共45张PPT)
第九单元 溶液
课题2 溶解度
课时1 饱和溶液与不饱和溶液 结晶
知识梳理
知识点1 饱和溶液与不饱和溶液
1. 在一定______下,向一定量______里加入某种溶质,当溶质_________________时,所得到的溶液叫做这种溶质的_________;_______________的溶液叫做这种溶质的_____________。判断溶液是否饱和的方法:继续加入______,看能否继续溶解。
2. 只有指明“_____________”和“_________________”,溶液的“饱和”和“不饱和”才有确定的意义。
3. 对于大多数溶液而言,不饱和溶液可以通过_________、_________、__________等方法变成饱和溶液;饱和溶液可以通过_________、_________等方法变成不饱和溶液。
温度
溶剂
不能继续溶解
饱和溶液
还能继续溶解
不饱和溶液
溶质
在一定温度下
在一定量溶剂里
增加溶质
蒸发溶剂
降低温度
增加溶剂
升高温度
4. 浓、稀溶液与饱和不饱和溶液之间的关系:①饱和溶液________是浓溶液,如饱和的石灰水溶液就是_______;②不饱和溶液________是稀溶液;③在一定温度时,同一种溶质的饱和溶液要比它的不饱和溶液______。
知识点2 结晶
5. 当硝酸钾饱和溶液温度降低时,过多的________会从溶液中以______的形式析出,这一过程叫做______。
不一定
稀溶液
不一定
浓
硝酸钾
晶体
结晶
课堂演练
知识点1 饱和溶液与不饱和溶液
【典例1】下面是四位同学对饱和溶液与不饱和溶液的理解,其中正确的是( )
A. 饱和溶液是指不能再溶解物质的溶液
B. 在一定温度下,某物质的饱和溶液是指该温度下该物质浓度最大的溶液
C. 在一定温度下,向饱和KNO3溶液中加入KNO3晶体,溶液质量变大
D. 在一定温度下,饱和的NaCl溶液中不能再溶解KNO3晶体
B
【变式拓展1】室温下,向一定质量的氯化钠溶液中加入10 g 氯化钠固体,充分搅拌后,尚有部分固体未溶解,加入10 g水后,固体全部溶解。下列判断正确的是( )
A. 加水后一定是不饱和溶液
B. 加水前可能是饱和溶液
C. 加水后一定是饱和溶液
D. 加水前一定是饱和溶液
【典例2】在一瓶NaCl饱和溶液中,当温度不变时,加入少量NaCl晶体,则( )
A. 溶液的质量增大 B. 晶体的质量不变
C. 晶体的质量增大 D. 晶体溶解一部分
【变式拓展2】把室温下的不饱和食盐水变成饱和溶液,最好的方法是( )
A. 蒸发水 B. 加食盐 C. 给溶液降温 D. 给溶液升温
D
B
B
思路点拨 (1)溶液的“饱和”与“不饱和”要在“一定温度”“一定量溶剂”前提下才有确定的意义。
(2)判断某种溶液是否饱和,主要看在一定温度下,还能否继续溶解该溶质,若不能则是该溶质的饱和溶液。需要注意的是,某溶质的饱和溶液对另一种溶质来说,不一定是饱和的。
(3)饱和溶液与不饱和溶液的转化,要特别注意温度对物质的溶解度的影响:溶解度随温度升高而增大的物质,其饱和溶液可通过①升温、②加溶剂转化为不饱和溶液;不饱和溶液可通过①降温、②加溶质、③蒸发溶剂转化为饱和溶液;溶解度随温度升高而减小的物质,其饱和溶液可通过①降温、
②加溶剂转化为不饱和溶液;不饱和溶液通过①升温、②加溶质、③蒸发溶剂转化为饱和溶液。
(4)饱和溶液与不饱和溶液、浓溶液与稀溶液是从不同角度表示溶液的方法,不存在包含关系。对于不同溶质来说,饱和溶液不一定是浓溶液(如石灰水);不饱和溶液不一定是稀溶液。但对同一种溶质来说,在一定温度下,饱和溶液一定比不饱和溶液的浓度大。
知识点2 结晶
【典例3】据《说文解字》记载,我们的祖先在神农氏时代就开始利用海水晒盐。海水晒盐的原理是( )
A. 日晒风吹使海水中的氯化钠蒸发
B. 日晒风吹使溶液由饱和变为不饱和
C. 日晒风吹使水分蒸发晶体析出
D. 日晒风吹使氯化钠的质量变大
【变式拓展3】将40 ℃时硝酸钾溶液降温至20 ℃,有少量晶体析出,则下列说法错误的是( )
A. 40 ℃时的溶液一定为饱和溶液
B. 溶剂的质量没有改变
C. 20 ℃时的溶液一定为饱和溶液
D. 20 ℃时的溶液的溶质质量比原来减少
思路点拨 对于大多数溶液,当达到饱和状态时,通过降低温度或者蒸发溶剂可以使溶液的溶质以晶体的形式析出;析出晶体后的溶液仍然是饱和溶液。常利用结晶的方法获得海水中的食盐。
C
A
课堂检测
1. (3分)一定能使饱和溶液变为不饱和溶液的方法是( )
A. 升温 B. 降温 C. 加溶剂 D. 加溶质
2. (3分)20 ℃时,在100 g水中不断加入食盐固体,充分搅拌后过滤,称量所得溶液的质量如下表所列,其中属于饱和溶液的是( )
3. (3分)下述方法:①加水;②加硝酸钾;③蒸发水;④冷却;⑤加热但保持溶液质量不变;⑥加饱和硝酸钾溶液。能使接近饱和的硝酸钾溶液变为饱和溶液的是( )
A. ①②⑤ B. ①⑤⑥ C. ②③④ D. ②④⑥
C
D
C
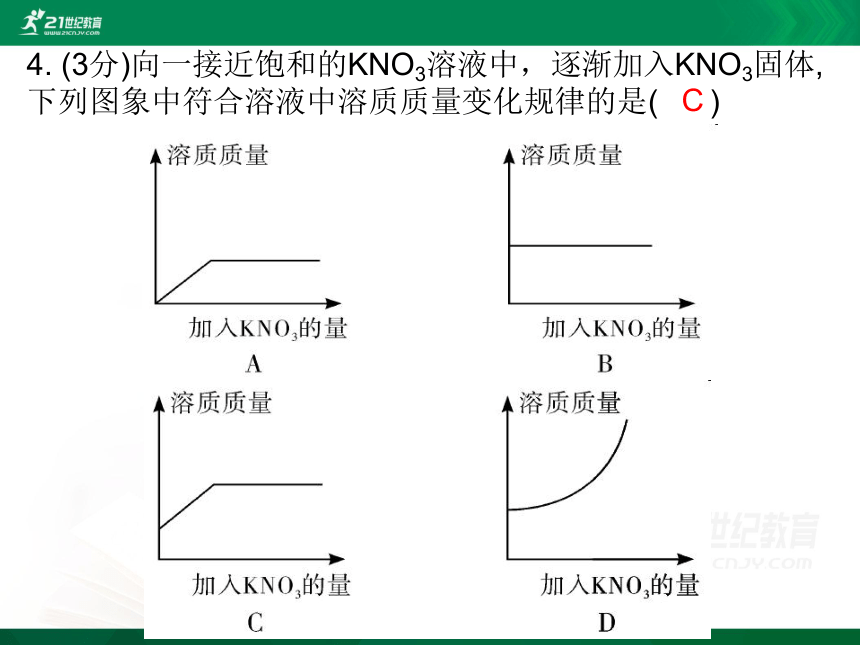
4. (3分)向一接近饱和的KNO3溶液中,逐渐加入KNO3固体,下列图象中符合溶液中溶质质量变化规律的是( )
C
5. (3分)t ℃时,有两瓶硝酸钾溶液,一瓶是饱和溶液(溶质的质量分数为40%),另一瓶是溶质的质量分数为10%的溶液。下列实验操作中,无法区别这两种溶液的是( )
A. 加一定量的水 B. 加入少量的硝酸钾晶体
C. 稍稍降低温度 D. t ℃时蒸发少量水
6. (3分)在温度不变时,某物质的甲溶液,经过如下变化:
则下列叙述不正确的是( )
A. 乙溶液不一定是饱和溶液
B. 丙溶液一定是饱和溶液
C. 乙和丙溶液可能都是饱和溶液
D. 将丙溶液再蒸发10 g水,析出晶体的质量一定是5 g
A
D
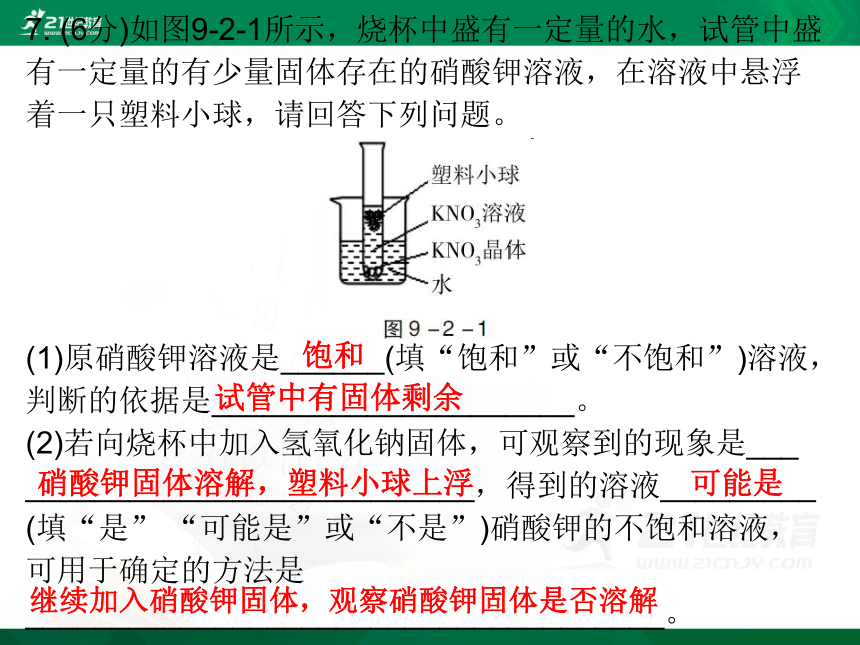
7. (6分)如图9-2-1所示,烧杯中盛有一定量的水,试管中盛有一定量的有少量固体存在的硝酸钾溶液,在溶液中悬浮着一只塑料小球,请回答下列问题。
(1)原硝酸钾溶液是______(填“饱和”或“不饱和”)溶液,判断的依据是_____________________。
(2)若向烧杯中加入氢氧化钠固体,可观察到的现象是___
__________________________,得到的溶液_________
(填“是” “可能是”或“不是”)硝酸钾的不饱和溶液,可用于确定的方法是_____________________________________。
饱和
试管中有固体剩余
硝酸钾固体溶解,塑料小球上浮
可能是
继续加入硝酸钾固体,观察硝酸钾固体是否溶解
8. (6分)如图9-2-2所示,在常温下将一块木块放入盛有饱和食盐水的烧杯中,木块漂浮在食盐水中。
(1)现加入少量食盐晶体,充分搅拌和静置后,在温度不变的情况下,木块在液面沉浮有何变化?________________,并简述理由:___________________________________
______________________________________________
______________________________________________。
(2)若要在不用外力的情况下使木块略上浮,你准备采取的具体方法是_____________________________________
____________________________________________________________________________________________。
沉浮情况不变
课时2 固体的溶解度 混合物的分离
知识梳理
知识点1 固体的溶解度
1. 定义:固体的溶解度表示在________下,某_________在______溶剂里(通常溶剂是水)达到_________时所溶解的质量。
2. 溶解度的相对大小(20 ℃):①溶解度大于_____g,一般称之为易溶;②大于______g,称之为可溶;③小于______g,称之为微溶;小于______g,称之为难溶。
3. 溶解度的含义:20 ℃时NaCl的溶解度为36 g,表示在20 ℃时,在______g水中最多能溶解______g NaCl或在20 ℃时,NaCl在______g水中达到______状态时所溶解的质量为______g。
一定温度
固态物质
100 g
饱和状态
10
1
1
0.01
100
36
100
饱和
36
知识点2 影响固体的溶解度的因素
4. 溶解度的四要素:①条件:_________;②标准:_____
__________;③状态:_____________;④溶解度的单位:______。
5. 影响固体物质溶解度的因素:①内因:______、______的性质(种类);②外因:______,大多数固体物质的溶解度随______的升高而增大,如KNO3;少数固体物质的溶解度受温度变化的影响______,如_______;极少数物质的溶解度随温度升高而______,如_____________。
一定温度
100 g溶剂
达到饱和
g
溶质
溶剂
温度
温度
很小
NaCl
减小
Ca(OH)2
知识点3 固体的溶解度曲线
6. 物质的溶解度随温度变化的曲线叫做_______________,曲线中用纵坐标表示________,横坐标表示______。
知识点4 混合物的分离
7. 混合物的分离方法:
(1)过滤法:_______________________。
(2)结晶法:_______________________。
①蒸发结晶法:即蒸发溶剂使晶体析出,如海水晒盐;
②降温结晶法:即_______________________________,如冬天捞碱。
溶解度曲线
溶解度
温度
分离可溶物和难溶物
分离几种可溶性物质
冷却热的饱和溶液使晶体析出
课堂演练
知识点1 固体的溶解度
【典例1】20 ℃时,50 g水中溶解了18 g食盐就恰好达到饱和。下列关于食盐溶解度的表述中正确的是( )
A. 食盐的溶解度为18 g
B. 食盐的溶解度为36 g
C. 20 ℃时,食盐的溶解度为36 g
D. 20 ℃时,食盐的溶解度为18 g
【变式拓展1】在20 ℃时,往50 g水中加入20 g氯化钾固体。充分搅拌后,仍然有3 g氯化钾未溶解,则20 ℃时,氯化钾的溶解度为( )
A. 3 g B. 34 g C. 50 g D. 70 g
C
B
知识点2 影响固体的溶解度的因素
【典例2】下列与固体溶解度无关的因素是( )
A. 溶质和溶剂量的多少 B. 温度
C. 溶质的性质 D. 溶剂的性质
【变式拓展2】现有一杯20 ℃的硝酸钾不饱和溶液,能改变硝酸钾溶解度的操作是( )
A. 加硝酸钾 B. 充分搅拌
C. 恒温蒸发水 D. 升高温度
思路点拨 影响固体溶解度的因素有内因(溶质的性质和溶剂的性质)、外因(温度),但与溶质、溶剂的量的多少无关。
A
D
知识点3 固体的溶解度曲线
【典例3】如图9-2-3是熟石灰的溶解度曲线,下列说法正确的是( )
A. 熟石灰属于易溶物
B. 任何固体的溶解度都随温度的升高而变大
C. 石灰水中溶质的质量随温度的升高而增大
D. 把20 ℃时澄清饱和石灰水升温到100 ℃溶液变浑浊
D
【变式拓展3】现有a、b两种物质在室温下的饱和溶液,
升高温度后,a溶液有晶体析出,b溶液还可以再溶解b晶体。则图中能正确表示a、b两种物质溶解度随温度变化的曲线的是( )
B
【典例4】蔗糖是生活中常用的调味品,其溶解度曲线如图9-2-4所示。下列说法正确的是( )
A. 蔗糖在热水中的溶解度比在冷水中的小
B. 将蔗糖饱和溶液蒸发溶剂后恢复至原温度,有结晶现象
C. 温度升高,溶液中蔗糖的质量分数一定增大
D. t1 ℃和t2 ℃时的两份蔗糖溶液,所含溶质的质量不可能相等
B
【变式拓展4】如图9-2-5是X、Y两种固体物质的溶解度曲线,下列说法中错误的是( )
A. X、Y两种物质的溶解度都随温度升高而增大
B. X物质的溶解度大于Y物质的溶解度
C. 降低温度可使接近饱和的X溶液变为饱和溶液
D. t ℃时,X物质和Y物质的溶解度相等
B
思路点拨 溶解度通常结合溶解度表或溶解度曲线进行考查,是中考的必考点,常涉及以下几个角度考查:
(1)比较溶解度大小:根据指定的温度,由各物质曲线上的点的高低来确定溶解度的大小。
(2)饱和溶液与不饱和溶液的判断:
①根据溶解度计算出达到饱和状态时所需溶质的质量,再与所给的溶质质量比较,比所给溶质质量大的是不饱和溶液,反之则为饱和溶液;②饱和溶液降温或升温后溶液状态的判断:若曲线是上升型,降温后仍为饱和溶液,升温后为不饱和溶液;若为下降型,降温后为不饱和溶液,升温后为饱和溶液。
(3)有相同溶解度的温度范围:
①利用表格数据直接判断:若t1 ℃时溶解度A>B,t2 ℃时,溶解度A(4)判断结晶方法:
①溶解度受温度影响较小的物质:蒸发结晶;
②溶解度受温度影响较大的物质:降温结晶。
(5)温度变化时是否有晶体析出:
①判断温度改变前后溶液是否饱和;
②判断溶解度随温度变化的趋势:如果溶解度随温度升高而增大,饱和溶液降温后一定有晶体析出,不饱和溶液降温后则不一定有晶体析出。
(6)降温时析出晶体质量的计算和比较:①析出晶体的质量为两个温度下溶液所含溶质差。若降温前溶质质量已知且溶剂为100 g时,则析出晶体的质量=降温前的溶质质量-降温后的溶解度;②一定温度下等质量的两种饱和溶液降低相同的温度时,溶解度受温度影响大的析出的晶体质量大。
知识点4 混合物的分离
【典例5】若要从饱和的氯化钠溶液中获得较多的晶体,下列方法中,你认为最合理的是( )
A. 升高溶液的温度 B. 蒸发溶剂
C. 降低溶液的温度 D. 从溶液中倒掉一部分水
【变式扩展5】夏天,实验员在实验室里配制了一瓶饱和的硝酸钾溶液并密封放置,到了冬天发现瓶底有大量的晶体析出。这是因为( )
A. 溶液中溶剂质量减小
B. 变成了不饱和溶液
C. 温度下降,硝酸钾溶解度变小
D. 溶液中溶质质量增加
思路点拨 当溶液中有两种溶质时,要提纯物质的溶解度受温度影响较大时(如提纯硝酸钾),可采用降温结晶法(或冷却热饱和溶液法);受温度影响较小时(如提纯氯化钠),可采用恒温蒸发溶剂法。
B
C
课堂检测
1. (3分)在60 ℃时50 g水中溶解55 g硝酸钾就刚好饱和。下列说法正确的是( )
A. 硝酸钾的溶解度是55 g
B. 60 ℃时硝酸钾的溶解度是55 g
C. 硝酸钾的溶解度是110 g
D. 60 ℃时硝酸钾的溶解度是110 g
D
2. (3分)图9-2-6为甲、乙两种固体在水中的溶解度曲线,下列说法错误的是( )
A. 升高温度能使乙物质的不饱和溶液变成饱和溶液
B. 在t1 ℃时M点表示甲、乙两物质的溶解度相等
C. 在t1 ℃时,50 g水可以溶解25 g甲物质
D. 在t2 ℃时,N点表示甲物质的不饱和溶液
C
3. (3分)氢氧化钙的溶解度随温度升高而减小。要想把一瓶接近饱和的石灰水变成饱和,具体措施有①加入氢氧化钙、②升高温度、③降低温度、④加入水、⑤蒸发水。其中正确的是( )
A. ①②④ B. ①③④ C. ①③⑤ D. ①②⑤
4. (3分)如图9-2-7是a、b、c三种物质的溶解度曲线,下列说法错误的是( )
A. t2 ℃时,a、b、c三种物质的溶解
度由大到小的顺序是a>b>c
B. P点表示t1 ℃时,a、c两种物质的
溶解度相等
C. 将c的饱和溶液变为不饱和溶液,可采
用降温的方法
D. t2 ℃时,将30 g a物质加入50 g水中
充分搅拌,得到80 g a的饱和溶液
D
D
5. (3分)KNO3与NaCl的溶解度曲线如图9-2-8所示。下列说法正确的是( )
A. KNO3的溶解度大于NaCl的溶解度
B. 用冷却热饱和溶液的方法,能使KNO3从溶液中结晶析出
C. t1 ℃时,KNO3溶液与NaCl溶液溶质的质量分数相等
D. 两饱和溶液分别由t2 ℃降温至t1 ℃,析出晶体一样多
B
6. (7分)A、B、C三种固体物质的溶解度曲线如图9-2-9所示。据图完成下列各题:
(1)升高温度,接近饱和的______物质溶液会变得饱和。
(2)10 ℃时,三种物质溶解度大小关系为___________。
(3)35 ℃时,A物质的饱和溶液中:溶质、溶剂、溶液的质量比为_______________。
C
B>A=C
3∶10∶13
(4)20 ℃时,25 g B物质放入到盛100 g水的烧杯中,充分溶解后溶液是______(填“饱和”或“不饱和”)溶液。
(5)20 ℃时,取100 g A物质的饱和溶液,将温度升高到35 ℃,此时溶液中溶质的质量______(填“变大”“变小”或“不变”)。
(6)要将A从它的饱和溶液中结晶出来,最好采取________的方法,而要将B从它的饱和溶液中大量析出,最好采取_________的方法。
饱和
不变
降温结晶
蒸发结晶
7. (8分)根据下表中的数据,回答下列问题。
(1)40 ℃时,NaCl的溶解度是________。
(2)20 ℃时,称取31.6g KNO3固体加入盛有100g水的烧杯中,充分溶解形成的溶液是______(填“饱和”或“不饱和”)溶液;称取31.6g KNO3固体时,发现托盘天平指针偏右,接下来的操作是____________________________。
36.6g
饱和
继续加KNO3固体至天平平衡
(3)当KNO3中混有少量NaCl时,提纯KNO3所采用的方法为_____________________________________。
(4)将等质量KNO3的饱和溶液和NaCl的饱和溶液从60 ℃降温到20 ℃,下列对所得溶液的叙述正确的是______(填字母,多选)。
A. 都是饱和溶液
B. 溶剂质量:KNO3>NaCl
C. 溶液质量:KNO3<NaCl
降温结晶(或冷却热饱和溶液)
AC
课时3 气体的溶解度
知识梳理
知识点 气体的溶解度
1. 气体溶解度的定义:在压强为________和__________时,在______水里达到______________时所溶解的气体______。
2. 影响因素①___________;②____________________;
③______________________。
3. ______________________,可以增加养鱼池水中氧气的溶解量;向鱼缸通入______可以增加水中的含氧量。
101 kPa
一定温度
1体积
饱和状态
体积
气体的性质
温度越高,气体溶解度越小
压强越大,气体溶解度越大
把水喷向空中
氧气
课堂演练
知识点 气体的溶解度
【典例1】据新闻报道,夏天经常有啤酒瓶自爆伤人的事件发生,其主要原因是( )
A. 温度升高,气体的溶解度减小
B. 压强增大,气体的溶解度增大
C. 温度升高,气体的溶解度增大
D. 压强增大,气体的溶解度减小
【变式拓展1】小欣拉开易拉罐汽水的拉环时,听到“啵”的一声,并有气体自汽水中冲出。下列有关此现象的说明正确的是( )
A. 因压强减小使气体的溶解度变小
B. 因压强增大使气体的溶解度变小
C. 因温度升高使气体的溶解度变小
D. 因温度降低使气体的溶解度变小
A
A
思路点拨 影响气体溶解度的三个因素:①气体的性质;②温度越高,气体溶解度越小;③压强越大,气体溶解度越大。
课堂检测
1. (3分)下列与气体溶解度有关的是( )
①温度 ②压强 ③溶剂的质量 ④溶质的质量
A. ①② B. ② C. ②③ D. ①④
2. (3分)压强增大时,其在水中的溶解度不受影响的是( )
A. NH3 B. SO2 C. CO2 D. KCl
3. (3分)小林用凉开水养鱼,不一会儿鱼全死了。下列解释合理的是( )
A. 凉开水中几乎不含氧原子
B. 凉开水中几乎不含氧分子
C. 凉开水中几乎不含水分子
D. 凉开水中几乎不含氧元素
A
D
B
4. (3分)佛山市三水健力宝生产的“魔水”驰名中外。“魔水”内溶有一定量的二氧化碳气体。打开瓶塞,“魔水”会自动喷出;喝了“魔水”后常会打嗝。说明气体在水中的溶解度与压强、温度有关。以下关于气体溶解度的说法正确的是( )
A. 压强增大,气体溶解度不变
B. 压强减小,气体溶解度增大
C. 温度升高,气体溶解度减小
D. 温度降低,气体溶解度减小
5. (6分)夏天,暴雨来临之前,鱼塘里的鱼常会出现“浮头”现象,你知道是 什么原因吗?______________________
_____________________________________。假如你承包了这个鱼塘,你将采取哪些措施增加鱼塘中氧气的含量?______________________________________________。
C
通过水泵将鱼塘的水喷向空中,以增大水中的含氧量
6. (12分)啤酒是生活中常见的饮料,其中含有二氧化碳、水和蛋白质等物质。
(1)观察一瓶啤酒,未见气泡;打开啤酒瓶盖,会冒出大量气泡,原因是___________________________________。
(2)要使啤酒冒出更多的气泡,除可采用振荡或搅拌的方法外,其他方法有:______。
(3)已知从啤酒中产生的气体是CO2,请你设计2种实验方法检验啤酒中的CO2,请在下表中写出必要的实验步骤和实验现象。
压强减小,原先溶解在啤酒中的气体的溶解度减小
加热
将啤酒中跑出的气体用导管导出,通入澄清石灰水中
石灰水变浑浊
将啤酒中跑出的气体用导管导出,通入紫色石蕊溶液中
紫色石蕊溶液变红色
谢谢
21世纪教育网(www.21cnjy.com) 中小学教育资源网站
有大把高质量资料?一线教师?一线教研员?
欢迎加入21世纪教育网教师合作团队!!月薪过万不是梦!!
详情请看:
https://www.21cnjy.com/help/help_extract.php
第九单元 溶液
课题2 溶解度
课时1 饱和溶液与不饱和溶液 结晶
知识梳理
知识点1 饱和溶液与不饱和溶液
1. 在一定______下,向一定量______里加入某种溶质,当溶质_________________时,所得到的溶液叫做这种溶质的_________;_______________的溶液叫做这种溶质的_____________。判断溶液是否饱和的方法:继续加入______,看能否继续溶解。
2. 只有指明“_____________”和“_________________”,溶液的“饱和”和“不饱和”才有确定的意义。
3. 对于大多数溶液而言,不饱和溶液可以通过_________、_________、__________等方法变成饱和溶液;饱和溶液可以通过_________、_________等方法变成不饱和溶液。
温度
溶剂
不能继续溶解
饱和溶液
还能继续溶解
不饱和溶液
溶质
在一定温度下
在一定量溶剂里
增加溶质
蒸发溶剂
降低温度
增加溶剂
升高温度
4. 浓、稀溶液与饱和不饱和溶液之间的关系:①饱和溶液________是浓溶液,如饱和的石灰水溶液就是_______;②不饱和溶液________是稀溶液;③在一定温度时,同一种溶质的饱和溶液要比它的不饱和溶液______。
知识点2 结晶
5. 当硝酸钾饱和溶液温度降低时,过多的________会从溶液中以______的形式析出,这一过程叫做______。
不一定
稀溶液
不一定
浓
硝酸钾
晶体
结晶
课堂演练
知识点1 饱和溶液与不饱和溶液
【典例1】下面是四位同学对饱和溶液与不饱和溶液的理解,其中正确的是( )
A. 饱和溶液是指不能再溶解物质的溶液
B. 在一定温度下,某物质的饱和溶液是指该温度下该物质浓度最大的溶液
C. 在一定温度下,向饱和KNO3溶液中加入KNO3晶体,溶液质量变大
D. 在一定温度下,饱和的NaCl溶液中不能再溶解KNO3晶体
B
【变式拓展1】室温下,向一定质量的氯化钠溶液中加入10 g 氯化钠固体,充分搅拌后,尚有部分固体未溶解,加入10 g水后,固体全部溶解。下列判断正确的是( )
A. 加水后一定是不饱和溶液
B. 加水前可能是饱和溶液
C. 加水后一定是饱和溶液
D. 加水前一定是饱和溶液
【典例2】在一瓶NaCl饱和溶液中,当温度不变时,加入少量NaCl晶体,则( )
A. 溶液的质量增大 B. 晶体的质量不变
C. 晶体的质量增大 D. 晶体溶解一部分
【变式拓展2】把室温下的不饱和食盐水变成饱和溶液,最好的方法是( )
A. 蒸发水 B. 加食盐 C. 给溶液降温 D. 给溶液升温
D
B
B
思路点拨 (1)溶液的“饱和”与“不饱和”要在“一定温度”“一定量溶剂”前提下才有确定的意义。
(2)判断某种溶液是否饱和,主要看在一定温度下,还能否继续溶解该溶质,若不能则是该溶质的饱和溶液。需要注意的是,某溶质的饱和溶液对另一种溶质来说,不一定是饱和的。
(3)饱和溶液与不饱和溶液的转化,要特别注意温度对物质的溶解度的影响:溶解度随温度升高而增大的物质,其饱和溶液可通过①升温、②加溶剂转化为不饱和溶液;不饱和溶液可通过①降温、②加溶质、③蒸发溶剂转化为饱和溶液;溶解度随温度升高而减小的物质,其饱和溶液可通过①降温、
②加溶剂转化为不饱和溶液;不饱和溶液通过①升温、②加溶质、③蒸发溶剂转化为饱和溶液。
(4)饱和溶液与不饱和溶液、浓溶液与稀溶液是从不同角度表示溶液的方法,不存在包含关系。对于不同溶质来说,饱和溶液不一定是浓溶液(如石灰水);不饱和溶液不一定是稀溶液。但对同一种溶质来说,在一定温度下,饱和溶液一定比不饱和溶液的浓度大。
知识点2 结晶
【典例3】据《说文解字》记载,我们的祖先在神农氏时代就开始利用海水晒盐。海水晒盐的原理是( )
A. 日晒风吹使海水中的氯化钠蒸发
B. 日晒风吹使溶液由饱和变为不饱和
C. 日晒风吹使水分蒸发晶体析出
D. 日晒风吹使氯化钠的质量变大
【变式拓展3】将40 ℃时硝酸钾溶液降温至20 ℃,有少量晶体析出,则下列说法错误的是( )
A. 40 ℃时的溶液一定为饱和溶液
B. 溶剂的质量没有改变
C. 20 ℃时的溶液一定为饱和溶液
D. 20 ℃时的溶液的溶质质量比原来减少
思路点拨 对于大多数溶液,当达到饱和状态时,通过降低温度或者蒸发溶剂可以使溶液的溶质以晶体的形式析出;析出晶体后的溶液仍然是饱和溶液。常利用结晶的方法获得海水中的食盐。
C
A
课堂检测
1. (3分)一定能使饱和溶液变为不饱和溶液的方法是( )
A. 升温 B. 降温 C. 加溶剂 D. 加溶质
2. (3分)20 ℃时,在100 g水中不断加入食盐固体,充分搅拌后过滤,称量所得溶液的质量如下表所列,其中属于饱和溶液的是( )
3. (3分)下述方法:①加水;②加硝酸钾;③蒸发水;④冷却;⑤加热但保持溶液质量不变;⑥加饱和硝酸钾溶液。能使接近饱和的硝酸钾溶液变为饱和溶液的是( )
A. ①②⑤ B. ①⑤⑥ C. ②③④ D. ②④⑥
C
D
C
4. (3分)向一接近饱和的KNO3溶液中,逐渐加入KNO3固体,下列图象中符合溶液中溶质质量变化规律的是( )
C
5. (3分)t ℃时,有两瓶硝酸钾溶液,一瓶是饱和溶液(溶质的质量分数为40%),另一瓶是溶质的质量分数为10%的溶液。下列实验操作中,无法区别这两种溶液的是( )
A. 加一定量的水 B. 加入少量的硝酸钾晶体
C. 稍稍降低温度 D. t ℃时蒸发少量水
6. (3分)在温度不变时,某物质的甲溶液,经过如下变化:
则下列叙述不正确的是( )
A. 乙溶液不一定是饱和溶液
B. 丙溶液一定是饱和溶液
C. 乙和丙溶液可能都是饱和溶液
D. 将丙溶液再蒸发10 g水,析出晶体的质量一定是5 g
A
D
7. (6分)如图9-2-1所示,烧杯中盛有一定量的水,试管中盛有一定量的有少量固体存在的硝酸钾溶液,在溶液中悬浮着一只塑料小球,请回答下列问题。
(1)原硝酸钾溶液是______(填“饱和”或“不饱和”)溶液,判断的依据是_____________________。
(2)若向烧杯中加入氢氧化钠固体,可观察到的现象是___
__________________________,得到的溶液_________
(填“是” “可能是”或“不是”)硝酸钾的不饱和溶液,可用于确定的方法是_____________________________________。
饱和
试管中有固体剩余
硝酸钾固体溶解,塑料小球上浮
可能是
继续加入硝酸钾固体,观察硝酸钾固体是否溶解
8. (6分)如图9-2-2所示,在常温下将一块木块放入盛有饱和食盐水的烧杯中,木块漂浮在食盐水中。
(1)现加入少量食盐晶体,充分搅拌和静置后,在温度不变的情况下,木块在液面沉浮有何变化?________________,并简述理由:___________________________________
______________________________________________
______________________________________________。
(2)若要在不用外力的情况下使木块略上浮,你准备采取的具体方法是_____________________________________
____________________________________________________________________________________________。
沉浮情况不变
课时2 固体的溶解度 混合物的分离
知识梳理
知识点1 固体的溶解度
1. 定义:固体的溶解度表示在________下,某_________在______溶剂里(通常溶剂是水)达到_________时所溶解的质量。
2. 溶解度的相对大小(20 ℃):①溶解度大于_____g,一般称之为易溶;②大于______g,称之为可溶;③小于______g,称之为微溶;小于______g,称之为难溶。
3. 溶解度的含义:20 ℃时NaCl的溶解度为36 g,表示在20 ℃时,在______g水中最多能溶解______g NaCl或在20 ℃时,NaCl在______g水中达到______状态时所溶解的质量为______g。
一定温度
固态物质
100 g
饱和状态
10
1
1
0.01
100
36
100
饱和
36
知识点2 影响固体的溶解度的因素
4. 溶解度的四要素:①条件:_________;②标准:_____
__________;③状态:_____________;④溶解度的单位:______。
5. 影响固体物质溶解度的因素:①内因:______、______的性质(种类);②外因:______,大多数固体物质的溶解度随______的升高而增大,如KNO3;少数固体物质的溶解度受温度变化的影响______,如_______;极少数物质的溶解度随温度升高而______,如_____________。
一定温度
100 g溶剂
达到饱和
g
溶质
溶剂
温度
温度
很小
NaCl
减小
Ca(OH)2
知识点3 固体的溶解度曲线
6. 物质的溶解度随温度变化的曲线叫做_______________,曲线中用纵坐标表示________,横坐标表示______。
知识点4 混合物的分离
7. 混合物的分离方法:
(1)过滤法:_______________________。
(2)结晶法:_______________________。
①蒸发结晶法:即蒸发溶剂使晶体析出,如海水晒盐;
②降温结晶法:即_______________________________,如冬天捞碱。
溶解度曲线
溶解度
温度
分离可溶物和难溶物
分离几种可溶性物质
冷却热的饱和溶液使晶体析出
课堂演练
知识点1 固体的溶解度
【典例1】20 ℃时,50 g水中溶解了18 g食盐就恰好达到饱和。下列关于食盐溶解度的表述中正确的是( )
A. 食盐的溶解度为18 g
B. 食盐的溶解度为36 g
C. 20 ℃时,食盐的溶解度为36 g
D. 20 ℃时,食盐的溶解度为18 g
【变式拓展1】在20 ℃时,往50 g水中加入20 g氯化钾固体。充分搅拌后,仍然有3 g氯化钾未溶解,则20 ℃时,氯化钾的溶解度为( )
A. 3 g B. 34 g C. 50 g D. 70 g
C
B
知识点2 影响固体的溶解度的因素
【典例2】下列与固体溶解度无关的因素是( )
A. 溶质和溶剂量的多少 B. 温度
C. 溶质的性质 D. 溶剂的性质
【变式拓展2】现有一杯20 ℃的硝酸钾不饱和溶液,能改变硝酸钾溶解度的操作是( )
A. 加硝酸钾 B. 充分搅拌
C. 恒温蒸发水 D. 升高温度
思路点拨 影响固体溶解度的因素有内因(溶质的性质和溶剂的性质)、外因(温度),但与溶质、溶剂的量的多少无关。
A
D
知识点3 固体的溶解度曲线
【典例3】如图9-2-3是熟石灰的溶解度曲线,下列说法正确的是( )
A. 熟石灰属于易溶物
B. 任何固体的溶解度都随温度的升高而变大
C. 石灰水中溶质的质量随温度的升高而增大
D. 把20 ℃时澄清饱和石灰水升温到100 ℃溶液变浑浊
D
【变式拓展3】现有a、b两种物质在室温下的饱和溶液,
升高温度后,a溶液有晶体析出,b溶液还可以再溶解b晶体。则图中能正确表示a、b两种物质溶解度随温度变化的曲线的是( )
B
【典例4】蔗糖是生活中常用的调味品,其溶解度曲线如图9-2-4所示。下列说法正确的是( )
A. 蔗糖在热水中的溶解度比在冷水中的小
B. 将蔗糖饱和溶液蒸发溶剂后恢复至原温度,有结晶现象
C. 温度升高,溶液中蔗糖的质量分数一定增大
D. t1 ℃和t2 ℃时的两份蔗糖溶液,所含溶质的质量不可能相等
B
【变式拓展4】如图9-2-5是X、Y两种固体物质的溶解度曲线,下列说法中错误的是( )
A. X、Y两种物质的溶解度都随温度升高而增大
B. X物质的溶解度大于Y物质的溶解度
C. 降低温度可使接近饱和的X溶液变为饱和溶液
D. t ℃时,X物质和Y物质的溶解度相等
B
思路点拨 溶解度通常结合溶解度表或溶解度曲线进行考查,是中考的必考点,常涉及以下几个角度考查:
(1)比较溶解度大小:根据指定的温度,由各物质曲线上的点的高低来确定溶解度的大小。
(2)饱和溶液与不饱和溶液的判断:
①根据溶解度计算出达到饱和状态时所需溶质的质量,再与所给的溶质质量比较,比所给溶质质量大的是不饱和溶液,反之则为饱和溶液;②饱和溶液降温或升温后溶液状态的判断:若曲线是上升型,降温后仍为饱和溶液,升温后为不饱和溶液;若为下降型,降温后为不饱和溶液,升温后为饱和溶液。
(3)有相同溶解度的温度范围:
①利用表格数据直接判断:若t1 ℃时溶解度A>B,t2 ℃时,溶解度A
①溶解度受温度影响较小的物质:蒸发结晶;
②溶解度受温度影响较大的物质:降温结晶。
(5)温度变化时是否有晶体析出:
①判断温度改变前后溶液是否饱和;
②判断溶解度随温度变化的趋势:如果溶解度随温度升高而增大,饱和溶液降温后一定有晶体析出,不饱和溶液降温后则不一定有晶体析出。
(6)降温时析出晶体质量的计算和比较:①析出晶体的质量为两个温度下溶液所含溶质差。若降温前溶质质量已知且溶剂为100 g时,则析出晶体的质量=降温前的溶质质量-降温后的溶解度;②一定温度下等质量的两种饱和溶液降低相同的温度时,溶解度受温度影响大的析出的晶体质量大。
知识点4 混合物的分离
【典例5】若要从饱和的氯化钠溶液中获得较多的晶体,下列方法中,你认为最合理的是( )
A. 升高溶液的温度 B. 蒸发溶剂
C. 降低溶液的温度 D. 从溶液中倒掉一部分水
【变式扩展5】夏天,实验员在实验室里配制了一瓶饱和的硝酸钾溶液并密封放置,到了冬天发现瓶底有大量的晶体析出。这是因为( )
A. 溶液中溶剂质量减小
B. 变成了不饱和溶液
C. 温度下降,硝酸钾溶解度变小
D. 溶液中溶质质量增加
思路点拨 当溶液中有两种溶质时,要提纯物质的溶解度受温度影响较大时(如提纯硝酸钾),可采用降温结晶法(或冷却热饱和溶液法);受温度影响较小时(如提纯氯化钠),可采用恒温蒸发溶剂法。
B
C
课堂检测
1. (3分)在60 ℃时50 g水中溶解55 g硝酸钾就刚好饱和。下列说法正确的是( )
A. 硝酸钾的溶解度是55 g
B. 60 ℃时硝酸钾的溶解度是55 g
C. 硝酸钾的溶解度是110 g
D. 60 ℃时硝酸钾的溶解度是110 g
D
2. (3分)图9-2-6为甲、乙两种固体在水中的溶解度曲线,下列说法错误的是( )
A. 升高温度能使乙物质的不饱和溶液变成饱和溶液
B. 在t1 ℃时M点表示甲、乙两物质的溶解度相等
C. 在t1 ℃时,50 g水可以溶解25 g甲物质
D. 在t2 ℃时,N点表示甲物质的不饱和溶液
C
3. (3分)氢氧化钙的溶解度随温度升高而减小。要想把一瓶接近饱和的石灰水变成饱和,具体措施有①加入氢氧化钙、②升高温度、③降低温度、④加入水、⑤蒸发水。其中正确的是( )
A. ①②④ B. ①③④ C. ①③⑤ D. ①②⑤
4. (3分)如图9-2-7是a、b、c三种物质的溶解度曲线,下列说法错误的是( )
A. t2 ℃时,a、b、c三种物质的溶解
度由大到小的顺序是a>b>c
B. P点表示t1 ℃时,a、c两种物质的
溶解度相等
C. 将c的饱和溶液变为不饱和溶液,可采
用降温的方法
D. t2 ℃时,将30 g a物质加入50 g水中
充分搅拌,得到80 g a的饱和溶液
D
D
5. (3分)KNO3与NaCl的溶解度曲线如图9-2-8所示。下列说法正确的是( )
A. KNO3的溶解度大于NaCl的溶解度
B. 用冷却热饱和溶液的方法,能使KNO3从溶液中结晶析出
C. t1 ℃时,KNO3溶液与NaCl溶液溶质的质量分数相等
D. 两饱和溶液分别由t2 ℃降温至t1 ℃,析出晶体一样多
B
6. (7分)A、B、C三种固体物质的溶解度曲线如图9-2-9所示。据图完成下列各题:
(1)升高温度,接近饱和的______物质溶液会变得饱和。
(2)10 ℃时,三种物质溶解度大小关系为___________。
(3)35 ℃时,A物质的饱和溶液中:溶质、溶剂、溶液的质量比为_______________。
C
B>A=C
3∶10∶13
(4)20 ℃时,25 g B物质放入到盛100 g水的烧杯中,充分溶解后溶液是______(填“饱和”或“不饱和”)溶液。
(5)20 ℃时,取100 g A物质的饱和溶液,将温度升高到35 ℃,此时溶液中溶质的质量______(填“变大”“变小”或“不变”)。
(6)要将A从它的饱和溶液中结晶出来,最好采取________的方法,而要将B从它的饱和溶液中大量析出,最好采取_________的方法。
饱和
不变
降温结晶
蒸发结晶
7. (8分)根据下表中的数据,回答下列问题。
(1)40 ℃时,NaCl的溶解度是________。
(2)20 ℃时,称取31.6g KNO3固体加入盛有100g水的烧杯中,充分溶解形成的溶液是______(填“饱和”或“不饱和”)溶液;称取31.6g KNO3固体时,发现托盘天平指针偏右,接下来的操作是____________________________。
36.6g
饱和
继续加KNO3固体至天平平衡
(3)当KNO3中混有少量NaCl时,提纯KNO3所采用的方法为_____________________________________。
(4)将等质量KNO3的饱和溶液和NaCl的饱和溶液从60 ℃降温到20 ℃,下列对所得溶液的叙述正确的是______(填字母,多选)。
A. 都是饱和溶液
B. 溶剂质量:KNO3>NaCl
C. 溶液质量:KNO3<NaCl
降温结晶(或冷却热饱和溶液)
AC
课时3 气体的溶解度
知识梳理
知识点 气体的溶解度
1. 气体溶解度的定义:在压强为________和__________时,在______水里达到______________时所溶解的气体______。
2. 影响因素①___________;②____________________;
③______________________。
3. ______________________,可以增加养鱼池水中氧气的溶解量;向鱼缸通入______可以增加水中的含氧量。
101 kPa
一定温度
1体积
饱和状态
体积
气体的性质
温度越高,气体溶解度越小
压强越大,气体溶解度越大
把水喷向空中
氧气
课堂演练
知识点 气体的溶解度
【典例1】据新闻报道,夏天经常有啤酒瓶自爆伤人的事件发生,其主要原因是( )
A. 温度升高,气体的溶解度减小
B. 压强增大,气体的溶解度增大
C. 温度升高,气体的溶解度增大
D. 压强增大,气体的溶解度减小
【变式拓展1】小欣拉开易拉罐汽水的拉环时,听到“啵”的一声,并有气体自汽水中冲出。下列有关此现象的说明正确的是( )
A. 因压强减小使气体的溶解度变小
B. 因压强增大使气体的溶解度变小
C. 因温度升高使气体的溶解度变小
D. 因温度降低使气体的溶解度变小
A
A
思路点拨 影响气体溶解度的三个因素:①气体的性质;②温度越高,气体溶解度越小;③压强越大,气体溶解度越大。
课堂检测
1. (3分)下列与气体溶解度有关的是( )
①温度 ②压强 ③溶剂的质量 ④溶质的质量
A. ①② B. ② C. ②③ D. ①④
2. (3分)压强增大时,其在水中的溶解度不受影响的是( )
A. NH3 B. SO2 C. CO2 D. KCl
3. (3分)小林用凉开水养鱼,不一会儿鱼全死了。下列解释合理的是( )
A. 凉开水中几乎不含氧原子
B. 凉开水中几乎不含氧分子
C. 凉开水中几乎不含水分子
D. 凉开水中几乎不含氧元素
A
D
B
4. (3分)佛山市三水健力宝生产的“魔水”驰名中外。“魔水”内溶有一定量的二氧化碳气体。打开瓶塞,“魔水”会自动喷出;喝了“魔水”后常会打嗝。说明气体在水中的溶解度与压强、温度有关。以下关于气体溶解度的说法正确的是( )
A. 压强增大,气体溶解度不变
B. 压强减小,气体溶解度增大
C. 温度升高,气体溶解度减小
D. 温度降低,气体溶解度减小
5. (6分)夏天,暴雨来临之前,鱼塘里的鱼常会出现“浮头”现象,你知道是 什么原因吗?______________________
_____________________________________。假如你承包了这个鱼塘,你将采取哪些措施增加鱼塘中氧气的含量?______________________________________________。
C
通过水泵将鱼塘的水喷向空中,以增大水中的含氧量
6. (12分)啤酒是生活中常见的饮料,其中含有二氧化碳、水和蛋白质等物质。
(1)观察一瓶啤酒,未见气泡;打开啤酒瓶盖,会冒出大量气泡,原因是___________________________________。
(2)要使啤酒冒出更多的气泡,除可采用振荡或搅拌的方法外,其他方法有:______。
(3)已知从啤酒中产生的气体是CO2,请你设计2种实验方法检验啤酒中的CO2,请在下表中写出必要的实验步骤和实验现象。
压强减小,原先溶解在啤酒中的气体的溶解度减小
加热
将啤酒中跑出的气体用导管导出,通入澄清石灰水中
石灰水变浑浊
将啤酒中跑出的气体用导管导出,通入紫色石蕊溶液中
紫色石蕊溶液变红色
谢谢
21世纪教育网(www.21cnjy.com) 中小学教育资源网站
有大把高质量资料?一线教师?一线教研员?
欢迎加入21世纪教育网教师合作团队!!月薪过万不是梦!!
详情请看:
https://www.21cnjy.com/help/help_extract.php
同课章节目录
