选修3第一章 原子结构与性质 归纳与整理
文档属性
| 名称 | 选修3第一章 原子结构与性质 归纳与整理 |

|
|
| 格式 | zip | ||
| 文件大小 | 177.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-03-07 00:00:00 | ||
图片预览





文档简介
(共18张PPT)
归纳与整理
《原子结构与性质》
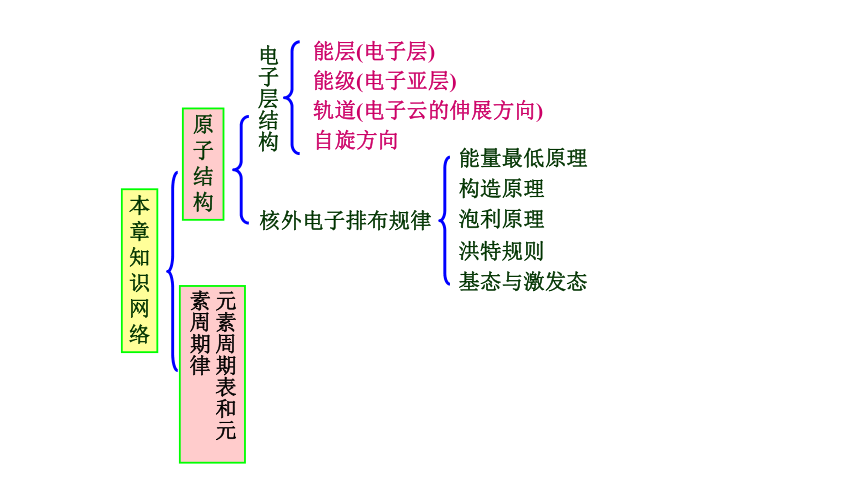
本章知识网络
原子结构
电子层结构
核外电子排布规律
能量最低原理
泡利原理
洪特规则
构造原理
基态与激发态
能层(电子层)
能级(电子亚层)
轨道(电子云的伸展方向)
自旋方向
元素周期表和元素周期律
一、能层、能级、原子轨道之间的关系:
能层n 1 2 3 4 …
符 号 K L M N …
能级 s s p s p d s p d f …
轨道数 1 1 3 1 3 5 1 3 5 7 …
最多容纳的电子数 2 2 6 2 6 10 2 6 10 14 …
2 8 18 32 2n2
2、下列说法中正确的是( )
A. 处于最低能量的原子叫做基态原子
B. 3p2表示3p能级有两个轨道
C. 同一原子中,1s、2s、3s电子的能量逐渐减小
D. 同一原子中,2p、3p、4p能级的轨道数依次增多
A
1、下列各电子能层中,不包含 d 能级的是 ( )
A、N能层 B、M能层 C、L能层 D、K能层
CD
二、核外电子排布规律:
构造原理
关键点:电子排入轨道的顺序。
从第四能层开始,该能层的ns与np能级之间插入了(n-1)层的d能级,第六能层开始还插入(n-2)f。
其能量关系是:ns<(n-2)f < (n-1)d <np
能量最低原理
泡利原理
洪特规则
整个原子
处于能量
最低状态
二、核外电子排布规律
用电子排布图表示出铁原子的核外电子排布
↑↓
↑↓
↑↓
↑↓
↑↓
↑↓
↑↓
↑↓
↑↓
↑↓
↑↓
↑
↑
↑
↑
洪特规则
泡利原理
能量最低原理
构造原理
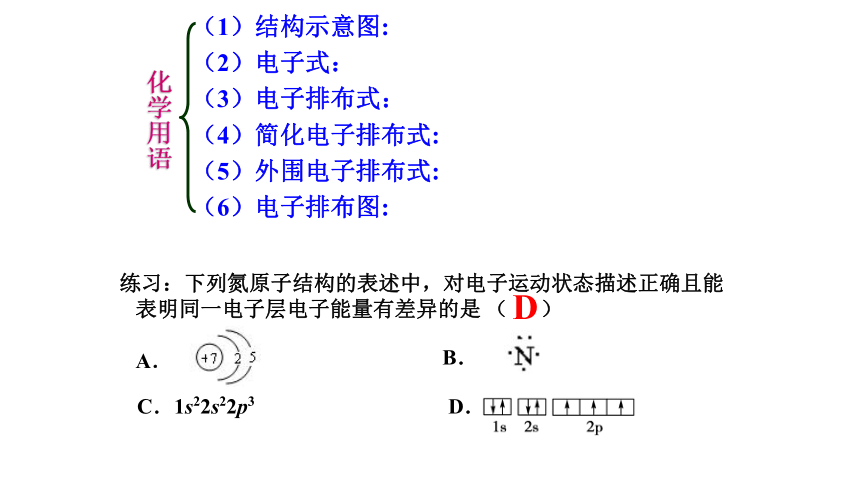
(1)结构示意图:
(2)电子式:
(3)电子排布式:
(4)简化电子排布式:
(5)外围电子排布式:
(6)电子排布图:
化学用语
练习:下列氮原子结构的表述中,对电子运动状态描述正确且能
表明同一电子层电子能量有差异的是 ( )
A.
B.
C.1s22s22p3 D.
D
书写下列基态原子的电子排布式
S
Cr
Ni
Cu
F
Mn
本章知识网络
原子结构
电子层结构
核外电子排布规律
能量最低原理
泡利原理
洪特规则
构造原理
基态与激发态
能层(电子层)
能级(电子亚层)
轨道(电子云的伸展方向)
自旋方向
原子半径 电离能 电负性
对角线规则
各周期元素数目
周期表中元素的分区
元素的金属性与非金属性
元素周期表和元素周期律
三、原子结构与元素周期表:
元素周期表
均是 元素
(n-1)d1~9ns1~2
ⅢB族~ⅦB族、Ⅷ族
d区
ⅢA族~ⅦA族、0族
p区
除氢外都是活泼的 元素
s区
元素性质特点
外围电子排布
元素分布及特点
分区
镧系、锕系元素化学性质相近
(n-2)f 0~14(n-1)d0~2ns2
镧系、锕系
f区
均是金属元素
ds区
多为非金属元素
金属
ns2np1~ns2np6
ns1~ns2
ⅠA~ⅡA
ⅠB~ⅡB
(n-1)d10ns1~
(n-1)d10ns2
元素周期律
性 质 同周期(从左向右) 同主族(从上到下)
核外电子的排布 电子层数
最外层电数
原子半径
金属性和非金属性 金属性
非金属性
最高价氧化物对应水化物酸碱性 酸性
碱性
气态氢化物稳定性
第一电离能
电负性
相同
逐渐增大
逐渐增大
相同
逐渐减小
逐渐增大
逐渐减弱
逐渐增强
逐渐减弱
逐渐增强
逐渐增强
逐渐增强
逐渐减弱
逐渐减弱
逐渐减弱
逐渐增强
电离能
第一电离能:气态电中性基态原子失去一个电子转化为气态基态
正离子所需要的最低能量
电离能反映了不同元素的原子失电子的难易,元素电离能越小,表示越容易失去电子,即元素金属性越强。
每个周期的第一个元素第一电离能最 最后一个元素的第一电离能最 。
同族元素从上至下,元素的第一电离能逐渐 。
最小
最大
减小
电负性
用来描述不同元素的原子对键合电子吸引力的大小。以氟的电负性为4.0,锂的电负性为1.0作为相对标准,得出了各元素的电负性
电负性的大小也可以作为判断金属性和非金属性强弱的尺度,金属的电负性一般小于1.8,非金属的电负性一般大于1.8,而位于非金属三角区边界的“类金属”电负性的电负性在1.8左右。它们既有金属性,又有非金属性。
元素周期律
性 质 同周期(从左向右) 同主族(从上到下)
核外电子的排布 电子层数
最外层电数
原子半径
金属性和非金属性 金属性
非金属性
最高价氧化物对应水化物酸碱性 酸性
碱性
气态氢化物稳定性
第一电离能
电负性
相同
逐渐增大
逐渐增大
相同
逐渐减小
逐渐增大
逐渐减弱
逐渐增强
逐渐减弱
逐渐增强
逐渐增强
逐渐增强
逐渐减弱
逐渐减弱
逐渐减弱
逐渐增强
逐渐增大
逐渐减小
逐渐减小
递增趋势
1、已知X、Y元素同周期,且电负性X>Y,下列说法错误的是( )
A.第一电离能:Y小于X
B.气态氢化物的稳定性:HmY强于HnX
C.最高价含氧酸的酸性:X对应酸的酸性强于Y的
D.X和Y形成化合物时,X显负价,Y显正价
AB
2、已知X、Y是主族元素,I为电离能,单位是kJ·mol-1。请根据下表所列数据判断,错误的是( )
A.元素X的常见化合价是+1
B.元素Y是ⅢA族元素
C.元素X与氯形成化合物时,化学式可能是XCl
D.若元素Y处于第三周期,它可与冷水剧烈反应
元素 I1 I2 I3 I4
X 500 4 600 6 900 9 500
Y 580 1 800 2 700 11 600
D
谢谢!
微粒半径的比较
电子层数
核电荷数
判断依据
同周期:原子半径随核电荷数的增大而减小
同主族:原子、离子半径随核电荷数的增大而增大。
电子层结构相同的微粒半径随核电荷数的增大而减小。
同一元素不同价态的微粒半径,价态越高离子半径越小
一般规律
归纳与整理
《原子结构与性质》
本章知识网络
原子结构
电子层结构
核外电子排布规律
能量最低原理
泡利原理
洪特规则
构造原理
基态与激发态
能层(电子层)
能级(电子亚层)
轨道(电子云的伸展方向)
自旋方向
元素周期表和元素周期律
一、能层、能级、原子轨道之间的关系:
能层n 1 2 3 4 …
符 号 K L M N …
能级 s s p s p d s p d f …
轨道数 1 1 3 1 3 5 1 3 5 7 …
最多容纳的电子数 2 2 6 2 6 10 2 6 10 14 …
2 8 18 32 2n2
2、下列说法中正确的是( )
A. 处于最低能量的原子叫做基态原子
B. 3p2表示3p能级有两个轨道
C. 同一原子中,1s、2s、3s电子的能量逐渐减小
D. 同一原子中,2p、3p、4p能级的轨道数依次增多
A
1、下列各电子能层中,不包含 d 能级的是 ( )
A、N能层 B、M能层 C、L能层 D、K能层
CD
二、核外电子排布规律:
构造原理
关键点:电子排入轨道的顺序。
从第四能层开始,该能层的ns与np能级之间插入了(n-1)层的d能级,第六能层开始还插入(n-2)f。
其能量关系是:ns<(n-2)f < (n-1)d <np
能量最低原理
泡利原理
洪特规则
整个原子
处于能量
最低状态
二、核外电子排布规律
用电子排布图表示出铁原子的核外电子排布
↑↓
↑↓
↑↓
↑↓
↑↓
↑↓
↑↓
↑↓
↑↓
↑↓
↑↓
↑
↑
↑
↑
洪特规则
泡利原理
能量最低原理
构造原理
(1)结构示意图:
(2)电子式:
(3)电子排布式:
(4)简化电子排布式:
(5)外围电子排布式:
(6)电子排布图:
化学用语
练习:下列氮原子结构的表述中,对电子运动状态描述正确且能
表明同一电子层电子能量有差异的是 ( )
A.
B.
C.1s22s22p3 D.
D
书写下列基态原子的电子排布式
S
Cr
Ni
Cu
F
Mn
本章知识网络
原子结构
电子层结构
核外电子排布规律
能量最低原理
泡利原理
洪特规则
构造原理
基态与激发态
能层(电子层)
能级(电子亚层)
轨道(电子云的伸展方向)
自旋方向
原子半径 电离能 电负性
对角线规则
各周期元素数目
周期表中元素的分区
元素的金属性与非金属性
元素周期表和元素周期律
三、原子结构与元素周期表:
元素周期表
均是 元素
(n-1)d1~9ns1~2
ⅢB族~ⅦB族、Ⅷ族
d区
ⅢA族~ⅦA族、0族
p区
除氢外都是活泼的 元素
s区
元素性质特点
外围电子排布
元素分布及特点
分区
镧系、锕系元素化学性质相近
(n-2)f 0~14(n-1)d0~2ns2
镧系、锕系
f区
均是金属元素
ds区
多为非金属元素
金属
ns2np1~ns2np6
ns1~ns2
ⅠA~ⅡA
ⅠB~ⅡB
(n-1)d10ns1~
(n-1)d10ns2
元素周期律
性 质 同周期(从左向右) 同主族(从上到下)
核外电子的排布 电子层数
最外层电数
原子半径
金属性和非金属性 金属性
非金属性
最高价氧化物对应水化物酸碱性 酸性
碱性
气态氢化物稳定性
第一电离能
电负性
相同
逐渐增大
逐渐增大
相同
逐渐减小
逐渐增大
逐渐减弱
逐渐增强
逐渐减弱
逐渐增强
逐渐增强
逐渐增强
逐渐减弱
逐渐减弱
逐渐减弱
逐渐增强
电离能
第一电离能:气态电中性基态原子失去一个电子转化为气态基态
正离子所需要的最低能量
电离能反映了不同元素的原子失电子的难易,元素电离能越小,表示越容易失去电子,即元素金属性越强。
每个周期的第一个元素第一电离能最 最后一个元素的第一电离能最 。
同族元素从上至下,元素的第一电离能逐渐 。
最小
最大
减小
电负性
用来描述不同元素的原子对键合电子吸引力的大小。以氟的电负性为4.0,锂的电负性为1.0作为相对标准,得出了各元素的电负性
电负性的大小也可以作为判断金属性和非金属性强弱的尺度,金属的电负性一般小于1.8,非金属的电负性一般大于1.8,而位于非金属三角区边界的“类金属”电负性的电负性在1.8左右。它们既有金属性,又有非金属性。
元素周期律
性 质 同周期(从左向右) 同主族(从上到下)
核外电子的排布 电子层数
最外层电数
原子半径
金属性和非金属性 金属性
非金属性
最高价氧化物对应水化物酸碱性 酸性
碱性
气态氢化物稳定性
第一电离能
电负性
相同
逐渐增大
逐渐增大
相同
逐渐减小
逐渐增大
逐渐减弱
逐渐增强
逐渐减弱
逐渐增强
逐渐增强
逐渐增强
逐渐减弱
逐渐减弱
逐渐减弱
逐渐增强
逐渐增大
逐渐减小
逐渐减小
递增趋势
1、已知X、Y元素同周期,且电负性X>Y,下列说法错误的是( )
A.第一电离能:Y小于X
B.气态氢化物的稳定性:HmY强于HnX
C.最高价含氧酸的酸性:X对应酸的酸性强于Y的
D.X和Y形成化合物时,X显负价,Y显正价
AB
2、已知X、Y是主族元素,I为电离能,单位是kJ·mol-1。请根据下表所列数据判断,错误的是( )
A.元素X的常见化合价是+1
B.元素Y是ⅢA族元素
C.元素X与氯形成化合物时,化学式可能是XCl
D.若元素Y处于第三周期,它可与冷水剧烈反应
元素 I1 I2 I3 I4
X 500 4 600 6 900 9 500
Y 580 1 800 2 700 11 600
D
谢谢!
微粒半径的比较
电子层数
核电荷数
判断依据
同周期:原子半径随核电荷数的增大而减小
同主族:原子、离子半径随核电荷数的增大而增大。
电子层结构相同的微粒半径随核电荷数的增大而减小。
同一元素不同价态的微粒半径,价态越高离子半径越小
一般规律
