7.2碱及其性质 课时作业(解析版)
图片预览


文档简介
7.2碱及其性质
课时作业(解析版)
1.下列变化,与空气的成分无关的是
A.敞口放置的石灰水表面出现一层白膜 B.敞口放置的浓盐酸变稀
C.酥脆的饼干置于空气中变软 D.菜刀放在潮湿的空气中生锈
2.下列物质存放在烧杯中一段时间后,质量变小且不变质的是( )
A.烧碱 B.浓硫酸 C.浓盐酸 D.生石灰
3.下列物质俗名和名称对应关系错误的是( )
A.熟石灰 氢氧化钙
B.小苏打 碳酸氢钠
C.烧碱 碳酸钠
D.干冰 二氧化碳
4.下列物质的性质与用途的对应关系错误的是( )
选项
性质
用途
A
氮气在常温下化学性质稳定
食品充氮防腐剂
B
干冰升华吸收大量热
人工降雨
C
浓硫酸具有吸水性
实验室干燥气体
D
氢氧化钙能与酸反应
中和胃酸
A.A B.B C.C D.D
5.造纸是我国古代四大发明之一。早期的纸张生产中,常常用纸表面涂敷某种物质的工艺,但存在副作用,该物质易导致纸张发生酸性腐蚀,使纸张变脆易破损,该物质是( )
A.烧碱 B.明矾 C.草木灰 D.熟石灰
6.下列物质敞口放置在空气中一段时间后,因发生化学反应使质量增加的是( )
A.浓硫酸 B.氯化钠 C.烧碱 D.浓盐酸
7.下列物质露置在空气中一段时间后,因为发生化学变化而质量增加的是( )
A.浓硫酸 B.浓盐酸 C.氢氧化钠 D.石灰石
8.下列关于石灰水的叙述正确的是( )
A.饱和石灰水是浓溶液
B.饱和石灰水是纯净物
C.澄清石灰水一定是氢氧化钙的饱和溶液
D.加热饱和石灰水有沉淀产生,溶液变浑浊
9.下列物质属于碱的是( )
A. B. C. D.
10.“苛性钠、烧碱、纯碱、火碱”四种俗称中所代表的物质只有( )
A.1种 B.2种 C.3种 D.4种
11.用下面几种常见元素,写出一种符合要求物质的化学式:
(1)写出一种金属氧化物 _____;
(2)写出一种常见的酸 _____;
(3)写出一种常见的碱 _____;
(4)写出一种常见的盐 _____。
12.根据图中资料信息回答问题:碱石灰敞口放置过程中的现象是_____,完全变质后的物质是_____,碱石灰可以干燥的气体是_____(写出一种化学式即可)。
13.长期盛放澄清石灰水的试剂瓶内壁往往附着一层白色固体。
(1)这层白色固体的主要成分是什么_____?写出有关反应的化学方程式_____。
(2)该固体可用生活中的什么物质清除?_____
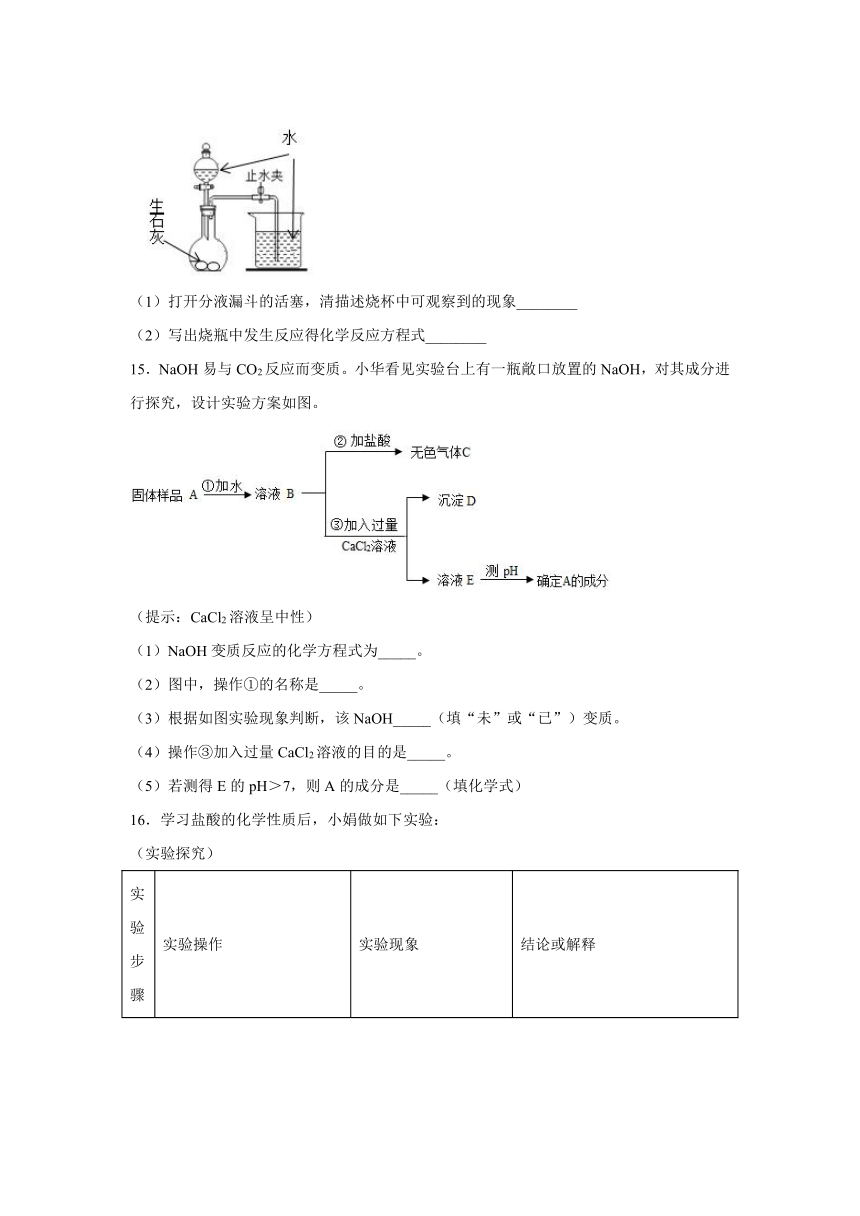
14.根据如图实验回答下列问题。
(1)打开分液漏斗的活塞,清描述烧杯中可观察到的现象________
(2)写出烧瓶中发生反应得化学反应方程式________
15.NaOH易与CO2反应而变质。小华看见实验台上有一瓶敞口放置的NaOH,对其成分进行探究,设计实验方案如图。
(提示:CaCl2溶液呈中性)
(1)NaOH变质反应的化学方程式为_____。
(2)图中,操作①的名称是_____。
(3)根据如图实验现象判断,该NaOH_____(填“未”或“已”)变质。
(4)操作③加入过量CaCl2溶液的目的是_____。
(5)若测得E的pH>7,则A的成分是_____(填化学式)
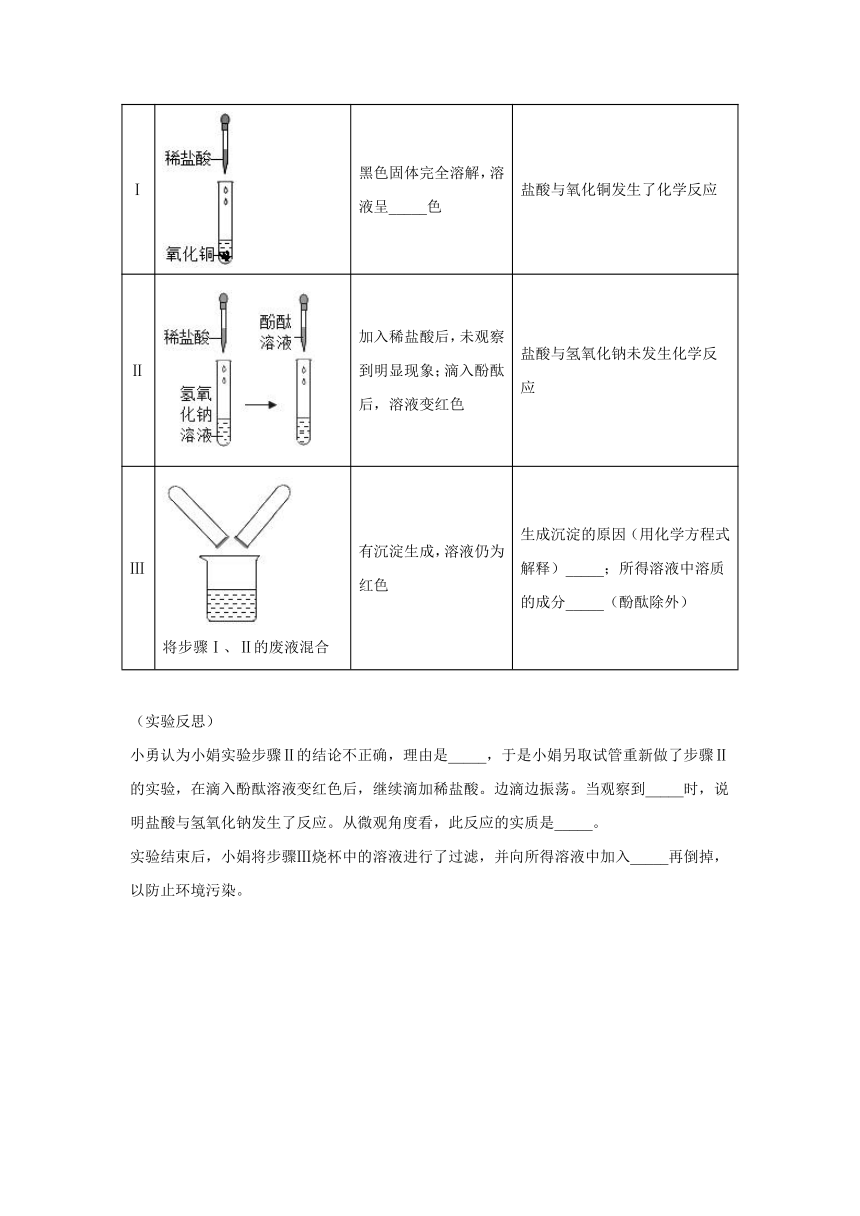
16.学习盐酸的化学性质后,小娟做如下实验:
(实验探究)
实验步骤
实验操作
实验现象
结论或解释
Ⅰ
黑色固体完全溶解,溶液呈_____色
盐酸与氧化铜发生了化学反应
Ⅱ
加入稀盐酸后,未观察到明显现象;滴入酚酞后,溶液变红色
盐酸与氢氧化钠未发生化学反应
Ⅲ
将步骤Ⅰ、Ⅱ的废液混合
有沉淀生成,溶液仍为红色
生成沉淀的原因(用化学方程式解释)_____;所得溶液中溶质的成分_____(酚酞除外)
(实验反思)
小勇认为小娟实验步骤Ⅱ的结论不正确,理由是_____,于是小娟另取试管重新做了步骤Ⅱ的实验,在滴入酚酞溶液变红色后,继续滴加稀盐酸。边滴边振荡。当观察到_____时,说明盐酸与氢氧化钠发生了反应。从微观角度看,此反应的实质是_____。
实验结束后,小娟将步骤Ⅲ烧杯中的溶液进行了过滤,并向所得溶液中加入_____再倒掉,以防止环境污染。
参考答案
1.B
【解析】
A、敞口放置的石灰水表面出现一层白膜,是空气中的二氧化碳与石灰水中的氢氧化钙反应生成碳酸钙的缘故,与空气成分有关,故A错误;
B、浓盐酸具有挥发性,敞口放置的浓盐酸变稀,是由于盐酸挥发溶质减少造成的,与空气成分无关,故B正确;
C、酥软的饼干置于空气中吸收水分变软,与空气中的水分有关,故C错误;
D、菜刀在潮湿的空气中与氧气和水反应生成铁锈,与空气成分有关,故D错误;
2.C
【解析】
A.烧碱能与二氧化碳反应生成碳酸钠而变质,质量增大,故不符合;
B.浓硫酸具有吸水性,能吸收空气中的水而使质量增大,发生的是物理变化,物质不变质,故不符合;
C.浓盐酸具有挥发性,易挥发出溶质氯化氢而导致溶液质量减少,不变质,故符合;
D.生石灰吸收空气中的水蒸气生成氢氧化钙而变质,质量增加,故不符合,
3.C
【解析】
A.氢氧化钙的俗称是熟石灰或消石灰,其物质俗名和名称对应关系正确,故不符合题意;
B.小苏打是碳酸氢钠的俗称,其物质俗名和名称对应关系正确,故不符合题意;
C.氢氧化钠俗称火碱、烧碱、苛性钠,其化学为NaOH;碳酸钠的俗称是纯碱,其物质俗名和名称对应关系错误,故符合题意;
D.干冰是固态的二氧化碳,其物质俗名和名称对应关系正确,故不符合题意。故选C。
4.D
【解析】
A、氮气化学性质稳定,常用作保护气,故不符合题意;
B、干冰升华会吸热,所以常用于人工降雨,故不符合题意;
C、浓硫酸具有吸水性,所以常用于干燥酸性和中性气体,故不符合题意;
D、氢氧化钙具有腐蚀性,不能用于中和胃酸,故符合题意。
5.B
【解析】
早期的纸张生产中,常在纸表面涂敷明矾的工艺,利用的是明矾水解出氢离子,溶液呈酸性,在酸性环境下,纤维素水解,使高分子链断裂,从而使纸张变脆易破裂;烧碱、草木灰、熟石灰的水溶液都呈碱性。
6.C
【解析】
A、浓硫酸具有吸水性,放置在空气中会吸收空气中的水分,其质量增加,但发生的是物理变化,故A错误;B、氯化钠不与空气中的成分发生化学反应,也不会吸收空气中的水蒸气,质量不变,故B错误;C、烧碱敞口放置在空气中,能与空气中的二氧化碳发生化学反应生成碳酸钠和水,发生了化学反应导致质量增加,故C正确;D、浓盐酸具有挥发性,会使其质量减少,故D错误。故选C。
7.C
【解析】
A、浓硫酸具有吸水性,质量增加,但是不发生化学变化,故错误。
B、浓盐酸具有挥发性,质量减小,故错误。
C、氢氧化钠易与二氧化碳反应生成碳酸钠而使质量增加,故正确。
D、石灰石化学性质稳定,质量不变,故错误。故选C。
8.D
【解析】
氢氧化钙的溶解度随着温度的升高而减小,加热饱和石灰水,氢氧化钙的溶解度减小,有氢氧化钙析出,溶液变浑浊。
A、氢氧化钙的溶解度很小,饱和石灰水是稀溶液,故A不正确;
B、饱和石灰水是氢氧化钙的水溶液,属于混合物,故B不正确;
C、澄清石灰水不一定是氢氧化钙的饱和溶液,也可能是不饱和溶液,故C不正确;
D、氢氧化钙的溶解度随着温度的升高而减小,加热饱和石灰水,氢氧化钙的溶解度减小,有氢氧化钙析出,溶液变浑浊,故D正确。故选D。
9.C
【解析】
A、氯化钠能电离出金属阳离子和酸根阴离子,属于盐,故A错误;
B、碳酸钠能电离出金属阳离子和酸根阴离子,属于盐,故B错误;
C、氢氧化钠是电离出的阴离子全部是氢氧根离子的化合物,属于碱,故C正确。
D、硫酸钠能电离出金属阳离子和酸根阴离子,属于盐,故D错误。故选C。
10.B
【解析】
根据常见物质的名称与俗称来分析解答。
苛性钠、火碱和烧碱都是氢氧化钠的俗称,纯碱是碳酸钠的俗称,所以“苛性钠、烧碱、纯碱、火碱”四种俗称中所代表的物质有两种。故选B。
11.Na2O H2SO4 NaOH Na2SO4
【解析】
图示原子结构示意图分别是氢、氧、钠和硫。提供的元素分别为氢元素、氧元素、钠元素和硫元素。 (1)由两种元素组成,其中一种元素是氧元素的化合物属于氧化物,由提供的元素组成的过氧化氢、水、二氧化硫、氧化钠等属于氧化物;金属氧化物是氧化钠,故填:Na2O; (2)电离时产生的阳离子全部是氢离子的化合物属于酸,由提供的元素组成的硫酸属于酸;故填:H2SO4; (3)电离时,产生的阴离子全部是氢氧根离子的化合物属于碱,由提供的元素组成的碱是氢氧化钠;故填:NaOH; (4)电离时,能产生金属阳离子与酸根阴离子的化合物属于盐,由提供的元素组成的硫酸钠属于盐;故填:Na2SO4(只要答案合理均可)。
12.放热 碳酸钙、碳酸钠 O2(或H2等合理即可)
【解析】
(1)由图可知,碱石灰是氧化钙和氢氧化钠的固体混合物,氧化钙会吸收空气中的水蒸气生成氢氧化钙并放出热量,氢氧化钙和氢氧化钠可以吸收空气中的二氧化碳生成碳酸钠,碳酸钠和氢氧化钙反应生成碳酸钙和氢氧化钠,原来是固体现象不明显,故填写:放热;
(2)氧化钙会吸收空气中的水蒸气生成氢氧化钙,氢氧化钙吸收空气中的二氧化碳生成碳酸钙和水,同时,氢氧化钠也可以吸收空气中的二氧化碳生成碳酸钠和水,因此,完全变质后的物质是碳酸钙和碳酸钠,故填写:碳酸钙、碳酸钠;
(3)碱石灰中的氧化钙可以吸收水蒸气,氢氧化钠也可以吸收水蒸气,因此,碱石灰可以用于干燥气体,但与氧化钙、氢氧化钠以及与氧化钙和水的生成物氢氧化钙反应的气体不能用碱石灰干燥,例如:二氧化碳、氯化氢等不能用碱石灰干燥,能用碱石灰干燥的气体有O2、H2等,故填写:O2(或H2等合理即可)。
13.碳酸钙 食醋
【解析】
长期盛放澄清石灰水的试剂瓶内壁往往附着一层白色固体,是由于与空气中的二氧化碳反应导致的。
(1)这层白色固体的主要成分是氢氧化钙溶液与空气中的二氧化碳反应产生的碳酸钙,方程式为:。
(2)碳酸钙固体与部分稀酸反应,生活中可用醋酸除去。
14.导管口有气泡 CaO+H2O=Ca(OH)2
【解析】
(1)打开分液漏斗,生石灰和水反应,产生大量的热,瓶内气体受热膨胀,气压增大,大于外界大气压,在压强差的作用下,沿导管排出。
故答案:导管口有气泡
(2)根据图示,烧瓶中发生反应得化学反应方程式CaO+H2O=Ca(OH)2
故答案:CaO+H2O=Ca(OH)2
15.2NaOH+CO2=Na2CO3+H2O 溶解 已 检验并且除去碳酸钠 NaOH、Na2CO3
【解析】
(1)NaOH变质反应的化学方程式为:2NaOH+CO2=Na2CO3+H2O。
(2)图中,操作①的名称是溶解。
(3)根据如图实验现象判断,加入盐酸产生气泡,是因为碳酸钠和盐酸反应生成了二氧化碳,该NaOH已变质。
(4)操作③加入过量CaCl2溶液的目的是检验并且除去碳酸钠。
(5)若测得E的pH>7,说明溶液中含有氢氧化钠,则A的成分是NaOH Na2CO3。
故填:2NaOH+CO2=Na2CO3+H2O;溶解;已;检验并且除去碳酸钠;NaOH Na2CO3。
16.蓝CuCl2+2NaOH═Cu(OH)2↓+2NaClNaCl、NaOH氢氧化钠过量溶液红色恰好褪去氢离子和氢氧根离子反应生成了水分子硼酸
【解析】
Ⅰ.向氧化铜中滴加稀盐酸,会生成氯化铜和水,发生反应的化学方程式为:CuO+2HCl═CuCl2+H2O,黑色固体完全溶解,生成蓝色的氯化铜溶液;Ⅲ.将步骤Ⅰ、Ⅱ的废液混合有沉淀生成,溶液仍为红色,说明步骤Ⅰ中生成的氯化铜与步骤Ⅱ中剩余的氢氧化钠反应,生成了蓝色的氢氧化铜沉淀,发生反应的化学方程式为:CuCl2+2NaOH═Cu(OH)2↓+2NaCl;由反应后溶液仍呈红色知且氢氧化钠溶液有剩余,因此反应后所得溶液中的溶质为NaCl、NaOH;【实验反思】盐酸遇氢氧化钠一定发生酸碱中和反应,实验步骤Ⅱ中滴加无色酚酞后变红,是因为氢氧化钠过量;为使盐酸与氢氧化钠反应的现象更明显,可在氢氧化钠溶液中先滴入无色酚酞,此时酚酞变红,然后边滴加稀盐酸边振荡,直到溶液红色恰好褪去,说明盐酸与氢氧化钠发生了反应;从微观角度看,中和反应前后金属离子和酸根离子均为发生改变,因此中和反应的实质都是氢离子和氢氧根粒子反应生成了水分子;由上述分析知,步骤Ⅲ的烧杯中含有氢氧化钠,为减小其对环境的污染,应用硼酸或者醋酸将其中和后再倒掉。
课时作业(解析版)
1.下列变化,与空气的成分无关的是
A.敞口放置的石灰水表面出现一层白膜 B.敞口放置的浓盐酸变稀
C.酥脆的饼干置于空气中变软 D.菜刀放在潮湿的空气中生锈
2.下列物质存放在烧杯中一段时间后,质量变小且不变质的是( )
A.烧碱 B.浓硫酸 C.浓盐酸 D.生石灰
3.下列物质俗名和名称对应关系错误的是( )
A.熟石灰 氢氧化钙
B.小苏打 碳酸氢钠
C.烧碱 碳酸钠
D.干冰 二氧化碳
4.下列物质的性质与用途的对应关系错误的是( )
选项
性质
用途
A
氮气在常温下化学性质稳定
食品充氮防腐剂
B
干冰升华吸收大量热
人工降雨
C
浓硫酸具有吸水性
实验室干燥气体
D
氢氧化钙能与酸反应
中和胃酸
A.A B.B C.C D.D
5.造纸是我国古代四大发明之一。早期的纸张生产中,常常用纸表面涂敷某种物质的工艺,但存在副作用,该物质易导致纸张发生酸性腐蚀,使纸张变脆易破损,该物质是( )
A.烧碱 B.明矾 C.草木灰 D.熟石灰
6.下列物质敞口放置在空气中一段时间后,因发生化学反应使质量增加的是( )
A.浓硫酸 B.氯化钠 C.烧碱 D.浓盐酸
7.下列物质露置在空气中一段时间后,因为发生化学变化而质量增加的是( )
A.浓硫酸 B.浓盐酸 C.氢氧化钠 D.石灰石
8.下列关于石灰水的叙述正确的是( )
A.饱和石灰水是浓溶液
B.饱和石灰水是纯净物
C.澄清石灰水一定是氢氧化钙的饱和溶液
D.加热饱和石灰水有沉淀产生,溶液变浑浊
9.下列物质属于碱的是( )
A. B. C. D.
10.“苛性钠、烧碱、纯碱、火碱”四种俗称中所代表的物质只有( )
A.1种 B.2种 C.3种 D.4种
11.用下面几种常见元素,写出一种符合要求物质的化学式:
(1)写出一种金属氧化物 _____;
(2)写出一种常见的酸 _____;
(3)写出一种常见的碱 _____;
(4)写出一种常见的盐 _____。
12.根据图中资料信息回答问题:碱石灰敞口放置过程中的现象是_____,完全变质后的物质是_____,碱石灰可以干燥的气体是_____(写出一种化学式即可)。
13.长期盛放澄清石灰水的试剂瓶内壁往往附着一层白色固体。
(1)这层白色固体的主要成分是什么_____?写出有关反应的化学方程式_____。
(2)该固体可用生活中的什么物质清除?_____
14.根据如图实验回答下列问题。
(1)打开分液漏斗的活塞,清描述烧杯中可观察到的现象________
(2)写出烧瓶中发生反应得化学反应方程式________
15.NaOH易与CO2反应而变质。小华看见实验台上有一瓶敞口放置的NaOH,对其成分进行探究,设计实验方案如图。
(提示:CaCl2溶液呈中性)
(1)NaOH变质反应的化学方程式为_____。
(2)图中,操作①的名称是_____。
(3)根据如图实验现象判断,该NaOH_____(填“未”或“已”)变质。
(4)操作③加入过量CaCl2溶液的目的是_____。
(5)若测得E的pH>7,则A的成分是_____(填化学式)
16.学习盐酸的化学性质后,小娟做如下实验:
(实验探究)
实验步骤
实验操作
实验现象
结论或解释
Ⅰ
黑色固体完全溶解,溶液呈_____色
盐酸与氧化铜发生了化学反应
Ⅱ
加入稀盐酸后,未观察到明显现象;滴入酚酞后,溶液变红色
盐酸与氢氧化钠未发生化学反应
Ⅲ
将步骤Ⅰ、Ⅱ的废液混合
有沉淀生成,溶液仍为红色
生成沉淀的原因(用化学方程式解释)_____;所得溶液中溶质的成分_____(酚酞除外)
(实验反思)
小勇认为小娟实验步骤Ⅱ的结论不正确,理由是_____,于是小娟另取试管重新做了步骤Ⅱ的实验,在滴入酚酞溶液变红色后,继续滴加稀盐酸。边滴边振荡。当观察到_____时,说明盐酸与氢氧化钠发生了反应。从微观角度看,此反应的实质是_____。
实验结束后,小娟将步骤Ⅲ烧杯中的溶液进行了过滤,并向所得溶液中加入_____再倒掉,以防止环境污染。
参考答案
1.B
【解析】
A、敞口放置的石灰水表面出现一层白膜,是空气中的二氧化碳与石灰水中的氢氧化钙反应生成碳酸钙的缘故,与空气成分有关,故A错误;
B、浓盐酸具有挥发性,敞口放置的浓盐酸变稀,是由于盐酸挥发溶质减少造成的,与空气成分无关,故B正确;
C、酥软的饼干置于空气中吸收水分变软,与空气中的水分有关,故C错误;
D、菜刀在潮湿的空气中与氧气和水反应生成铁锈,与空气成分有关,故D错误;
2.C
【解析】
A.烧碱能与二氧化碳反应生成碳酸钠而变质,质量增大,故不符合;
B.浓硫酸具有吸水性,能吸收空气中的水而使质量增大,发生的是物理变化,物质不变质,故不符合;
C.浓盐酸具有挥发性,易挥发出溶质氯化氢而导致溶液质量减少,不变质,故符合;
D.生石灰吸收空气中的水蒸气生成氢氧化钙而变质,质量增加,故不符合,
3.C
【解析】
A.氢氧化钙的俗称是熟石灰或消石灰,其物质俗名和名称对应关系正确,故不符合题意;
B.小苏打是碳酸氢钠的俗称,其物质俗名和名称对应关系正确,故不符合题意;
C.氢氧化钠俗称火碱、烧碱、苛性钠,其化学为NaOH;碳酸钠的俗称是纯碱,其物质俗名和名称对应关系错误,故符合题意;
D.干冰是固态的二氧化碳,其物质俗名和名称对应关系正确,故不符合题意。故选C。
4.D
【解析】
A、氮气化学性质稳定,常用作保护气,故不符合题意;
B、干冰升华会吸热,所以常用于人工降雨,故不符合题意;
C、浓硫酸具有吸水性,所以常用于干燥酸性和中性气体,故不符合题意;
D、氢氧化钙具有腐蚀性,不能用于中和胃酸,故符合题意。
5.B
【解析】
早期的纸张生产中,常在纸表面涂敷明矾的工艺,利用的是明矾水解出氢离子,溶液呈酸性,在酸性环境下,纤维素水解,使高分子链断裂,从而使纸张变脆易破裂;烧碱、草木灰、熟石灰的水溶液都呈碱性。
6.C
【解析】
A、浓硫酸具有吸水性,放置在空气中会吸收空气中的水分,其质量增加,但发生的是物理变化,故A错误;B、氯化钠不与空气中的成分发生化学反应,也不会吸收空气中的水蒸气,质量不变,故B错误;C、烧碱敞口放置在空气中,能与空气中的二氧化碳发生化学反应生成碳酸钠和水,发生了化学反应导致质量增加,故C正确;D、浓盐酸具有挥发性,会使其质量减少,故D错误。故选C。
7.C
【解析】
A、浓硫酸具有吸水性,质量增加,但是不发生化学变化,故错误。
B、浓盐酸具有挥发性,质量减小,故错误。
C、氢氧化钠易与二氧化碳反应生成碳酸钠而使质量增加,故正确。
D、石灰石化学性质稳定,质量不变,故错误。故选C。
8.D
【解析】
氢氧化钙的溶解度随着温度的升高而减小,加热饱和石灰水,氢氧化钙的溶解度减小,有氢氧化钙析出,溶液变浑浊。
A、氢氧化钙的溶解度很小,饱和石灰水是稀溶液,故A不正确;
B、饱和石灰水是氢氧化钙的水溶液,属于混合物,故B不正确;
C、澄清石灰水不一定是氢氧化钙的饱和溶液,也可能是不饱和溶液,故C不正确;
D、氢氧化钙的溶解度随着温度的升高而减小,加热饱和石灰水,氢氧化钙的溶解度减小,有氢氧化钙析出,溶液变浑浊,故D正确。故选D。
9.C
【解析】
A、氯化钠能电离出金属阳离子和酸根阴离子,属于盐,故A错误;
B、碳酸钠能电离出金属阳离子和酸根阴离子,属于盐,故B错误;
C、氢氧化钠是电离出的阴离子全部是氢氧根离子的化合物,属于碱,故C正确。
D、硫酸钠能电离出金属阳离子和酸根阴离子,属于盐,故D错误。故选C。
10.B
【解析】
根据常见物质的名称与俗称来分析解答。
苛性钠、火碱和烧碱都是氢氧化钠的俗称,纯碱是碳酸钠的俗称,所以“苛性钠、烧碱、纯碱、火碱”四种俗称中所代表的物质有两种。故选B。
11.Na2O H2SO4 NaOH Na2SO4
【解析】
图示原子结构示意图分别是氢、氧、钠和硫。提供的元素分别为氢元素、氧元素、钠元素和硫元素。 (1)由两种元素组成,其中一种元素是氧元素的化合物属于氧化物,由提供的元素组成的过氧化氢、水、二氧化硫、氧化钠等属于氧化物;金属氧化物是氧化钠,故填:Na2O; (2)电离时产生的阳离子全部是氢离子的化合物属于酸,由提供的元素组成的硫酸属于酸;故填:H2SO4; (3)电离时,产生的阴离子全部是氢氧根离子的化合物属于碱,由提供的元素组成的碱是氢氧化钠;故填:NaOH; (4)电离时,能产生金属阳离子与酸根阴离子的化合物属于盐,由提供的元素组成的硫酸钠属于盐;故填:Na2SO4(只要答案合理均可)。
12.放热 碳酸钙、碳酸钠 O2(或H2等合理即可)
【解析】
(1)由图可知,碱石灰是氧化钙和氢氧化钠的固体混合物,氧化钙会吸收空气中的水蒸气生成氢氧化钙并放出热量,氢氧化钙和氢氧化钠可以吸收空气中的二氧化碳生成碳酸钠,碳酸钠和氢氧化钙反应生成碳酸钙和氢氧化钠,原来是固体现象不明显,故填写:放热;
(2)氧化钙会吸收空气中的水蒸气生成氢氧化钙,氢氧化钙吸收空气中的二氧化碳生成碳酸钙和水,同时,氢氧化钠也可以吸收空气中的二氧化碳生成碳酸钠和水,因此,完全变质后的物质是碳酸钙和碳酸钠,故填写:碳酸钙、碳酸钠;
(3)碱石灰中的氧化钙可以吸收水蒸气,氢氧化钠也可以吸收水蒸气,因此,碱石灰可以用于干燥气体,但与氧化钙、氢氧化钠以及与氧化钙和水的生成物氢氧化钙反应的气体不能用碱石灰干燥,例如:二氧化碳、氯化氢等不能用碱石灰干燥,能用碱石灰干燥的气体有O2、H2等,故填写:O2(或H2等合理即可)。
13.碳酸钙 食醋
【解析】
长期盛放澄清石灰水的试剂瓶内壁往往附着一层白色固体,是由于与空气中的二氧化碳反应导致的。
(1)这层白色固体的主要成分是氢氧化钙溶液与空气中的二氧化碳反应产生的碳酸钙,方程式为:。
(2)碳酸钙固体与部分稀酸反应,生活中可用醋酸除去。
14.导管口有气泡 CaO+H2O=Ca(OH)2
【解析】
(1)打开分液漏斗,生石灰和水反应,产生大量的热,瓶内气体受热膨胀,气压增大,大于外界大气压,在压强差的作用下,沿导管排出。
故答案:导管口有气泡
(2)根据图示,烧瓶中发生反应得化学反应方程式CaO+H2O=Ca(OH)2
故答案:CaO+H2O=Ca(OH)2
15.2NaOH+CO2=Na2CO3+H2O 溶解 已 检验并且除去碳酸钠 NaOH、Na2CO3
【解析】
(1)NaOH变质反应的化学方程式为:2NaOH+CO2=Na2CO3+H2O。
(2)图中,操作①的名称是溶解。
(3)根据如图实验现象判断,加入盐酸产生气泡,是因为碳酸钠和盐酸反应生成了二氧化碳,该NaOH已变质。
(4)操作③加入过量CaCl2溶液的目的是检验并且除去碳酸钠。
(5)若测得E的pH>7,说明溶液中含有氢氧化钠,则A的成分是NaOH Na2CO3。
故填:2NaOH+CO2=Na2CO3+H2O;溶解;已;检验并且除去碳酸钠;NaOH Na2CO3。
16.蓝CuCl2+2NaOH═Cu(OH)2↓+2NaClNaCl、NaOH氢氧化钠过量溶液红色恰好褪去氢离子和氢氧根离子反应生成了水分子硼酸
【解析】
Ⅰ.向氧化铜中滴加稀盐酸,会生成氯化铜和水,发生反应的化学方程式为:CuO+2HCl═CuCl2+H2O,黑色固体完全溶解,生成蓝色的氯化铜溶液;Ⅲ.将步骤Ⅰ、Ⅱ的废液混合有沉淀生成,溶液仍为红色,说明步骤Ⅰ中生成的氯化铜与步骤Ⅱ中剩余的氢氧化钠反应,生成了蓝色的氢氧化铜沉淀,发生反应的化学方程式为:CuCl2+2NaOH═Cu(OH)2↓+2NaCl;由反应后溶液仍呈红色知且氢氧化钠溶液有剩余,因此反应后所得溶液中的溶质为NaCl、NaOH;【实验反思】盐酸遇氢氧化钠一定发生酸碱中和反应,实验步骤Ⅱ中滴加无色酚酞后变红,是因为氢氧化钠过量;为使盐酸与氢氧化钠反应的现象更明显,可在氢氧化钠溶液中先滴入无色酚酞,此时酚酞变红,然后边滴加稀盐酸边振荡,直到溶液红色恰好褪去,说明盐酸与氢氧化钠发生了反应;从微观角度看,中和反应前后金属离子和酸根离子均为发生改变,因此中和反应的实质都是氢离子和氢氧根粒子反应生成了水分子;由上述分析知,步骤Ⅲ的烧杯中含有氢氧化钠,为减小其对环境的污染,应用硼酸或者醋酸将其中和后再倒掉。
同课章节目录
- 第七单元 常见的酸和碱
- 第一节 酸及其性质
- 第二节 碱及其性质
- 第三节 溶液的酸碱性
- 第四节 酸碱中和反应
- 到实验室去:探究酸和碱的化学性质
- 第八单元 海水中的化学
- 第一节 海洋化学资源
- 第二节 海水“晒盐“
- 第三节 海水“制碱“
- 到实验室去:粗盐中难溶性杂质的去除
- 第九单元 金属
- 第一节 常见的金属材料
- 第二节 金属的化学性质
- 第三节 钢铁的锈蚀与防护
- 到实验室去 探究金属的性质
- 第十单元 化学与健康
- 第一节 食物中的有机物
- 第二节 化学元素与人体健康
- 第三节 远离有毒物质
- 第十一单元 化学与社会发展
- 第一节 化学与能源开发
- 第二节 化学与材料研制
- 第三节 化学与农业生产
- 第四节 化学与环境保护
