第四节 酸碱中和反应 课件(22张PPT)
文档属性
| 名称 | 第四节 酸碱中和反应 课件(22张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 965.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版(五四学制) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-03-09 09:19:44 | ||
图片预览






文档简介
(共22张PPT)
酸碱中和反应
实验探究
盐酸(HCl)和氢氧化钠(NaOH)溶液能否发生化学反应?
猜想与假设
可能反应?
HCl + NaOH =
可能不反应?
设计实验
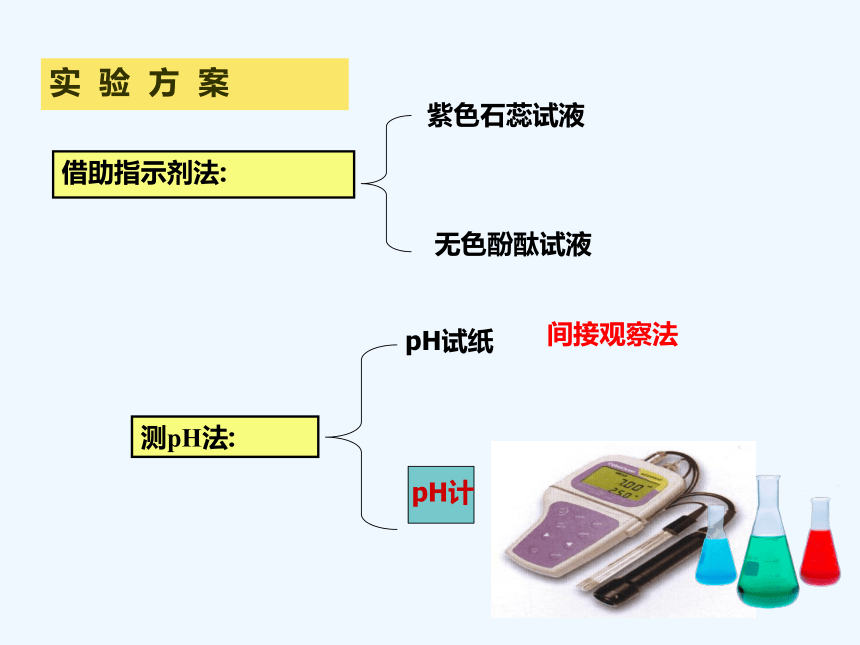
一、中和反应
测pH法:
借助指示剂法:
pH试纸
紫色石蕊试液
无色酚酞试液
实 验 方 案
间接观察法
HCl+NaOH
能反应
向氢氧化钠溶液中先滴加酚酞试液,再滴加稀盐酸
溶液先变为红色,滴加盐酸后红色消失,溶液变为无色
实验操作 实验现象 结论
方案一
方案…
实验探究
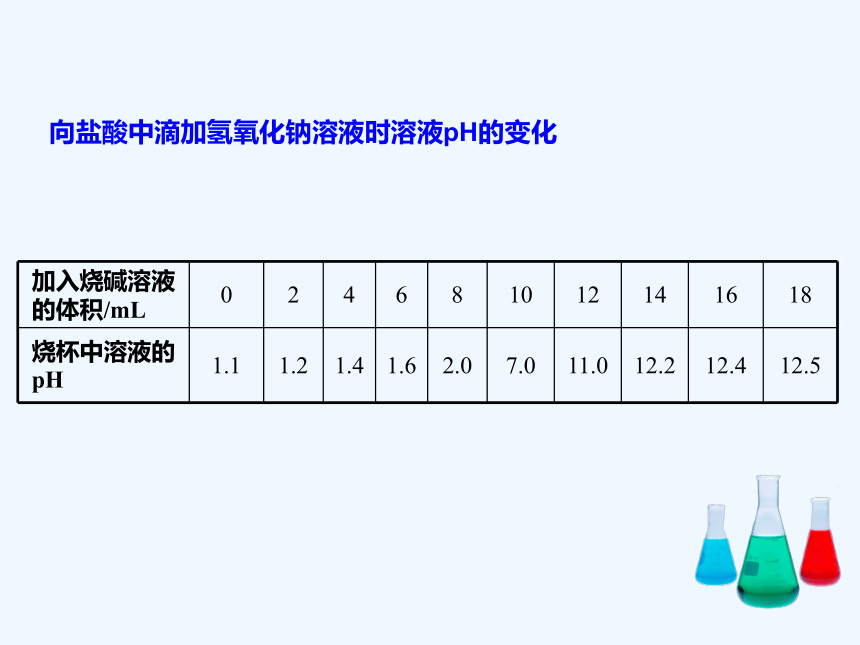
盐酸和氢氧化钠反应中溶液酸碱性的变化
向盛有稀盐酸的烧杯中逐滴滴加氢氧化钠溶液,用pH计测定溶液的pH
向盐酸中滴加氢氧化钠溶液时溶液pH的变化
加入烧碱溶液的体积/mL 0 2 4 6 8 10 12 14 16 18
烧杯中溶液的pH 1.1 1.2 1.4 1.6 2.0 7.0 11.0 12.2 12.4 12.5
活动天地:图像
.
.
.
.
.
.
.
.
.
.
。
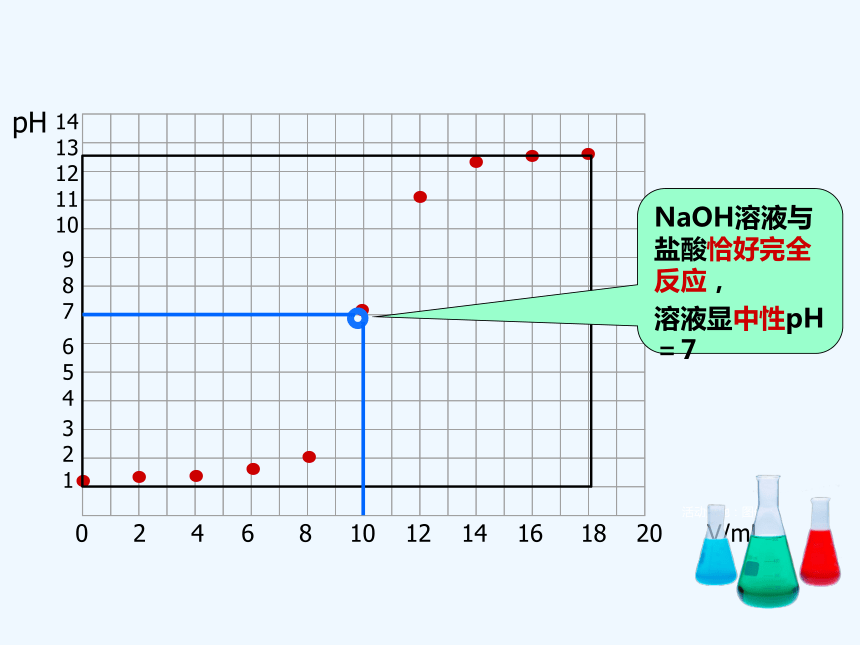
NaOH溶液与盐酸恰好完全反应,
溶液显中性pH=7
实验结果表明
当滴入氢氧化钠溶液不足时pH<7,HCl有剩余,溶液显___性。
当滴入氢氧化钠溶液与HCl恰好完全反应时pH=7,溶液显___性。
当滴入氢氧化钠溶液过量时pH>7,氢氧化钠有剩余,溶液显___性。
碱
酸
中
你认为盐酸和氢氧化钠恰好反应溶液蒸发后留在玻璃片上的可能是什么物质?
2、你能试着写出上述反应的化学方程式吗?
3、在活动中你发现的问题和想法。
NaOH+HCl=NaCl+H2O
实验探究
向一只盛有氢氧化钙溶液的试管中滴加2-3滴酚酞试液,振荡观察现象;再向其中加入少量稀盐酸,振荡并观察现象。
Ca(OH)2+2HCl=CaCl2+2H2O
实验现象:
先变红,然后红色消失
HCl + Ca(OH)2
盐
酸 和 碱 作用生成 盐 和 水
的反应叫做中和反应
HCl + NaOH
Na Cl + H2O
Ca Cl 2 + 2 H2O
2
H2SO4+ 2KOH
K 2 SO4 + 2 H2O
酸: HCl、H2SO4、 HNO3 … …
碱: NaOH、 Ca(OH)2 、KOH… …
盐: NaCl 、 CaCl2 、K2SO4
NH4NO3 … …
NaOH+HCI=NaCI+H2O
Ca(OH)2+2HCl=CaCl2+2H2O
碱+酸→盐+水
中和反应:酸跟碱作用生成盐和水的反应。
中和反应实质
NaOH+HCI=NaCI+H2O
中和反应的实质:H+ + OH- =H2O
写出下列反应的化学方程式
达标练习
1、硫酸(H2SO4)与氢氧化钠(NaOH)反应
2、硝酸(HNO3)与氢氧化钙(Ca(OH)2)的反应
1.在滴有石蕊的稀盐酸中,加入足量NaOH溶液,加酸前后溶液颜色依次为 ( )
A.红色、紫色 、蓝色 B.紫色、红色、蓝色
C.红色、蓝色、紫色 D.蓝色、紫色、红色
A
达标检测
2.食用松花蛋时常感到有涩味,是因为制作过程中用到了熟石灰和纯碱等原料。为了减轻涩味,可在食用时添加调味品,这种调味品最好( )。
A、食盐 B、酱油
C、香油 D、食醋
D
3、若想使某种pH=0的溶液成为pH=8的溶液,应加入下列何种物质才能实现 ( )
A.水
B.氢氧化钠溶液
C.稀硫酸
D.pH=0的溶液
B
4.下列反应,属于中和反应的是 ( )
A. Ca(OH)2+ CO2=CaCO3↓+H2O
B. CuO + 2HCl = CuCl2 + H2O
C. Cu(OH)2 + H2SO4 = CuSO4 + 2H2O
D. AgNO3 + HCl =AgCl↓+ HNO3
C
5、某种消化药片的有效成分氢氧化镁,能减缓因胃酸过多引起的疼痛。在氢氧化镁与胃酸作用的过程中,胃液pH变化的情况是( )
B
6. 向NaOH溶液中不断滴加稀盐酸,溶液pH随加入盐酸体积变化与下图相符的是 ( )
A
7、下图是氢氧化钠和盐酸反应的溶液酸碱性的走势图
(2)当加入溶液为ag 时,所得溶液中溶质是 。
(1)该实验操作是将 滴加到另一种溶液中。
(3)如果选择的指示剂是酚酞,当滴加溶液为bg时,溶液颜色变化是
氢氧化钠
HCl、NaCl
无色变为红色
8、写出下列反应的化学方程式
1、胃酸(HCl)过多,口服碱性药物(例:Al(OH)3)
2、向酸性土壤(H2SO4)中撒熟石灰(Ca(OH)2)
3、向酸性废水(HCl)中加熟石灰(Ca(OH)2)
酸碱中和反应
实验探究
盐酸(HCl)和氢氧化钠(NaOH)溶液能否发生化学反应?
猜想与假设
可能反应?
HCl + NaOH =
可能不反应?
设计实验
一、中和反应
测pH法:
借助指示剂法:
pH试纸
紫色石蕊试液
无色酚酞试液
实 验 方 案
间接观察法
HCl+NaOH
能反应
向氢氧化钠溶液中先滴加酚酞试液,再滴加稀盐酸
溶液先变为红色,滴加盐酸后红色消失,溶液变为无色
实验操作 实验现象 结论
方案一
方案…
实验探究
盐酸和氢氧化钠反应中溶液酸碱性的变化
向盛有稀盐酸的烧杯中逐滴滴加氢氧化钠溶液,用pH计测定溶液的pH
向盐酸中滴加氢氧化钠溶液时溶液pH的变化
加入烧碱溶液的体积/mL 0 2 4 6 8 10 12 14 16 18
烧杯中溶液的pH 1.1 1.2 1.4 1.6 2.0 7.0 11.0 12.2 12.4 12.5
活动天地:图像
.
.
.
.
.
.
.
.
.
.
。
NaOH溶液与盐酸恰好完全反应,
溶液显中性pH=7
实验结果表明
当滴入氢氧化钠溶液不足时pH<7,HCl有剩余,溶液显___性。
当滴入氢氧化钠溶液与HCl恰好完全反应时pH=7,溶液显___性。
当滴入氢氧化钠溶液过量时pH>7,氢氧化钠有剩余,溶液显___性。
碱
酸
中
你认为盐酸和氢氧化钠恰好反应溶液蒸发后留在玻璃片上的可能是什么物质?
2、你能试着写出上述反应的化学方程式吗?
3、在活动中你发现的问题和想法。
NaOH+HCl=NaCl+H2O
实验探究
向一只盛有氢氧化钙溶液的试管中滴加2-3滴酚酞试液,振荡观察现象;再向其中加入少量稀盐酸,振荡并观察现象。
Ca(OH)2+2HCl=CaCl2+2H2O
实验现象:
先变红,然后红色消失
HCl + Ca(OH)2
盐
酸 和 碱 作用生成 盐 和 水
的反应叫做中和反应
HCl + NaOH
Na Cl + H2O
Ca Cl 2 + 2 H2O
2
H2SO4+ 2KOH
K 2 SO4 + 2 H2O
酸: HCl、H2SO4、 HNO3 … …
碱: NaOH、 Ca(OH)2 、KOH… …
盐: NaCl 、 CaCl2 、K2SO4
NH4NO3 … …
NaOH+HCI=NaCI+H2O
Ca(OH)2+2HCl=CaCl2+2H2O
碱+酸→盐+水
中和反应:酸跟碱作用生成盐和水的反应。
中和反应实质
NaOH+HCI=NaCI+H2O
中和反应的实质:H+ + OH- =H2O
写出下列反应的化学方程式
达标练习
1、硫酸(H2SO4)与氢氧化钠(NaOH)反应
2、硝酸(HNO3)与氢氧化钙(Ca(OH)2)的反应
1.在滴有石蕊的稀盐酸中,加入足量NaOH溶液,加酸前后溶液颜色依次为 ( )
A.红色、紫色 、蓝色 B.紫色、红色、蓝色
C.红色、蓝色、紫色 D.蓝色、紫色、红色
A
达标检测
2.食用松花蛋时常感到有涩味,是因为制作过程中用到了熟石灰和纯碱等原料。为了减轻涩味,可在食用时添加调味品,这种调味品最好( )。
A、食盐 B、酱油
C、香油 D、食醋
D
3、若想使某种pH=0的溶液成为pH=8的溶液,应加入下列何种物质才能实现 ( )
A.水
B.氢氧化钠溶液
C.稀硫酸
D.pH=0的溶液
B
4.下列反应,属于中和反应的是 ( )
A. Ca(OH)2+ CO2=CaCO3↓+H2O
B. CuO + 2HCl = CuCl2 + H2O
C. Cu(OH)2 + H2SO4 = CuSO4 + 2H2O
D. AgNO3 + HCl =AgCl↓+ HNO3
C
5、某种消化药片的有效成分氢氧化镁,能减缓因胃酸过多引起的疼痛。在氢氧化镁与胃酸作用的过程中,胃液pH变化的情况是( )
B
6. 向NaOH溶液中不断滴加稀盐酸,溶液pH随加入盐酸体积变化与下图相符的是 ( )
A
7、下图是氢氧化钠和盐酸反应的溶液酸碱性的走势图
(2)当加入溶液为ag 时,所得溶液中溶质是 。
(1)该实验操作是将 滴加到另一种溶液中。
(3)如果选择的指示剂是酚酞,当滴加溶液为bg时,溶液颜色变化是
氢氧化钠
HCl、NaCl
无色变为红色
8、写出下列反应的化学方程式
1、胃酸(HCl)过多,口服碱性药物(例:Al(OH)3)
2、向酸性土壤(H2SO4)中撒熟石灰(Ca(OH)2)
3、向酸性废水(HCl)中加熟石灰(Ca(OH)2)
同课章节目录
- 第一单元 溶液
- 1 溶液的形成
- 2 溶液组成的定量表示
- 3物质的溶解性
- 到实验室去:配制一定溶质质量分数的溶液
- 第二单元 常见的酸和碱
- 1 酸及其性质
- 2 碱及其性质
- 3 溶液的酸碱性
- 4 酸碱中和反应
- 到实验室去:探究酸和碱的化学性质
- 到图书馆去:分子变成离子
- 第三单元 海水中的化学
- 1 海洋化学资源
- 2 海水“晒盐”
- 3 海水“制碱”
- 到实验室去:粗盐中难溶性杂质的去除
- 第四单元 金属
- 1 常见的金属材料
- 2 金属的化学性质
- 3 钢铁的锈蚀与防护
- 到实验室去:探究金属的性质
- 第五单元 化学与健康
- 1 食物中的有机物
- 2 化学元素与人体健康
- 3 远离有毒物质
- 第六单元 化学与社会发展
- 1 化学与能源开发
- 2 化学与材料研制
- 3 化学与农业生产
- 4 化学与环境保护
