课题1 生活中常见的盐---碳酸盐(共21张PPT)
文档属性
| 名称 | 课题1 生活中常见的盐---碳酸盐(共21张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 5.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-03-10 08:49:48 | ||
图片预览






文档简介
(共21张PPT)
一、碳酸钠、碳酸氢钠和碳酸钙
1、俗称与用途
【练一练】阅读课本73页完成学评P66表格
Na2CO3
纯碱、苏打
玻璃、造纸、纺织和洗涤剂
NaHCO3
小苏打
发酵粉、胃药治疗胃酸过多
CaCO3
建筑材料、补钙剂
大理石、石灰石的主要成分
名称 化学式 俗名 主要用途
碳酸钠
碳酸氢钠
碳酸钙
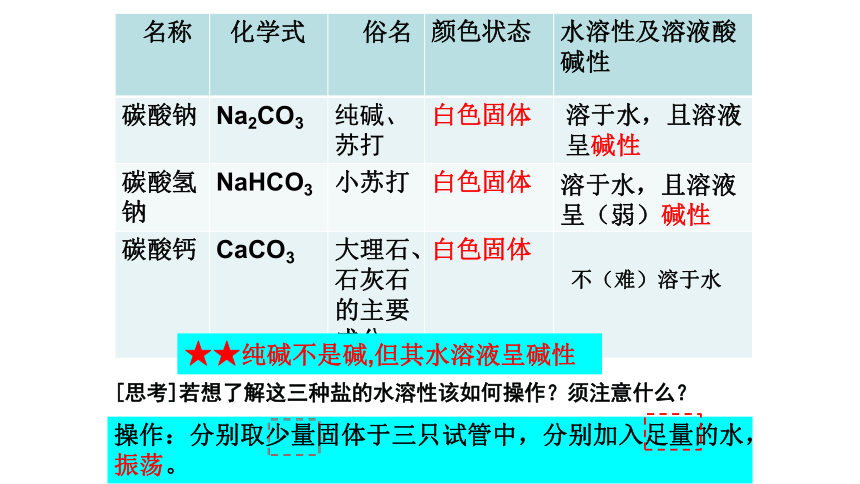
[思考]若想了解这三种盐的水溶性该如何操作?须注意什么?
操作:分别取少量固体于三只试管中,分别加入足量的水,振荡。
溶于水,且溶液呈碱性
溶于水,且溶液
呈(弱)碱性
不(难)溶于水
★★纯碱不是碱,但其水溶液呈碱性
名称 化学式 俗名 颜色状态 水溶性及溶液酸碱性
碳酸钠 Na2CO3 纯碱、苏打 白色固体
碳酸氢钠 NaHCO3 小苏打 白色固体
碳酸钙 CaCO3 大理石、石灰石的主要成分 白色固体
这个制碱新方法被命名为“联合制碱法”,它使盐的利用率从原来的70%一下子提高到96%。此外,污染坏境的废物氯化钙成为对农作物有用的化肥——氯化铵,还可以减少1/3设备,所以它的优越性在大超过了苏尔维制碱法,从而开创了世界制碱工业的新纪元。侯德榜为纯碱和氮肥工业技术的发展做出了杰出的贡献。
在化学工业中,纯碱是一种重要的化工原料,它的化学名称又叫“碳酸钠”,是一种白色的粉末。侯德榜刻苦钻研,在1926年6月生产出洁白的纯碱,打破了西方国家的垄断。
侯德榜
原理:
NH3+CO2+H2O = NH4HCO3 NH4HCO3+NaCl = NaHCO3↓+NH4Cl 2NaHCO3 = Na2CO3+H2O+CO2↑
总反应:
NH3+CO2+H2O +NaCl = NaHCO3↓+NH4Cl
2NaHCO3 = Na2CO3+H2O+CO2↑
将二氧化碳通入氨水的氯化钠饱和溶液中,使溶解度较小的碳酸氢钠析出。
△
△
【回顾] 请说出实验室制取CO2的化学反应原理。
P74【讨论】
CaCO3 + 2HCl = CaCl2 + H2O + CO2↑
2、 CaCO3 、 Na2CO3 、 NaHCO3的化学性质
比较碳酸钙与碳酸钠和碳酸氢钠的组成,推断碳酸钠和碳酸氢钠是否也能发生上述类似的反应。
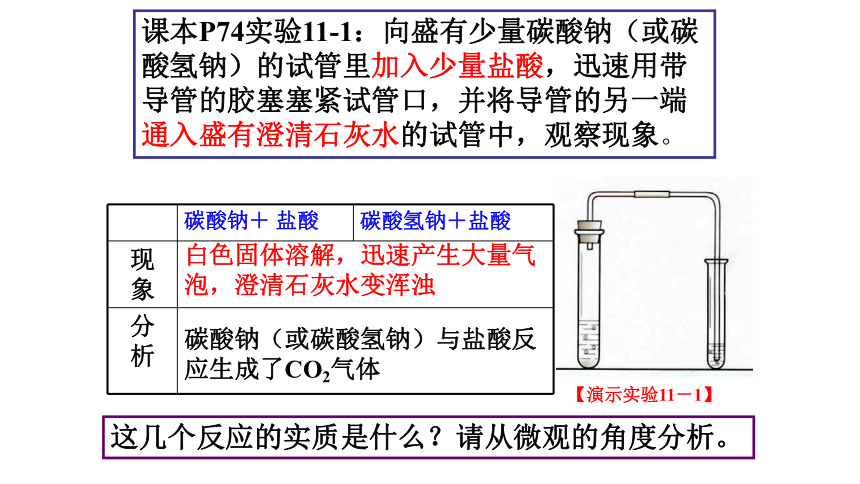
白色固体溶解,迅速产生大量气泡,澄清石灰水变浑浊
碳酸钠(或碳酸氢钠)与盐酸反应生成了CO2气体
课本P74实验11-1:向盛有少量碳酸钠(或碳酸氢钠)的试管里加入少量盐酸,迅速用带导管的胶塞塞紧试管口,并将导管的另一端通入盛有澄清石灰水的试管中,观察现象。
这几个反应的实质是什么?请从微观的角度分析。
碳酸钠+ 盐酸 碳酸氢钠+盐酸
现 象
分 析
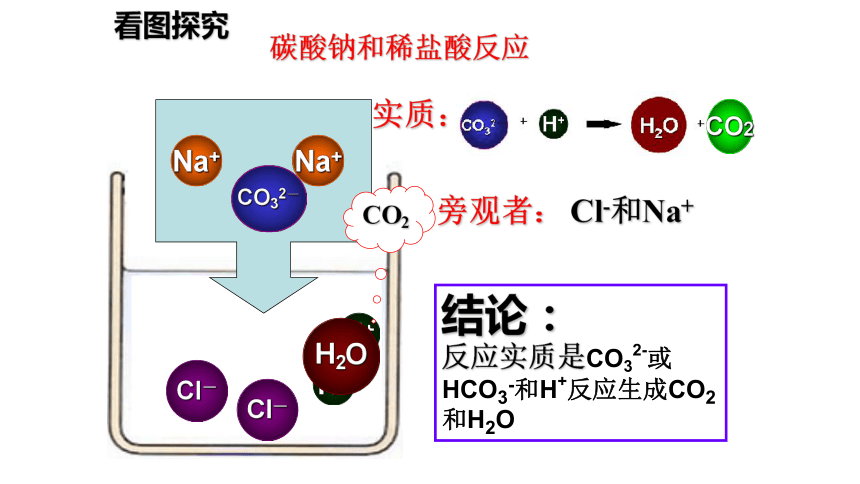
看图探究
Na+
Na+
CO32-
Cl-
H+
Cl-
H+
H2O
碳酸钠和稀盐酸反应
结论:
反应实质是CO32-或HCO3-和H+反应生成CO2和H2O
CO2
实质:
旁观者:
Cl-和Na+
H2CO3
生成新盐和水和二氧化碳(新酸)
【思考】1、含有CO32- 或HCO3 –的盐都能与哪类 物质反应,产生的气体是什么?
2、如何检验CO32- 或HCO3 –?
取少量待测样品于试管中,加入少量稀盐酸,若产生能使澄清石灰水变浑浊的气体,则说明样品中含有CO32- 或HCO3 –
能与酸反应,
Na2CO3 + 2HCl = 2NaCl + H2O+CO2↑
NaHCO3 + HCl = NaCl + H2O + CO2↑
取样品
药品:稀盐酸、石灰水
现象:产生气泡、澄清石灰水变浑浊
溶液产生白色沉淀
含有CO32-的碳酸盐溶液与石灰水能反应产生白色沉淀
Na2CO3+Ca(OH)2=CaCO3↓+2NaOH
实验11-2:向盛有少量Na2CO3溶液的试管
滴入澄清的石灰水,观察现象。
该反应的实质是什么?
由实验11-1和11-2可知,碳酸盐有什么共同的化学性质?
现象
化学方程式
分析
(1)能与酸反应,生成新盐和水和二氧化碳(新酸)
Na2CO3 + 2 HCl === 2NaCl + CO2↑+H2O
NaHCO3 + HCl === NaCl + CO2↑+H2O
(2)能与某些碱反应,生成新碳酸盐↓和新碱
Na2CO3 + Ca(OH)2 === CaCO3 ↓+ 2 NaOH
碳酸盐化学性质
CaCO3 + 2HCl == CaCl2 + H2O + CO2↑
[举一反三]2、写出下列反应的化学方程式。P67学评
氢氧化钾与硫酸反应:
碳酸氢钾与硫酸反应:
碳酸钾与盐酸反应:
碳酸钾与澄清石灰水反应:
K2CO3 + 2 HCl = 2KCl + CO2↑+H2O
K2CO3 + Ca(OH)2 = 2KOH + CaCO3↓
1、为什么碳酸氢钠可以治疗胃酸过多?
2、自制汽水中的气泡是如何产生的?P45
[学以致用]
NaHCO3 + HCl = NaCl+H2O+CO2↑
3、馒头、面包等发面食品的一个特点是面团中有许多小孔,它们使发面食品松软可口。根据发酵粉(含碳酸氢钠和有机酸等)可与面粉、水混合直接制作发面食品的事实,说明碳酸氢钠在其中的作用。
[学以致用]
和面时,发酵粉中的NaHCO3能和有机酸遇水起反应,产生CO2气体,气体在面团中形成许多小气室,使馒头、面包等疏松多孔。
酸的化学性质
1、与指示剂作用(酸能使紫色石蕊溶液变红色)
2、酸与活泼金属反应,生成氢气和盐
3、酸与金属氧化物反应,生成盐和水
5、酸与碳酸盐反应,生成新盐和水和二氧化碳(新酸)
4、酸与碱发生中和反应,生成盐和水
1、与指示剂作用(碱溶液能使紫色石蕊溶液变蓝色,能使无色酚酞溶液变红色)
碱的化学性质
2、碱与非金属氧化物反应,生成盐和水
3、碱与酸发生中和反应,生成盐和水
4、碱与某些盐发生反应,生成新碱和新盐
本课小结
1、了解几种常见的碳酸盐的俗称及用途;
2、知道碳酸盐的两点化学性质:(1)能与酸反应生成水和二氧化碳,
(2)能与某些碱(氢氧化钙、氢氧化钡等)反应,生成碳酸盐沉淀;
3、会检验和鉴别碳酸盐。(用稀盐酸和澄清石灰水)
厨房里有两瓶白色固体,一瓶是食盐,一瓶是纯碱。想想看,我们能用哪些方法鉴别它们呢?
1、下列各组物质名称不代表同一物质的一组是( )
A.氯化钠、盐
B.氢氧化钠、苛性钠
C.碳酸钠、纯碱
D.碳酸氢钠、小苏打
2、下列关于物质用途的说法中,错误的是( )
A.碳酸钙用作补钙剂
B.碳酸氢钠用于焙制糕点
C.纯碱溶液用于除水垢
D.食盐用作调味品
A
C
3、将珍珠放入稀盐酸中,有气泡产生,生成的气体能使澄清的石灰水变浑浊,则珍珠中含有下列离子中的( )。
C
A、氯离子 B、硫酸根离子
C、碳酸根离子 D、氢氧根离子
(1)可用作洗涤剂的是(填序号,下同)____;
(2)可用作调味剂的_____________________;
(3)可用作补钙剂和牙膏填充剂的是________;
(4)可用于生产玻璃的是_________________;
(5)可用作发酵粉和治疗胃酸过多症的是____;
b
c
b
d
a
4、在下列物质:
a食盐;b纯碱;c碳酸氢钠;d碳酸钙
探究:如何鉴别氯化钠溶液和碳酸钠溶液?
Na2CO3+2HCl==
2NaCl+H2O+CO2↑
Na2CO3+Ca(OH)2==
CaCO3↓+2NaOH
酚酞试液
显红色的为碳酸钠溶液
无色的为氯化钠溶液
pH试纸
pH>7 ,碳酸钠溶液
pH=7,氯化钠溶液
稀盐酸
有大量气泡产生的是碳酸钠溶液,无明显现象的为氯化钠溶液
氢氧化
钙溶液
有白色沉淀产生的是碳酸钠溶液,无明显现象的为氯化钠溶液
方法 实验现象、结论 原理
(用化学方程式表示)
一、碳酸钠、碳酸氢钠和碳酸钙
1、俗称与用途
【练一练】阅读课本73页完成学评P66表格
Na2CO3
纯碱、苏打
玻璃、造纸、纺织和洗涤剂
NaHCO3
小苏打
发酵粉、胃药治疗胃酸过多
CaCO3
建筑材料、补钙剂
大理石、石灰石的主要成分
名称 化学式 俗名 主要用途
碳酸钠
碳酸氢钠
碳酸钙
[思考]若想了解这三种盐的水溶性该如何操作?须注意什么?
操作:分别取少量固体于三只试管中,分别加入足量的水,振荡。
溶于水,且溶液呈碱性
溶于水,且溶液
呈(弱)碱性
不(难)溶于水
★★纯碱不是碱,但其水溶液呈碱性
名称 化学式 俗名 颜色状态 水溶性及溶液酸碱性
碳酸钠 Na2CO3 纯碱、苏打 白色固体
碳酸氢钠 NaHCO3 小苏打 白色固体
碳酸钙 CaCO3 大理石、石灰石的主要成分 白色固体
这个制碱新方法被命名为“联合制碱法”,它使盐的利用率从原来的70%一下子提高到96%。此外,污染坏境的废物氯化钙成为对农作物有用的化肥——氯化铵,还可以减少1/3设备,所以它的优越性在大超过了苏尔维制碱法,从而开创了世界制碱工业的新纪元。侯德榜为纯碱和氮肥工业技术的发展做出了杰出的贡献。
在化学工业中,纯碱是一种重要的化工原料,它的化学名称又叫“碳酸钠”,是一种白色的粉末。侯德榜刻苦钻研,在1926年6月生产出洁白的纯碱,打破了西方国家的垄断。
侯德榜
原理:
NH3+CO2+H2O = NH4HCO3 NH4HCO3+NaCl = NaHCO3↓+NH4Cl 2NaHCO3 = Na2CO3+H2O+CO2↑
总反应:
NH3+CO2+H2O +NaCl = NaHCO3↓+NH4Cl
2NaHCO3 = Na2CO3+H2O+CO2↑
将二氧化碳通入氨水的氯化钠饱和溶液中,使溶解度较小的碳酸氢钠析出。
△
△
【回顾] 请说出实验室制取CO2的化学反应原理。
P74【讨论】
CaCO3 + 2HCl = CaCl2 + H2O + CO2↑
2、 CaCO3 、 Na2CO3 、 NaHCO3的化学性质
比较碳酸钙与碳酸钠和碳酸氢钠的组成,推断碳酸钠和碳酸氢钠是否也能发生上述类似的反应。
白色固体溶解,迅速产生大量气泡,澄清石灰水变浑浊
碳酸钠(或碳酸氢钠)与盐酸反应生成了CO2气体
课本P74实验11-1:向盛有少量碳酸钠(或碳酸氢钠)的试管里加入少量盐酸,迅速用带导管的胶塞塞紧试管口,并将导管的另一端通入盛有澄清石灰水的试管中,观察现象。
这几个反应的实质是什么?请从微观的角度分析。
碳酸钠+ 盐酸 碳酸氢钠+盐酸
现 象
分 析
看图探究
Na+
Na+
CO32-
Cl-
H+
Cl-
H+
H2O
碳酸钠和稀盐酸反应
结论:
反应实质是CO32-或HCO3-和H+反应生成CO2和H2O
CO2
实质:
旁观者:
Cl-和Na+
H2CO3
生成新盐和水和二氧化碳(新酸)
【思考】1、含有CO32- 或HCO3 –的盐都能与哪类 物质反应,产生的气体是什么?
2、如何检验CO32- 或HCO3 –?
取少量待测样品于试管中,加入少量稀盐酸,若产生能使澄清石灰水变浑浊的气体,则说明样品中含有CO32- 或HCO3 –
能与酸反应,
Na2CO3 + 2HCl = 2NaCl + H2O+CO2↑
NaHCO3 + HCl = NaCl + H2O + CO2↑
取样品
药品:稀盐酸、石灰水
现象:产生气泡、澄清石灰水变浑浊
溶液产生白色沉淀
含有CO32-的碳酸盐溶液与石灰水能反应产生白色沉淀
Na2CO3+Ca(OH)2=CaCO3↓+2NaOH
实验11-2:向盛有少量Na2CO3溶液的试管
滴入澄清的石灰水,观察现象。
该反应的实质是什么?
由实验11-1和11-2可知,碳酸盐有什么共同的化学性质?
现象
化学方程式
分析
(1)能与酸反应,生成新盐和水和二氧化碳(新酸)
Na2CO3 + 2 HCl === 2NaCl + CO2↑+H2O
NaHCO3 + HCl === NaCl + CO2↑+H2O
(2)能与某些碱反应,生成新碳酸盐↓和新碱
Na2CO3 + Ca(OH)2 === CaCO3 ↓+ 2 NaOH
碳酸盐化学性质
CaCO3 + 2HCl == CaCl2 + H2O + CO2↑
[举一反三]2、写出下列反应的化学方程式。P67学评
氢氧化钾与硫酸反应:
碳酸氢钾与硫酸反应:
碳酸钾与盐酸反应:
碳酸钾与澄清石灰水反应:
K2CO3 + 2 HCl = 2KCl + CO2↑+H2O
K2CO3 + Ca(OH)2 = 2KOH + CaCO3↓
1、为什么碳酸氢钠可以治疗胃酸过多?
2、自制汽水中的气泡是如何产生的?P45
[学以致用]
NaHCO3 + HCl = NaCl+H2O+CO2↑
3、馒头、面包等发面食品的一个特点是面团中有许多小孔,它们使发面食品松软可口。根据发酵粉(含碳酸氢钠和有机酸等)可与面粉、水混合直接制作发面食品的事实,说明碳酸氢钠在其中的作用。
[学以致用]
和面时,发酵粉中的NaHCO3能和有机酸遇水起反应,产生CO2气体,气体在面团中形成许多小气室,使馒头、面包等疏松多孔。
酸的化学性质
1、与指示剂作用(酸能使紫色石蕊溶液变红色)
2、酸与活泼金属反应,生成氢气和盐
3、酸与金属氧化物反应,生成盐和水
5、酸与碳酸盐反应,生成新盐和水和二氧化碳(新酸)
4、酸与碱发生中和反应,生成盐和水
1、与指示剂作用(碱溶液能使紫色石蕊溶液变蓝色,能使无色酚酞溶液变红色)
碱的化学性质
2、碱与非金属氧化物反应,生成盐和水
3、碱与酸发生中和反应,生成盐和水
4、碱与某些盐发生反应,生成新碱和新盐
本课小结
1、了解几种常见的碳酸盐的俗称及用途;
2、知道碳酸盐的两点化学性质:(1)能与酸反应生成水和二氧化碳,
(2)能与某些碱(氢氧化钙、氢氧化钡等)反应,生成碳酸盐沉淀;
3、会检验和鉴别碳酸盐。(用稀盐酸和澄清石灰水)
厨房里有两瓶白色固体,一瓶是食盐,一瓶是纯碱。想想看,我们能用哪些方法鉴别它们呢?
1、下列各组物质名称不代表同一物质的一组是( )
A.氯化钠、盐
B.氢氧化钠、苛性钠
C.碳酸钠、纯碱
D.碳酸氢钠、小苏打
2、下列关于物质用途的说法中,错误的是( )
A.碳酸钙用作补钙剂
B.碳酸氢钠用于焙制糕点
C.纯碱溶液用于除水垢
D.食盐用作调味品
A
C
3、将珍珠放入稀盐酸中,有气泡产生,生成的气体能使澄清的石灰水变浑浊,则珍珠中含有下列离子中的( )。
C
A、氯离子 B、硫酸根离子
C、碳酸根离子 D、氢氧根离子
(1)可用作洗涤剂的是(填序号,下同)____;
(2)可用作调味剂的_____________________;
(3)可用作补钙剂和牙膏填充剂的是________;
(4)可用于生产玻璃的是_________________;
(5)可用作发酵粉和治疗胃酸过多症的是____;
b
c
b
d
a
4、在下列物质:
a食盐;b纯碱;c碳酸氢钠;d碳酸钙
探究:如何鉴别氯化钠溶液和碳酸钠溶液?
Na2CO3+2HCl==
2NaCl+H2O+CO2↑
Na2CO3+Ca(OH)2==
CaCO3↓+2NaOH
酚酞试液
显红色的为碳酸钠溶液
无色的为氯化钠溶液
pH试纸
pH>7 ,碳酸钠溶液
pH=7,氯化钠溶液
稀盐酸
有大量气泡产生的是碳酸钠溶液,无明显现象的为氯化钠溶液
氢氧化
钙溶液
有白色沉淀产生的是碳酸钠溶液,无明显现象的为氯化钠溶液
方法 实验现象、结论 原理
(用化学方程式表示)
同课章节目录
