人教版化学必修二1.3 化学键 经典导学课件(共60张PPT)
文档属性
| 名称 | 人教版化学必修二1.3 化学键 经典导学课件(共60张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 6.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-03-09 22:04:30 | ||
图片预览









文档简介
(共394张PPT)
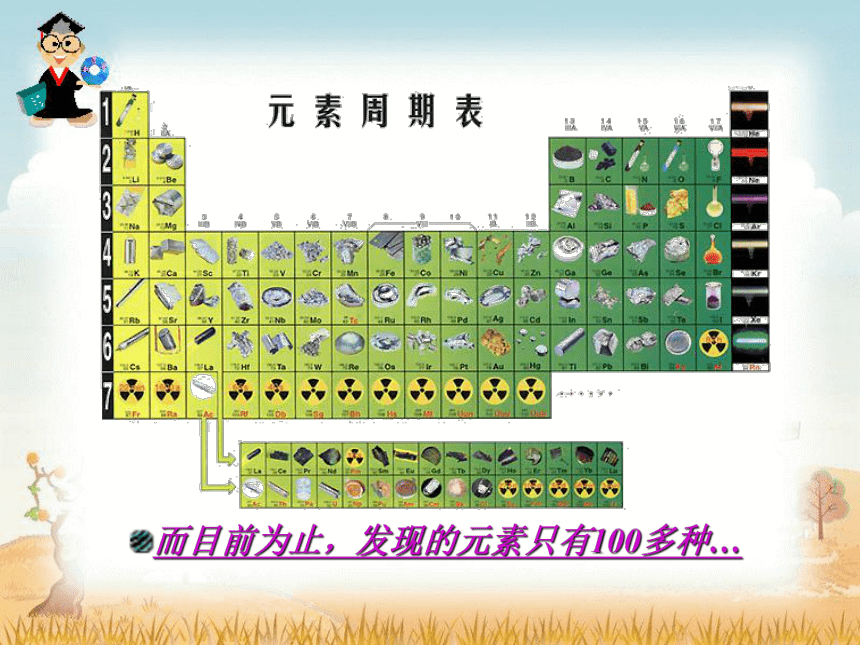
世界上的物质数以万计…
而目前为止,发现的元素只有100多种…
100多种元素
成千上万的物质
组成
?!
元素的原子通过什么作用形成如此丰富多彩的物质呢?
一、离子键
二、共价键
第三节 化学键
知识与能力
掌握离子键、共价键的概念。
了解极性键和非极性键的概念 。
掌握离子键、共价键的形成过程和形成条件。
能熟练地用电子式表示离子化合物及共价化合物的形成过程。
教学目标
过程与方法
通过对化学键形成过程中的教学,培养学生抽象思维和综合概括能力。
通过电子式的书写,培养学生的归纳比较能力。
情感、态度与价值观
培养学生从宏观到微观,从现象到本质的认识事物的科学方法。
培养学生用对立统一的规律认识问题。
重点
难点
离子键、共价键的概念。
离子键、共价键的形成过程和形成条件。
用电子式表示离子化合物及共价化合物的形成过程。
离子键、共价键的概念。
用电子式表示离子化合物及共价化合物的形成过程。
教学重难点
一、离子键
钠与氯气的反应
取一块绿豆大的切去氧化层的金属钠,用滤纸洗净煤油,放在石棉网上,用酒精微热,待钠熔成球状时将盛有氯气的集气瓶迅速倒扣在钠的上方,观察现象。
钠在氯气中燃烧,瓶中充满白烟。
钠和氯气剧烈反应生成氯化钠,小颗粒悬浮在气体中呈白烟状。
反应方程式
2Na + Cl2 = 2NaCl
1、离子键的形成和特点
离子键形成:
(1) 电负性相差较大的活泼金属原子和活泼非金属原子在一定条件下相遇时,发生原子间的电子转移,分别形成正、负离子。
(2)正负离子之间由于静电作用而相互吸引,当它们充分接近时,两核之间和电子云之间便产生排斥力。
(3)当吸引力和排斥力处于平衡状态时,整个体系的能量降至最低值,于是正、负离子间就形成了稳定的化学键,即离子键。
Na和Cl的反应过程
Na+
Cl-
Na
Cl
NaCl晶体结构示意图
Na+
Cl-
由于原子间电子转移形成正、负离子,并通过静电作用而形成的化学键,叫做离子键。
静电作用
静电引力(核与电子之间)
静电斥力(核与核,电子与电子之间)
离子键定义:
生成离子键的条件:
铵盐子和酸根离子(或活泼非金属元素)形成的盐。
把NH4+看作是活泼的金属阳离子
活泼的金属元素(IA,IIA)和活泼的非金属元素(VIA,VIIA)之间的化合物。
活泼的金属元素和酸根离子(SO42-、NO3-、Cl-等)形成的盐。
离子键的特点:
无方向性:与任何方向的电性不同的离子相吸引。
无饱和性:只要是正负离子之间,则彼此吸引。
由离子键构成的化合物叫离子化合物。如:强碱、大多数的盐类及典型的金属氧化物等。
离子化合物:
离子半径的变化规律
各主族元素,自上而下,电荷数相同的离子半径依次增大;
Li+<Na+<K+<Rb+<Cs+。
同一周期的主族元素,自左而右,正离子电荷增大半径减小;
r(Na+)>r(Mg2+)。
同一元素,高价离子的半径<低价离子的半径;
r(Fe3+)<r(Fe2+) 。
周期表中相邻族左上与右下斜对角线上的正离子半径近似相等。
负离子半径一般较大,正离子半径一般较小。
2、用电子式表示离子化合物的形成
电子式:
为了方便起见,我们可以在元素符号周围用“.” 或“×”来表示原子的最外层电子,这种式子叫做电子式。
原子:
离子:
离子化合物:
用电子式表示离子化合物的形成
氯化钠的形成过程:
氧化镁的形成过程:
离子须注明电荷数。
相同的原子可以合并写,相同的离子要单个写。
阴离子要用方括号括起。
不能把 “→”写成 “ ==”。
用箭头表明电子转移方向(也可不标)。
电子式书写时的注意事项
我们知道:
钠在氯气中燃烧生成氯化钠分子,它是由钠离子和氯离子间的静电作用形成的。
二、共价键
那么:
共价化合物HCl、H2 、Cl2的形成和NaCl一样吗?它们又是通过什么样的方式结合在一起的呢,是通过阴阳离子间静电作用吗?
以HCl为例:
氢原子最外层有一个电子,它要达到稳定结构就需要得到一个电子。而氯原子最外有7个电子要达到8电子稳定结构也需要得到一个电子,如果两原子都达到稳定结构的话就只能是两原子各提供一个电子形成共用电子对。我们若用用电子式表示HCl的形成过程可表示为 :
H ·
+
→
共价键的形成:
原子之间通过共用电子对所形成的相互作用,叫做共价键。
共价键定义:
同种或不同种非金属元素原子结合;
部分金属元素原子与非金属元素原子
(如AlCl3 ,FeCl3) 。
共价键形成条件:
象HCl这样只以共用电子对形成分子的化合物。
共价键表示方法:
在化学上常用一根短线“-”表示一对共用电子,如:
Cl-Cl
共价化合物:
H-Cl
共价键分类:
同种元素的原子之间形成的共价键称非极性共价键,简称非极性键;如H2、N2 、 Cl2
不同元素的原子之间形成的共价键称性共价键,简称极性共价键。如H2O 、 CO2
成键原子的非金属性相差越大其键的极性就越强。
影响极性键的强弱因素:
判断非极性键和极性键的依据:
不同种元素的原子之间形成的共价键一定是极性键。
同种元素的原子之间形成的共价键一定是非极性键;
离子键与共价键的比较:
离子键 共价键
成键微粒 阴、阳离子 原子
成键本质 静电作用 共用电子对
表示法 以NaCl为例 以为HCl例
成键元素 典型的金属元素、典型的非金属元素之间 同种元素或同类非金属元素之间
离子键使离子结合形成离子化合物;
共价键使原子结合形成共价化合物;
这种使离子或原子相结合的作用力通称为化学键。
化学键
离子键(价电子转移)
共价键(价电子共用)
一个化学反应的的过程,本质上就是旧化学键断裂和新化学键形成的过程。
化学反应的本质:
分子间作用力和氢键
1.分子间作用力
定义: 分子之间存在的一种把分子聚集在一起的作用力叫做分子间作用力(也叫范德华力)。
特点:分子间作用力比化学键弱得多,它主要影响物质的物理性质(如熔、沸点等),而化学键主要影响物质的化学性质。
一般来说,对于组成和结构相似的物质,相对分子质量越大,分子间作用力越大,物质的熔、沸点越高,如卤素单质:
熔沸点逐渐升高
卤族元素单质熔沸点变化
物质 F2 Cl2 Br2 I2
相对分子量 38 71 160 254
熔点(℃) -219.6 -101 -7.2 113.5
沸点(℃) -188.1 -34.6 58.78 184.4
熔沸点变化趋势
解释一些反常现象
一些氢化物的沸点
为什么HF、H2O和NH3的沸点与范德华力规律不符?
为什么冰会浮在水面上呢?
定义:
分子之间的氢核与带部分负电荷的非金属原子相互吸引,这种静电作用称氢键。
氢键
氢键的表示方法: X—H…Y
原子半径较小,非金属性很强的原子X,(N、O、F)与H原子形成强极性共价键,与另一个分子中的半径较小,非金属性很强的原子Y (N、O、F),在分子间H与Y产生较强的静电吸引,形成氢键。
氢键的形成条件:
使物质有较高的熔沸点(H2O、 HF 、NH3)
使物质 的溶解度增大(C2H5OH,CH3COOH)
(1)作用力比范德华力大,但比化学键小得多
(2)一种特殊的分子间作用力,不是化学键
(3)具有方向性和饱和性
氢键的特点:
氢键的作用:
化学键
离子键
共价键
极性共价键
(共用电子偏向一方)
非极性共价键
(共用电子对不偏移)
离子化合物
共价化合物
知识结构
课堂小结
离子键与共价键的比较
离子键 共价键
极性键 非极性键
成键微粒 阴离子和阳离子 不相同的原子 一般是相同的原子
微粒间的作用力 静电作用(包含静电引力和静电斥力) 共用电子对的作用
成键的条件 一般是活泼金属和活泼非金属之间形成 同种或不同种非金属原子之间形成
存在于何种类型物质中 离子化合物 大多数非金属单质、共价化合物、某些离子化合物
高考链接
1.(09海南卷)下列原子序数所对应的元素组中,两者可形成离子键的是( )
1和17 B.12和9
C. 14和6 D.15和8
B
解析:
本体可以根据原子序数写出化学式即A为HCl,B为MgF2是离子化合物,存在离子键
2.(07海南卷)下列叙述正确的是( )
A.分子晶体中的每个分子内一定含有共价键
B.原子晶体中的相邻原子间只存在非极性共价键
C.离子晶体中可能含有共价键
D.金属晶体的熔点和沸点都很高
C
解析:
本题中稀有气体为单原子分子无共价键;原子晶体中如SiO2也存在Si—O极性共价键,B错;在铵盐中既存在离子键又存在共价键,C正确。金属汞的熔点很低,D错。
3.(07海南卷)用价层电子对互斥理论预测H2S和BF3的立体结构,两个结论都正确的是( )
A.直线形;三角锥形
B.V形;三角锥形
C.直线形;平面三角形
D.V形;平面三角形
D
解析:
H2S 的立体结构为V形;BF3的立体结构为平面三角形。
1. 写出下列微粒的电子式:
(1)硫原子
(2)氯化镁
(3)氮气
(4)水分子
(5)氯气
2. 含有共价键的离子化合物有( D )
A. Li2O B. MgCl2
C. H2S D. Na2O2
D
3. 在下列分子结构中,原子的最外层电子不能满足8电子稳定结构的是(D )
A.CO2 B.PCl3
C.CCl4 D.NO2
D
4. 关于化学键的下列叙述中,正确的是 (A D )
A. 离子化合物可能含共价键
B. 共价化合物可能含离子键
C. 离子化合物中只含离子键
D. 共价化合物中不含离子键
AD
5. 下列叙述中正确的是( D )
A.共价化合物中一定没有离子键,离子化合
物中一定没有共价键
B.分子晶体和原子晶体中一定含有共价键
C.由不同种原子形成的纯净物一定是化合物
D.石墨转化成金刚石要吸收热量,石墨比金
刚石稳定
D
6. 下列事实能说明HCl是共价化合物的是( A)
A. 液态HCl不导电
B. HCl水溶液呈酸性
C. HCl溶解于水可以电离出H+和Cl-
D. HCl不易分解
A
7. 下列过程中,共价键被破坏的是( D )
A.碘升华 B.溴蒸气被木炭吸附
C.蔗糖溶于水 D.氯化氢气体溶于水
D
8. 下列关于只含非金属元素的化合物的说法中,正确的是( )
A.一定是共价化合物
B.其晶体有可能是离子晶体
C.其晶体不可能是离子晶体
D.其晶体不可能是原子晶体
B
9. 金属具有延展性的原因( )
A. 金属原子半径都比较大,价电子较少
B. 自由电子受外力作用时能迅速传递能量
C. 金属受外力作用变形时,金属阳离子与自由电子间仍保持较强烈的作用
D. 金属受外力作用变形时,金属阳离子与自由电子间强烈的作用被破坏
C
10. 下列关于NaHSO4的说法中正确的是( )
A. NaHSO4固体是离子晶体
B. NaHSO4晶体中阳离子和阴离子的个数是2 :1
C. NaHSO4晶体熔化时破坏的是离子键和共价键
D. NaHSO4固体溶于水时既破坏离子键又破坏共价键
AD
11. KO2的晶体结构和NaCl 相似,可以看作是Na+的位置用K+代替,Cl——的位置用O2—代替,下列对KO2的晶体结构的描述错误的是( )
A. 和K+距离相同且最近的O2—共有8个
B. 和K+距离相同且最近的K+共有12个
C. 和K+距离相同且最近的O2—构成的多面体是正八面体
D. 和K+距离相同且最近的O2—构成的多面体是正六面体
AD
18. 单质硼有无定形和晶体两种,参考下列数据:
晶体 金刚石 晶体硅 晶体硼
熔点(K) >3823 1683 2573
沸点(K) 5100 2628 2823
硬度(Moh) 10 7.0 9.5
(1)晶体硼的晶体类型属于_________晶体,理由是__________________________________________________________________________________________________________
(2)已知晶体硼的基本结构单元是由硼原子组成的 正二十面体(如上图所示),各正二十面体之间以B—B键相互联结,在每个正二十面体中有二十个等边三角形的面和一定数目的顶角,每个顶点各有一个硼原子。通过观察图形及推算,得出此基本结构单元是由_____个硼原子构成,其中B—B键之间的键角是__________。
原子晶体
非金属单质晶体硼的熔、沸点和硬度都介于原子晶体金刚石和晶体硅之间,由此推知晶体硼为原子晶体。
12
60°
1、
①
⑥
②
③
④
⑤
C
×
×
×
×
.
.
.
.
H
H
H
H
2、C 3、D 4、D
课后习题答案
5、略
6、稀有气体最外层电子已达2个或8个电子的
稳定结构
7、 ⑴
⑵
+
×Mg ×
+
8、⑴非极性键 ⑵非极性键 ⑶极性键
⑷极性键 ⑸极性键
9、⑴离子键和共价键
⑵属于离子化合物的有:NaOH、NaF、
MgCl2、CaO;
属于共价化合物的有: HCl、CO2、H2O、CH4
世界上的物质数以万计…
而目前为止,发现的元素只有100多种…
100多种元素
成千上万的物质
组成
?!
元素的原子通过什么作用形成如此丰富多彩的物质呢?
一、离子键
二、共价键
第三节 化学键
知识与能力
掌握离子键、共价键的概念。
了解极性键和非极性键的概念 。
掌握离子键、共价键的形成过程和形成条件。
能熟练地用电子式表示离子化合物及共价化合物的形成过程。
教学目标
过程与方法
通过对化学键形成过程中的教学,培养学生抽象思维和综合概括能力。
通过电子式的书写,培养学生的归纳比较能力。
情感、态度与价值观
培养学生从宏观到微观,从现象到本质的认识事物的科学方法。
培养学生用对立统一的规律认识问题。
重点
难点
离子键、共价键的概念。
离子键、共价键的形成过程和形成条件。
用电子式表示离子化合物及共价化合物的形成过程。
离子键、共价键的概念。
用电子式表示离子化合物及共价化合物的形成过程。
教学重难点
一、离子键
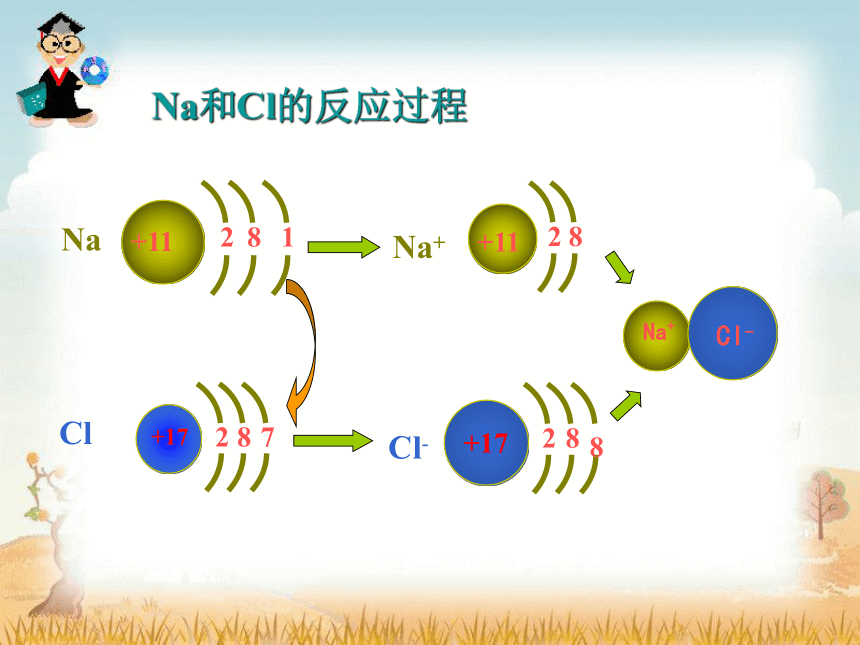
钠与氯气的反应
取一块绿豆大的切去氧化层的金属钠,用滤纸洗净煤油,放在石棉网上,用酒精微热,待钠熔成球状时将盛有氯气的集气瓶迅速倒扣在钠的上方,观察现象。
钠在氯气中燃烧,瓶中充满白烟。
钠和氯气剧烈反应生成氯化钠,小颗粒悬浮在气体中呈白烟状。
反应方程式
2Na + Cl2 = 2NaCl
1、离子键的形成和特点
离子键形成:
(1) 电负性相差较大的活泼金属原子和活泼非金属原子在一定条件下相遇时,发生原子间的电子转移,分别形成正、负离子。
(2)正负离子之间由于静电作用而相互吸引,当它们充分接近时,两核之间和电子云之间便产生排斥力。
(3)当吸引力和排斥力处于平衡状态时,整个体系的能量降至最低值,于是正、负离子间就形成了稳定的化学键,即离子键。
Na和Cl的反应过程
Na+
Cl-
Na
Cl
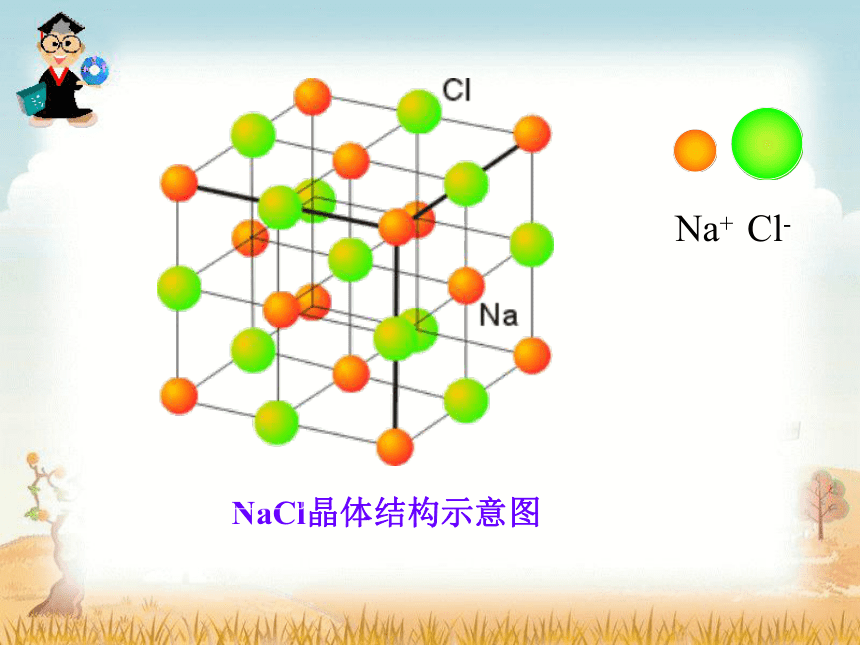
NaCl晶体结构示意图
Na+
Cl-
由于原子间电子转移形成正、负离子,并通过静电作用而形成的化学键,叫做离子键。
静电作用
静电引力(核与电子之间)
静电斥力(核与核,电子与电子之间)
离子键定义:
生成离子键的条件:
铵盐子和酸根离子(或活泼非金属元素)形成的盐。
把NH4+看作是活泼的金属阳离子
活泼的金属元素(IA,IIA)和活泼的非金属元素(VIA,VIIA)之间的化合物。
活泼的金属元素和酸根离子(SO42-、NO3-、Cl-等)形成的盐。
离子键的特点:
无方向性:与任何方向的电性不同的离子相吸引。
无饱和性:只要是正负离子之间,则彼此吸引。
由离子键构成的化合物叫离子化合物。如:强碱、大多数的盐类及典型的金属氧化物等。
离子化合物:
离子半径的变化规律
各主族元素,自上而下,电荷数相同的离子半径依次增大;
Li+<Na+<K+<Rb+<Cs+。
同一周期的主族元素,自左而右,正离子电荷增大半径减小;
r(Na+)>r(Mg2+)。
同一元素,高价离子的半径<低价离子的半径;
r(Fe3+)<r(Fe2+) 。
周期表中相邻族左上与右下斜对角线上的正离子半径近似相等。
负离子半径一般较大,正离子半径一般较小。
2、用电子式表示离子化合物的形成
电子式:
为了方便起见,我们可以在元素符号周围用“.” 或“×”来表示原子的最外层电子,这种式子叫做电子式。
原子:
离子:
离子化合物:
用电子式表示离子化合物的形成
氯化钠的形成过程:
氧化镁的形成过程:
离子须注明电荷数。
相同的原子可以合并写,相同的离子要单个写。
阴离子要用方括号括起。
不能把 “→”写成 “ ==”。
用箭头表明电子转移方向(也可不标)。
电子式书写时的注意事项
我们知道:
钠在氯气中燃烧生成氯化钠分子,它是由钠离子和氯离子间的静电作用形成的。
二、共价键
那么:
共价化合物HCl、H2 、Cl2的形成和NaCl一样吗?它们又是通过什么样的方式结合在一起的呢,是通过阴阳离子间静电作用吗?
以HCl为例:
氢原子最外层有一个电子,它要达到稳定结构就需要得到一个电子。而氯原子最外有7个电子要达到8电子稳定结构也需要得到一个电子,如果两原子都达到稳定结构的话就只能是两原子各提供一个电子形成共用电子对。我们若用用电子式表示HCl的形成过程可表示为 :
H ·
+
→
共价键的形成:
原子之间通过共用电子对所形成的相互作用,叫做共价键。
共价键定义:
同种或不同种非金属元素原子结合;
部分金属元素原子与非金属元素原子
(如AlCl3 ,FeCl3) 。
共价键形成条件:
象HCl这样只以共用电子对形成分子的化合物。
共价键表示方法:
在化学上常用一根短线“-”表示一对共用电子,如:
Cl-Cl
共价化合物:
H-Cl
共价键分类:
同种元素的原子之间形成的共价键称非极性共价键,简称非极性键;如H2、N2 、 Cl2
不同元素的原子之间形成的共价键称性共价键,简称极性共价键。如H2O 、 CO2
成键原子的非金属性相差越大其键的极性就越强。
影响极性键的强弱因素:
判断非极性键和极性键的依据:
不同种元素的原子之间形成的共价键一定是极性键。
同种元素的原子之间形成的共价键一定是非极性键;
离子键与共价键的比较:
离子键 共价键
成键微粒 阴、阳离子 原子
成键本质 静电作用 共用电子对
表示法 以NaCl为例 以为HCl例
成键元素 典型的金属元素、典型的非金属元素之间 同种元素或同类非金属元素之间
离子键使离子结合形成离子化合物;
共价键使原子结合形成共价化合物;
这种使离子或原子相结合的作用力通称为化学键。
化学键
离子键(价电子转移)
共价键(价电子共用)
一个化学反应的的过程,本质上就是旧化学键断裂和新化学键形成的过程。
化学反应的本质:
分子间作用力和氢键
1.分子间作用力
定义: 分子之间存在的一种把分子聚集在一起的作用力叫做分子间作用力(也叫范德华力)。
特点:分子间作用力比化学键弱得多,它主要影响物质的物理性质(如熔、沸点等),而化学键主要影响物质的化学性质。
一般来说,对于组成和结构相似的物质,相对分子质量越大,分子间作用力越大,物质的熔、沸点越高,如卤素单质:
熔沸点逐渐升高
卤族元素单质熔沸点变化
物质 F2 Cl2 Br2 I2
相对分子量 38 71 160 254
熔点(℃) -219.6 -101 -7.2 113.5
沸点(℃) -188.1 -34.6 58.78 184.4
熔沸点变化趋势
解释一些反常现象
一些氢化物的沸点
为什么HF、H2O和NH3的沸点与范德华力规律不符?
为什么冰会浮在水面上呢?
定义:
分子之间的氢核与带部分负电荷的非金属原子相互吸引,这种静电作用称氢键。
氢键
氢键的表示方法: X—H…Y
原子半径较小,非金属性很强的原子X,(N、O、F)与H原子形成强极性共价键,与另一个分子中的半径较小,非金属性很强的原子Y (N、O、F),在分子间H与Y产生较强的静电吸引,形成氢键。
氢键的形成条件:
使物质有较高的熔沸点(H2O、 HF 、NH3)
使物质 的溶解度增大(C2H5OH,CH3COOH)
(1)作用力比范德华力大,但比化学键小得多
(2)一种特殊的分子间作用力,不是化学键
(3)具有方向性和饱和性
氢键的特点:
氢键的作用:
化学键
离子键
共价键
极性共价键
(共用电子偏向一方)
非极性共价键
(共用电子对不偏移)
离子化合物
共价化合物
知识结构
课堂小结
离子键与共价键的比较
离子键 共价键
极性键 非极性键
成键微粒 阴离子和阳离子 不相同的原子 一般是相同的原子
微粒间的作用力 静电作用(包含静电引力和静电斥力) 共用电子对的作用
成键的条件 一般是活泼金属和活泼非金属之间形成 同种或不同种非金属原子之间形成
存在于何种类型物质中 离子化合物 大多数非金属单质、共价化合物、某些离子化合物
高考链接
1.(09海南卷)下列原子序数所对应的元素组中,两者可形成离子键的是( )
1和17 B.12和9
C. 14和6 D.15和8
B
解析:
本体可以根据原子序数写出化学式即A为HCl,B为MgF2是离子化合物,存在离子键
2.(07海南卷)下列叙述正确的是( )
A.分子晶体中的每个分子内一定含有共价键
B.原子晶体中的相邻原子间只存在非极性共价键
C.离子晶体中可能含有共价键
D.金属晶体的熔点和沸点都很高
C
解析:
本题中稀有气体为单原子分子无共价键;原子晶体中如SiO2也存在Si—O极性共价键,B错;在铵盐中既存在离子键又存在共价键,C正确。金属汞的熔点很低,D错。
3.(07海南卷)用价层电子对互斥理论预测H2S和BF3的立体结构,两个结论都正确的是( )
A.直线形;三角锥形
B.V形;三角锥形
C.直线形;平面三角形
D.V形;平面三角形
D
解析:
H2S 的立体结构为V形;BF3的立体结构为平面三角形。
1. 写出下列微粒的电子式:
(1)硫原子
(2)氯化镁
(3)氮气
(4)水分子
(5)氯气
2. 含有共价键的离子化合物有( D )
A. Li2O B. MgCl2
C. H2S D. Na2O2
D
3. 在下列分子结构中,原子的最外层电子不能满足8电子稳定结构的是(D )
A.CO2 B.PCl3
C.CCl4 D.NO2
D
4. 关于化学键的下列叙述中,正确的是 (A D )
A. 离子化合物可能含共价键
B. 共价化合物可能含离子键
C. 离子化合物中只含离子键
D. 共价化合物中不含离子键
AD
5. 下列叙述中正确的是( D )
A.共价化合物中一定没有离子键,离子化合
物中一定没有共价键
B.分子晶体和原子晶体中一定含有共价键
C.由不同种原子形成的纯净物一定是化合物
D.石墨转化成金刚石要吸收热量,石墨比金
刚石稳定
D
6. 下列事实能说明HCl是共价化合物的是( A)
A. 液态HCl不导电
B. HCl水溶液呈酸性
C. HCl溶解于水可以电离出H+和Cl-
D. HCl不易分解
A
7. 下列过程中,共价键被破坏的是( D )
A.碘升华 B.溴蒸气被木炭吸附
C.蔗糖溶于水 D.氯化氢气体溶于水
D
8. 下列关于只含非金属元素的化合物的说法中,正确的是( )
A.一定是共价化合物
B.其晶体有可能是离子晶体
C.其晶体不可能是离子晶体
D.其晶体不可能是原子晶体
B
9. 金属具有延展性的原因( )
A. 金属原子半径都比较大,价电子较少
B. 自由电子受外力作用时能迅速传递能量
C. 金属受外力作用变形时,金属阳离子与自由电子间仍保持较强烈的作用
D. 金属受外力作用变形时,金属阳离子与自由电子间强烈的作用被破坏
C
10. 下列关于NaHSO4的说法中正确的是( )
A. NaHSO4固体是离子晶体
B. NaHSO4晶体中阳离子和阴离子的个数是2 :1
C. NaHSO4晶体熔化时破坏的是离子键和共价键
D. NaHSO4固体溶于水时既破坏离子键又破坏共价键
AD
11. KO2的晶体结构和NaCl 相似,可以看作是Na+的位置用K+代替,Cl——的位置用O2—代替,下列对KO2的晶体结构的描述错误的是( )
A. 和K+距离相同且最近的O2—共有8个
B. 和K+距离相同且最近的K+共有12个
C. 和K+距离相同且最近的O2—构成的多面体是正八面体
D. 和K+距离相同且最近的O2—构成的多面体是正六面体
AD
18. 单质硼有无定形和晶体两种,参考下列数据:
晶体 金刚石 晶体硅 晶体硼
熔点(K) >3823 1683 2573
沸点(K) 5100 2628 2823
硬度(Moh) 10 7.0 9.5
(1)晶体硼的晶体类型属于_________晶体,理由是__________________________________________________________________________________________________________
(2)已知晶体硼的基本结构单元是由硼原子组成的 正二十面体(如上图所示),各正二十面体之间以B—B键相互联结,在每个正二十面体中有二十个等边三角形的面和一定数目的顶角,每个顶点各有一个硼原子。通过观察图形及推算,得出此基本结构单元是由_____个硼原子构成,其中B—B键之间的键角是__________。
原子晶体
非金属单质晶体硼的熔、沸点和硬度都介于原子晶体金刚石和晶体硅之间,由此推知晶体硼为原子晶体。
12
60°
1、
①
⑥
②
③
④
⑤
C
×
×
×
×
.
.
.
.
H
H
H
H
2、C 3、D 4、D
课后习题答案
5、略
6、稀有气体最外层电子已达2个或8个电子的
稳定结构
7、 ⑴
⑵
+
×Mg ×
+
8、⑴非极性键 ⑵非极性键 ⑶极性键
⑷极性键 ⑸极性键
9、⑴离子键和共价键
⑵属于离子化合物的有:NaOH、NaF、
MgCl2、CaO;
属于共价化合物的有: HCl、CO2、H2O、CH4
