人教版 高二 化学选修五第二章第一节脂肪烃(共51张PPT)
文档属性
| 名称 | 人教版 高二 化学选修五第二章第一节脂肪烃(共51张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 723.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-03-10 12:18:03 | ||
图片预览










文档简介
(共51张PPT)
1 脂 肪 烃
一、结构特点
1、烷烃
2、烯烃
3、炔烃
二、性质
学习有机物的一般思路:
1、结构 性质 用途 制法
2、从个别到一般(通式、通性、命名、同分异构体的书写)
3、有关有机物的沸点高低
有机物的沸点
分子间作用力
(分子的极性、分子间接触面积)
分子量越大,沸点越高
支链化程度高,沸点越低
考虑顺序
1、试将下列烃类化合物按沸点高低顺序排列:
(1)3,3—二甲基戊烷 (2)正庚烷
(3)2—甲基庚烷 (4)正戊烷
(5)2-甲基己烷
练一练
(3) ﹥ (2) ﹥ (5) ﹥ (1) ﹥ (4)
一)、物理性质
1、密度
2、水溶性
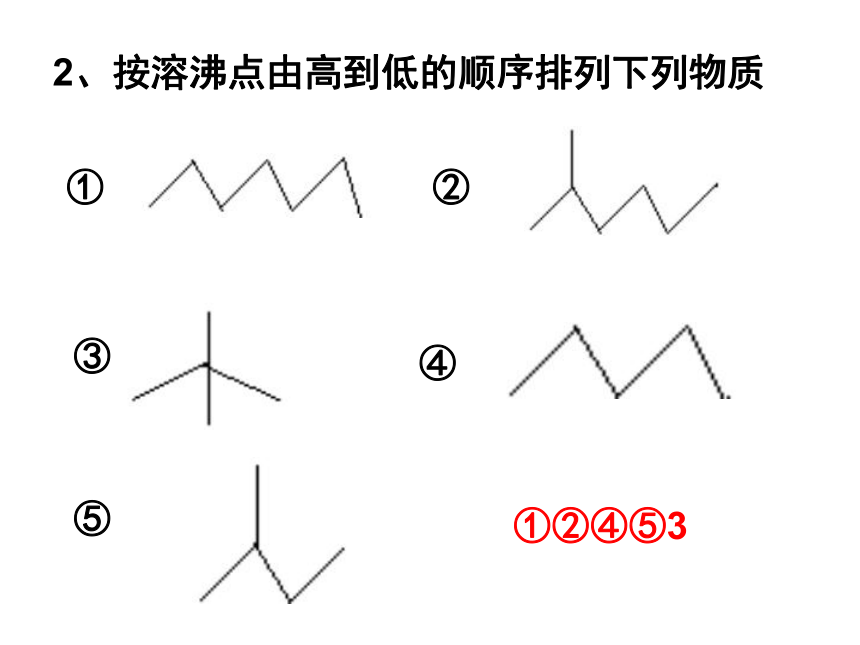
2、按溶沸点由高到低的顺序排列下列物质
①
⑤
③
④
②
①②④⑤3
二、化学性质
共性:可燃性
烃燃烧的通式:
特点:
甲烷 乙烯 乙炔的燃烧
二)、化学性质
共性:
可燃性
1、 烷烃
(1)取代反应
试剂:
条件:
取代原理:
取代产物:
纯卤素
光照或△
一个Cl取代一个H,但耗一个Cl2
CH4 + Cl2
光照
C
H
H
H
H
Cl
Cl
+
CH3Cl + HCl
CH3Cl + Cl2
光照
CH2Cl2 + HCl
C
H
H
Cl
Cl
Cl
+
H
特点:
2、裂化或裂解反应
(2) 烯烃
氧化反应
氧化剂:O2、KMnO4(H+)、O3等
已知:
CH2=CH2
KMnO4(H+)
2CO2
CH3CH=CHCH3 2CH3COOH
CH3 C = C CH3 2CH3CCH3
CH3
CH3
完成方程式:
KMnO4(H+)
KMnO4(H+)
O
已知:
CH2=CH2
KMnO4(H+)
2CO2
CH3CH=CHCH3 2CH3COOH
CH3 C = C CH3 2CH3CCH3
CH3
CH3
完成方程式:
KMnO4(H+)
KMnO4(H+)
O
……...
……...
已知:
C=C
O3
Zn/H2O
C=O
+
O=C
CH3 C = C CH3
CH3
CH3
CH2=CH2
CH3CH=CHCH3
完成方程式:
CH2=C—CH2—CH=CH—CH3
CH3
制备乙烯:
浓H2SO4
+
H2O
CH3CH2OH CH2=CH2+H2O
浓H2SO4
反应装置及收集方法:
170?C
170?C
装置类型:
(二) 烯烃
1、氧化反应
氧化剂:O2、KMnO4(H+)、O3等
2、加成反应
乙烯与溴的加成反应
我是
溴分子
加成反应的反应实质
乙烯
溴分子
1,2-二溴乙烷
(二) 烯烃
1、氧化反应
氧化剂:O2、KMnO4(H+)、O3等
2、加成反应
试剂:
H2、X2、HX、H2O、HCN等
思考:
将乙烯通入溴的四氯化碳溶液中则 。
发生了 反应。
如何证明是加成反应,而不是取代反应?
溶液褪色
加成
下列化学反应中的产物中存在同分异构体的是 ( )
A、丙烯与H2加成
B、丙烯与HCl加成
C、丙烯与Br2加成
D、2-丁烯与HCl加成
B
(二) 烯烃
1、氧化反应
氧化剂:O2、KMnO4(H+)、O3等
2、加成反应
①试剂:
H2、X2、HX、H2O、HCN等
②马氏规则:不对称稀烃与卤化氢发生加
成反应时,H总是加到含H多
的不饱和碳原子上。
写出下列烯烃与X2、HX、 H2O发生加成反应的产物
③二烯烃的加成
共轭二烯烃
+Br2
1,2加成
1,4加成
1,2,3,4加成
CH2Br—CHBr—CH=CH2
CH2Br—CH=CH—CH2Br
CH2Br—CHBr—CHBr—CH2Br
常见
同步练习7、14
3、加聚反应
+CH2=CH2
CH3—CH=CH2
CH2=CH—CH=CH2 + CH2=CH—CN+
例题分析2
烯烃的性质
1.能使酸性高锰酸钾溶液或溴水溶液褪色
2.能燃烧
3.加成反应:可与H2、X2、HX、 H2O等加成
4.加聚反应
结构:平面分子。
键角:120度
由于碳碳双键不能旋转而导致分子中原子或原子团在空间的排列方式不同所产生的异构现象,称为顺反异构
产生顺反异构体的原因:
双键的化合物——由于双键不能自由旋转
产生顺反异构的条件:
1.必须有双键;
2.每个双键碳原子连接了两个不同的原子或原子团。
思考题:下列物质中没有顺反异构的是哪些?
1)1,2-二氯乙烯
2)1,2-二氯丙烯
3)2-甲基-2-丁烯
4)2-氯-2-丁烯
两个相同的原子或原子团排列在双键的同一侧的称为顺式结构。
两个相同的原子或原子团排列在双键的两侧的称为反式结构。
例如:
顺-2-丁烯
反-2-丁烯
化学性质基本相同,但物理性质有一定差异。
烯烃
同
分
异
构
体
碳链异构
位置异构
顺反异构
总结与归纳
三、乙炔的结构
分子式 C2H2
电子式
结构式
H?C?C?H
直线型分子
三、乙炔的性质和用途
物理性质
纯的乙炔是无色、无味的气体。密度比空气稍轻。微溶于水,易溶于有机溶剂。
思考:根据乙炔物理性质
如何收集乙炔气体?
1)原料:
2) 反应原理:
CaC2+ H2O
2
碳化钙(CaC2),俗名电石,
常含有磷化钙,硫化钙等杂质
2、乙炔的实验室制法
饱和食盐水
3) 制取装置:
固 + 液
气体
化学性质
1. 氧化反应
(1) 在空气或在氧气中燃烧
C2H2 + 5/2O2 → 2CO2 + H2O
(2) 被氧化剂氧化
—完全氧化
点燃
可使酸性高锰酸钾褪色
乙炔跟空气的混合物遇火会发生爆炸,在生产和使用乙炔时,必须注意安全。
注意
2.加成反应
1, 2—二溴乙烯
1, 1, 2, 2—四溴乙烷
用哪种方法可以区别甲烷和乙炔?
① 分别点燃甲烷和乙炔,若火焰明亮有大量黑烟生成的是乙炔;火焰呈淡蓝色的是甲烷。
② 将甲烷和乙炔分别通入两支盛有溴水的试管中,能使溴水褪色的是乙炔;不使溴水褪色的是甲烷。
③ 将甲烷和乙炔分别通入两支盛有酸性高锰酸钾溶液的试管中,能使酸性高锰酸钾溶液褪色的是乙炔;不使酸性高锰酸钾溶液褪色的是甲烷。
请观察比较:
练习: 乙炔是一种重要的基本有机原料,可以用来制备氯乙烯,
写出乙炔制取聚氯乙烯的化学反应方程式。
1、乙炔是一种重要的基本有机原料,可以
用来制备氯乙烯、聚氯乙烯和乙醛等。
2、乙炔燃烧时产生的氧炔焰可用来切割或
焊接金属。
5、乙炔的用途
第一节 脂肪烃
甲 烷
乙 烯
结构简式
结构特点
空间结构
物 性
化
性
燃 烧
反应类型
与Br2(CCl4)
与KMnO4(H+)
CH4
CH2=CH2
全部单键,饱和
有碳碳双键,不饱和
正四面体
平面结构
无色无味,难溶于水
易燃,完全燃烧生成CO2和H2O
NO
NO
加成反应,Br2的CCl4溶液褪色
被氧化KMnO4溶液褪色
取代反应
加成,聚合反应
烷 烃
烯 烃
炔 烃
通式
物性
化
性
CnH2n+2
CnH2n
CnH2n-2
沸点随着分子量的变化和结构呈规律性变化
密度比水小,难溶于水
燃烧
KMnO4氧化
取代
加成
聚合
×
√
×
×
√
√
√
√
√
√
×
×
1 脂 肪 烃
一、结构特点
1、烷烃
2、烯烃
3、炔烃
二、性质
学习有机物的一般思路:
1、结构 性质 用途 制法
2、从个别到一般(通式、通性、命名、同分异构体的书写)
3、有关有机物的沸点高低
有机物的沸点
分子间作用力
(分子的极性、分子间接触面积)
分子量越大,沸点越高
支链化程度高,沸点越低
考虑顺序
1、试将下列烃类化合物按沸点高低顺序排列:
(1)3,3—二甲基戊烷 (2)正庚烷
(3)2—甲基庚烷 (4)正戊烷
(5)2-甲基己烷
练一练
(3) ﹥ (2) ﹥ (5) ﹥ (1) ﹥ (4)
一)、物理性质
1、密度
2、水溶性
2、按溶沸点由高到低的顺序排列下列物质
①
⑤
③
④
②
①②④⑤3
二、化学性质
共性:可燃性
烃燃烧的通式:
特点:
甲烷 乙烯 乙炔的燃烧
二)、化学性质
共性:
可燃性
1、 烷烃
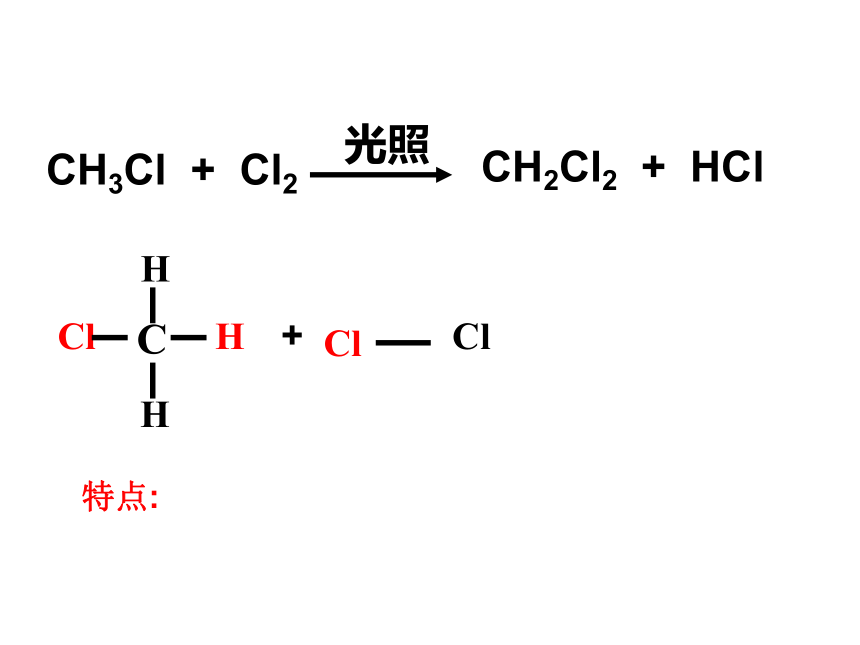
(1)取代反应
试剂:
条件:
取代原理:
取代产物:
纯卤素
光照或△
一个Cl取代一个H,但耗一个Cl2
CH4 + Cl2
光照
C
H
H
H
H
Cl
Cl
+
CH3Cl + HCl
CH3Cl + Cl2
光照
CH2Cl2 + HCl
C
H
H
Cl
Cl
Cl
+
H
特点:
2、裂化或裂解反应
(2) 烯烃
氧化反应
氧化剂:O2、KMnO4(H+)、O3等
已知:
CH2=CH2
KMnO4(H+)
2CO2
CH3CH=CHCH3 2CH3COOH
CH3 C = C CH3 2CH3CCH3
CH3
CH3
完成方程式:
KMnO4(H+)
KMnO4(H+)
O
已知:
CH2=CH2
KMnO4(H+)
2CO2
CH3CH=CHCH3 2CH3COOH
CH3 C = C CH3 2CH3CCH3
CH3
CH3
完成方程式:
KMnO4(H+)
KMnO4(H+)
O
……...
……...
已知:
C=C
O3
Zn/H2O
C=O
+
O=C
CH3 C = C CH3
CH3
CH3
CH2=CH2
CH3CH=CHCH3
完成方程式:
CH2=C—CH2—CH=CH—CH3
CH3
制备乙烯:
浓H2SO4
+
H2O
CH3CH2OH CH2=CH2+H2O
浓H2SO4
反应装置及收集方法:
170?C
170?C
装置类型:
(二) 烯烃
1、氧化反应
氧化剂:O2、KMnO4(H+)、O3等
2、加成反应
乙烯与溴的加成反应
我是
溴分子
加成反应的反应实质
乙烯
溴分子
1,2-二溴乙烷
(二) 烯烃
1、氧化反应
氧化剂:O2、KMnO4(H+)、O3等
2、加成反应
试剂:
H2、X2、HX、H2O、HCN等
思考:
将乙烯通入溴的四氯化碳溶液中则 。
发生了 反应。
如何证明是加成反应,而不是取代反应?
溶液褪色
加成
下列化学反应中的产物中存在同分异构体的是 ( )
A、丙烯与H2加成
B、丙烯与HCl加成
C、丙烯与Br2加成
D、2-丁烯与HCl加成
B
(二) 烯烃
1、氧化反应
氧化剂:O2、KMnO4(H+)、O3等
2、加成反应
①试剂:
H2、X2、HX、H2O、HCN等
②马氏规则:不对称稀烃与卤化氢发生加
成反应时,H总是加到含H多
的不饱和碳原子上。
写出下列烯烃与X2、HX、 H2O发生加成反应的产物
③二烯烃的加成
共轭二烯烃
+Br2
1,2加成
1,4加成
1,2,3,4加成
CH2Br—CHBr—CH=CH2
CH2Br—CH=CH—CH2Br
CH2Br—CHBr—CHBr—CH2Br
常见
同步练习7、14
3、加聚反应
+CH2=CH2
CH3—CH=CH2
CH2=CH—CH=CH2 + CH2=CH—CN+
例题分析2
烯烃的性质
1.能使酸性高锰酸钾溶液或溴水溶液褪色
2.能燃烧
3.加成反应:可与H2、X2、HX、 H2O等加成
4.加聚反应
结构:平面分子。
键角:120度
由于碳碳双键不能旋转而导致分子中原子或原子团在空间的排列方式不同所产生的异构现象,称为顺反异构
产生顺反异构体的原因:
双键的化合物——由于双键不能自由旋转
产生顺反异构的条件:
1.必须有双键;
2.每个双键碳原子连接了两个不同的原子或原子团。
思考题:下列物质中没有顺反异构的是哪些?
1)1,2-二氯乙烯
2)1,2-二氯丙烯
3)2-甲基-2-丁烯
4)2-氯-2-丁烯
两个相同的原子或原子团排列在双键的同一侧的称为顺式结构。
两个相同的原子或原子团排列在双键的两侧的称为反式结构。
例如:
顺-2-丁烯
反-2-丁烯
化学性质基本相同,但物理性质有一定差异。
烯烃
同
分
异
构
体
碳链异构
位置异构
顺反异构
总结与归纳
三、乙炔的结构
分子式 C2H2
电子式
结构式
H?C?C?H
直线型分子
三、乙炔的性质和用途
物理性质
纯的乙炔是无色、无味的气体。密度比空气稍轻。微溶于水,易溶于有机溶剂。
思考:根据乙炔物理性质
如何收集乙炔气体?
1)原料:
2) 反应原理:
CaC2+ H2O
2
碳化钙(CaC2),俗名电石,
常含有磷化钙,硫化钙等杂质
2、乙炔的实验室制法
饱和食盐水
3) 制取装置:
固 + 液
气体
化学性质
1. 氧化反应
(1) 在空气或在氧气中燃烧
C2H2 + 5/2O2 → 2CO2 + H2O
(2) 被氧化剂氧化
—完全氧化
点燃
可使酸性高锰酸钾褪色
乙炔跟空气的混合物遇火会发生爆炸,在生产和使用乙炔时,必须注意安全。
注意
2.加成反应
1, 2—二溴乙烯
1, 1, 2, 2—四溴乙烷
用哪种方法可以区别甲烷和乙炔?
① 分别点燃甲烷和乙炔,若火焰明亮有大量黑烟生成的是乙炔;火焰呈淡蓝色的是甲烷。
② 将甲烷和乙炔分别通入两支盛有溴水的试管中,能使溴水褪色的是乙炔;不使溴水褪色的是甲烷。
③ 将甲烷和乙炔分别通入两支盛有酸性高锰酸钾溶液的试管中,能使酸性高锰酸钾溶液褪色的是乙炔;不使酸性高锰酸钾溶液褪色的是甲烷。
请观察比较:
练习: 乙炔是一种重要的基本有机原料,可以用来制备氯乙烯,
写出乙炔制取聚氯乙烯的化学反应方程式。
1、乙炔是一种重要的基本有机原料,可以
用来制备氯乙烯、聚氯乙烯和乙醛等。
2、乙炔燃烧时产生的氧炔焰可用来切割或
焊接金属。
5、乙炔的用途
第一节 脂肪烃
甲 烷
乙 烯
结构简式
结构特点
空间结构
物 性
化
性
燃 烧
反应类型
与Br2(CCl4)
与KMnO4(H+)
CH4
CH2=CH2
全部单键,饱和
有碳碳双键,不饱和
正四面体
平面结构
无色无味,难溶于水
易燃,完全燃烧生成CO2和H2O
NO
NO
加成反应,Br2的CCl4溶液褪色
被氧化KMnO4溶液褪色
取代反应
加成,聚合反应
烷 烃
烯 烃
炔 烃
通式
物性
化
性
CnH2n+2
CnH2n
CnH2n-2
沸点随着分子量的变化和结构呈规律性变化
密度比水小,难溶于水
燃烧
KMnO4氧化
取代
加成
聚合
×
√
×
×
√
√
√
√
√
√
×
×
