课题1 空气 课件(21张PPT)
文档属性
| 名称 | 课题1 空气 课件(21张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 2.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(五四学制) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-03-10 00:00:00 | ||
图片预览






文档简介
(共21张PPT)
第二单元 我们周围的空气
课题1 空气
----探究空气中氧气含量
问题链驱动,引导实验探究
人类每时每刻都离不开空气,没有空气就没有生命,也就没有生机勃勃的地球。
问题1:空气的成分是怎样的?组成是否单一的?
如何证明空气中含有氧气呢?
设计思路:
通过某种 在盛有空气的 容器内燃烧,燃烧过程中消耗 ,导致气压降低,从而引起水倒吸的现象,根据倒吸的水的体积 消耗氧气的体积,推断出空气中氧气的含量。
魔术:小瓶口吞大鸡蛋
问题2:小瓶口吞大鸡蛋的魔术和胶头滴管吸液的实验对你设计探究空气中氧气含量实验原理有何启发?
可燃物
密闭
氧气
等于
木炭:黑色固体,在空气中能燃烧
碳+氧气 二氧化碳(无色气体)
镁条:银白色固体,在空气中能燃烧
镁+氧气 氧化镁 (白色固体)
镁+氮气 氮化镁(黄绿色粉末)
镁+二氧化碳 氧化镁(白色固体)+碳(黑色固体)
铁丝:银白色金属,在空气中不燃烧,在纯氧中燃烧
铁+氧气 四氧化三铁(黑色固体)
红磷:红色固体,在空气中易燃
磷+氧气 五氧化二磷(白色固体)
白磷:白色固体,在空气中易燃,剧毒
白磷+氧气 五氧化二磷(白色固体)
点燃
点燃
点燃
点燃
药品选择
点燃
点燃
点燃
问题3:是否所有可燃物都可以呢?
问题4:用可燃物的燃烧法测定空气中氧气的含量实验中,对可燃物有什么要求?
(1)物质在空气中就能燃烧,且不与空气中的其他成分反应;
(2)反应后的生成物不能是气体。
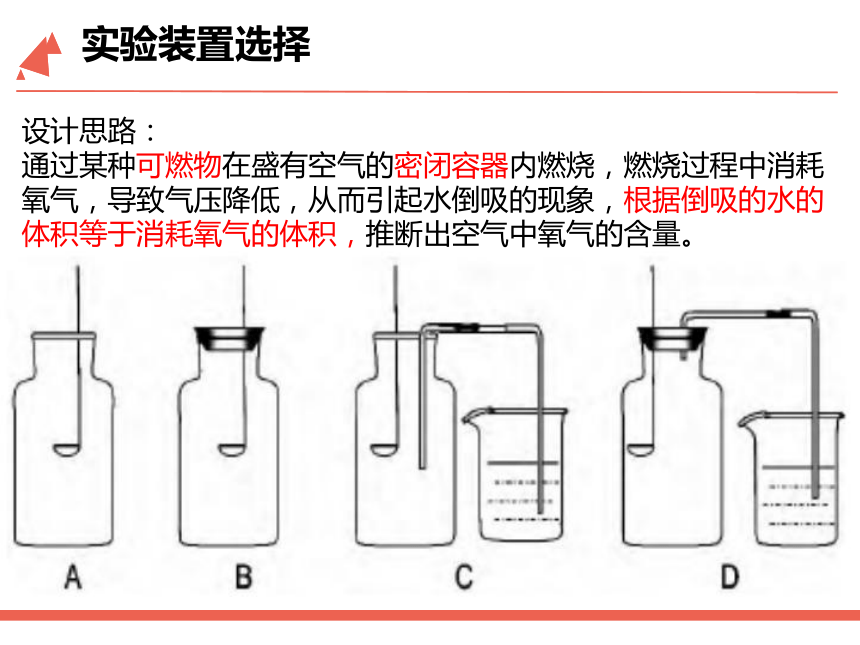
实验装置选择
设计思路:
通过某种可燃物在盛有空气的密闭容器内燃烧,燃烧过程中消耗氧气,导致气压降低,从而引起水倒吸的现象,根据倒吸的水的体积等于消耗氧气的体积,推断出空气中氧气的含量。
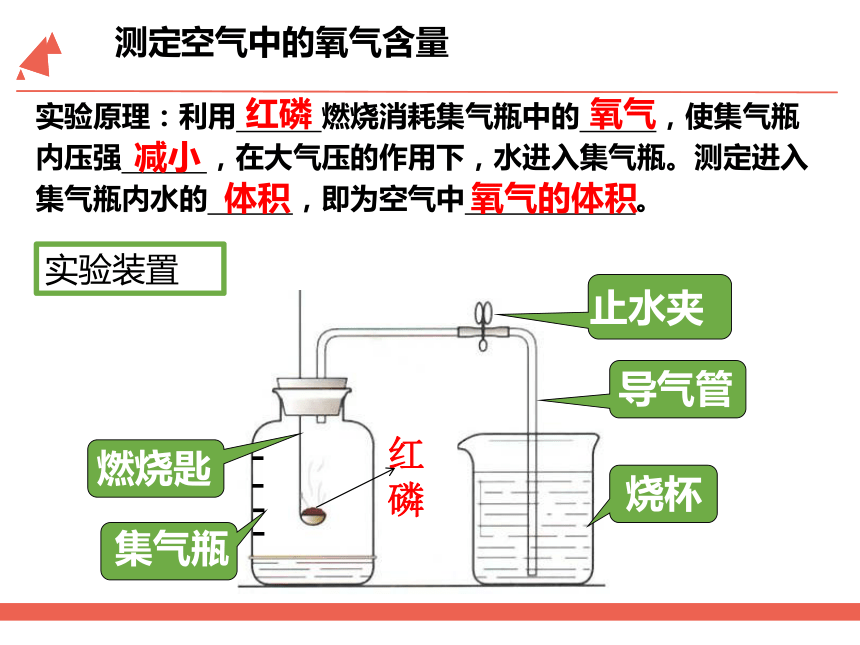
测定空气中氧气的含量实验用品
烧杯
燃烧匙
集气瓶
止水夹
和导气管
药品:
仪器:
红磷
集气瓶
燃烧匙
止水夹
导气管
烧杯
测定空气中的氧气含量
实验原理:利用 燃烧消耗集气瓶中的 ,使集气瓶内压强 ,在大气压的作用下,水进入集气瓶。测定进入集气瓶内水的 ,即为空气中 。
实验装置
红磷
氧气
减小
体积
氧气的体积
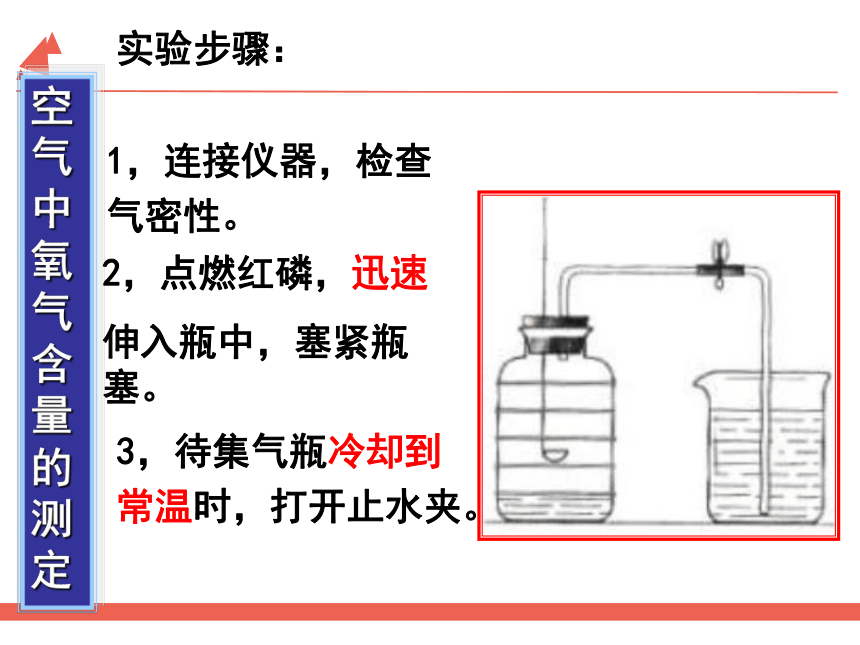
实验步骤:
空气中氧气含量的测定
1,连接仪器,检查气密性。
2,点燃红磷,迅速
伸入瓶中,塞紧瓶塞。
3,待集气瓶冷却到常温时,打开止水夹。
实验现象:
1、红磷燃烧,发出黄色火焰,产生大量白烟;
2、冷却至室温后,打开止水夹,集气瓶内水面上升,约占空气总体积1/5。
P O2 P2O5
五氧化二磷
点燃
实验结论:
氧气约占空气总体积的1/5。
文字表达式:
红磷 + 氧气
现象及结论
思考:
1、集气瓶中先加少量水的作用?
A.防止燃着的红磷溅在集气瓶上,使集气瓶炸裂
B.吸收生成的白烟五氧化二磷同时能加速降至室温
2、集气瓶内剩余气体主要成分具有什么性质?
不溶于水,不能燃烧,不支持燃烧
3. 在实验中如果进入水的体积小于集气瓶总体积的1/5,会有什么原因呢?
(1)红磷熄灭后未冷却到室温就打开止水夹;
(2)装置漏气;
(3)红磷的量不足;
(4)有部分水留在导管中未进入集气瓶。
思考
实验成功的关键:
(1)装置不能漏气
(2)集气瓶中加少量水(防止高温熔融物使瓶底炸裂)
(3)红磷应过量
(4)待红磷冷却后,打开止水夹
1. 很久以前,人们认为空气是单一的某种物质。
2. 18世纪70年代,瑞典科学家舍勒和英国化学家普利斯特利分别制得了氧气。
空气发现史
遗憾的是虽然他们都独立地发现并制得氧气,但是都坚信当时的“燃素说”,不敢向“燃素说”提出质疑。因此虽然率先发现了氧气但是却没有在这一领域取得重大突破!
1774年,法国科学家拉瓦锡第一次用实验证明了:空气是由氧气和氮气组成的。
拉瓦锡实验
曲颈甑
玻璃钟罩
汞槽
原理:
汞 + 氧气 氧化汞
(银白色) (红色)
加热
氧化汞 汞 + 氧气
HgO Hg O2
加热
拉瓦锡通过实验得出空气由氧气和氮气组成,其中氧气约占空气体积的1/5。
以史为鉴
为什么舍勒和普利斯特利这两位伟大的化学家发现了空气中含有氧气却无法走出燃素说的束缚,提出正确的理论,而拉瓦锡却做到了?
我们应该学习拉瓦锡身上哪些宝贵的品质?
教材中的实验装置仍然存在一定的弊端,你能否改进教材中的实验装置。
小小科学家
你有哪些收获?
实验探究环节
教材中的实验装置仍然存在一定的弊端,你能否改进教材中的实验装置
小小科学家
感谢倾听!
恳请各位批评指正!
第二单元 我们周围的空气
课题1 空气
----探究空气中氧气含量
问题链驱动,引导实验探究
人类每时每刻都离不开空气,没有空气就没有生命,也就没有生机勃勃的地球。
问题1:空气的成分是怎样的?组成是否单一的?
如何证明空气中含有氧气呢?
设计思路:
通过某种 在盛有空气的 容器内燃烧,燃烧过程中消耗 ,导致气压降低,从而引起水倒吸的现象,根据倒吸的水的体积 消耗氧气的体积,推断出空气中氧气的含量。
魔术:小瓶口吞大鸡蛋
问题2:小瓶口吞大鸡蛋的魔术和胶头滴管吸液的实验对你设计探究空气中氧气含量实验原理有何启发?
可燃物
密闭
氧气
等于
木炭:黑色固体,在空气中能燃烧
碳+氧气 二氧化碳(无色气体)
镁条:银白色固体,在空气中能燃烧
镁+氧气 氧化镁 (白色固体)
镁+氮气 氮化镁(黄绿色粉末)
镁+二氧化碳 氧化镁(白色固体)+碳(黑色固体)
铁丝:银白色金属,在空气中不燃烧,在纯氧中燃烧
铁+氧气 四氧化三铁(黑色固体)
红磷:红色固体,在空气中易燃
磷+氧气 五氧化二磷(白色固体)
白磷:白色固体,在空气中易燃,剧毒
白磷+氧气 五氧化二磷(白色固体)
点燃
点燃
点燃
点燃
药品选择
点燃
点燃
点燃
问题3:是否所有可燃物都可以呢?
问题4:用可燃物的燃烧法测定空气中氧气的含量实验中,对可燃物有什么要求?
(1)物质在空气中就能燃烧,且不与空气中的其他成分反应;
(2)反应后的生成物不能是气体。
实验装置选择
设计思路:
通过某种可燃物在盛有空气的密闭容器内燃烧,燃烧过程中消耗氧气,导致气压降低,从而引起水倒吸的现象,根据倒吸的水的体积等于消耗氧气的体积,推断出空气中氧气的含量。
测定空气中氧气的含量实验用品
烧杯
燃烧匙
集气瓶
止水夹
和导气管
药品:
仪器:
红磷
集气瓶
燃烧匙
止水夹
导气管
烧杯
测定空气中的氧气含量
实验原理:利用 燃烧消耗集气瓶中的 ,使集气瓶内压强 ,在大气压的作用下,水进入集气瓶。测定进入集气瓶内水的 ,即为空气中 。
实验装置
红磷
氧气
减小
体积
氧气的体积
实验步骤:
空气中氧气含量的测定
1,连接仪器,检查气密性。
2,点燃红磷,迅速
伸入瓶中,塞紧瓶塞。
3,待集气瓶冷却到常温时,打开止水夹。
实验现象:
1、红磷燃烧,发出黄色火焰,产生大量白烟;
2、冷却至室温后,打开止水夹,集气瓶内水面上升,约占空气总体积1/5。
P O2 P2O5
五氧化二磷
点燃
实验结论:
氧气约占空气总体积的1/5。
文字表达式:
红磷 + 氧气
现象及结论
思考:
1、集气瓶中先加少量水的作用?
A.防止燃着的红磷溅在集气瓶上,使集气瓶炸裂
B.吸收生成的白烟五氧化二磷同时能加速降至室温
2、集气瓶内剩余气体主要成分具有什么性质?
不溶于水,不能燃烧,不支持燃烧
3. 在实验中如果进入水的体积小于集气瓶总体积的1/5,会有什么原因呢?
(1)红磷熄灭后未冷却到室温就打开止水夹;
(2)装置漏气;
(3)红磷的量不足;
(4)有部分水留在导管中未进入集气瓶。
思考
实验成功的关键:
(1)装置不能漏气
(2)集气瓶中加少量水(防止高温熔融物使瓶底炸裂)
(3)红磷应过量
(4)待红磷冷却后,打开止水夹
1. 很久以前,人们认为空气是单一的某种物质。
2. 18世纪70年代,瑞典科学家舍勒和英国化学家普利斯特利分别制得了氧气。
空气发现史
遗憾的是虽然他们都独立地发现并制得氧气,但是都坚信当时的“燃素说”,不敢向“燃素说”提出质疑。因此虽然率先发现了氧气但是却没有在这一领域取得重大突破!
1774年,法国科学家拉瓦锡第一次用实验证明了:空气是由氧气和氮气组成的。
拉瓦锡实验
曲颈甑
玻璃钟罩
汞槽
原理:
汞 + 氧气 氧化汞
(银白色) (红色)
加热
氧化汞 汞 + 氧气
HgO Hg O2
加热
拉瓦锡通过实验得出空气由氧气和氮气组成,其中氧气约占空气体积的1/5。
以史为鉴
为什么舍勒和普利斯特利这两位伟大的化学家发现了空气中含有氧气却无法走出燃素说的束缚,提出正确的理论,而拉瓦锡却做到了?
我们应该学习拉瓦锡身上哪些宝贵的品质?
教材中的实验装置仍然存在一定的弊端,你能否改进教材中的实验装置。
小小科学家
你有哪些收获?
实验探究环节
教材中的实验装置仍然存在一定的弊端,你能否改进教材中的实验装置
小小科学家
感谢倾听!
恳请各位批评指正!
同课章节目录
- 第一单元 走进化学世界
- 课题1 物质的变化和性质
- 课题2 化学是一门以实验为基础的科学
- 课题3 走进化学实验室
- 第二单元 我们周围的空气
- 课题1 空气
- 课题2 氧气
- 课题3 制取氧气
- 实验活动1 氧气的实验室制取与性质
- 第三单元 物质构成的奥秘
- 课题1 分子和原子
- 课题2 原子的构成
- 课题3 元素
- 第四单元 自然界的水
- 课题1 爱护水资源
- 课题2 水的净化
- 课题3 水的组成
- 课题4 化学式与化合价
- 第五单元 化学方程式
- 课题1 质量守恒定律
- 课题2 如何正确书写化学方程式
- 课题3 利用化学方程式的简单计算
- 第六单元 碳和碳的氧化物
- 课题1 金刚石、石墨和C60
- 课题2 二氧化碳制取的研究
- 课题3 二氧化碳和一氧化碳
- 实验活动2 二氧化碳的实验室制取与性质
- 第七单元 燃料及其利用
- 课题1 燃烧和灭火
- 课题2 燃料的合理利用与开发
- 实验活动3 燃烧的条件
- 旧版目录
- 第五单元 物质组成的表示
- 课题2 燃料和热量
- 课题3 使用燃料对环境的影响
