人教版 高二 化学选修五第二章第一节 脂肪烃(共51张PPT)
文档属性
| 名称 | 人教版 高二 化学选修五第二章第一节 脂肪烃(共51张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 3.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-03-10 12:21:17 | ||
图片预览









文档简介
(共52张PPT)
第二章
烃和卤代烃
概念辨析
烃:
卤代烃:
仅含碳和氢两种元素的有机物
烃分子中的氢原子被卤素原子取代
后生成的化合物
链状烃
环状烃
烷烃 C-C-C-C
烯烃 C=C-C-C
炔烃 C≡C-C-C
脂环烃
芳香烃
脂肪烃
烃
有机物的反应与无机物反应相比有其特点:
(1)反应缓慢。有机分子中的原子一般以共价
键结合,有机反应是分子之间的反应。
(2)反应产物复杂。有机物往往具有多个反应
部位,在生成主要产物的同时,往往伴有
其他副产物的生成。
(3)反应常在有机溶剂中进行。有机物一般在
水中的溶解度较小,而在有机溶剂中的溶
解度较大。
第一课时
2012年 11月30日 星期五
自然界中存在的脂肪烃
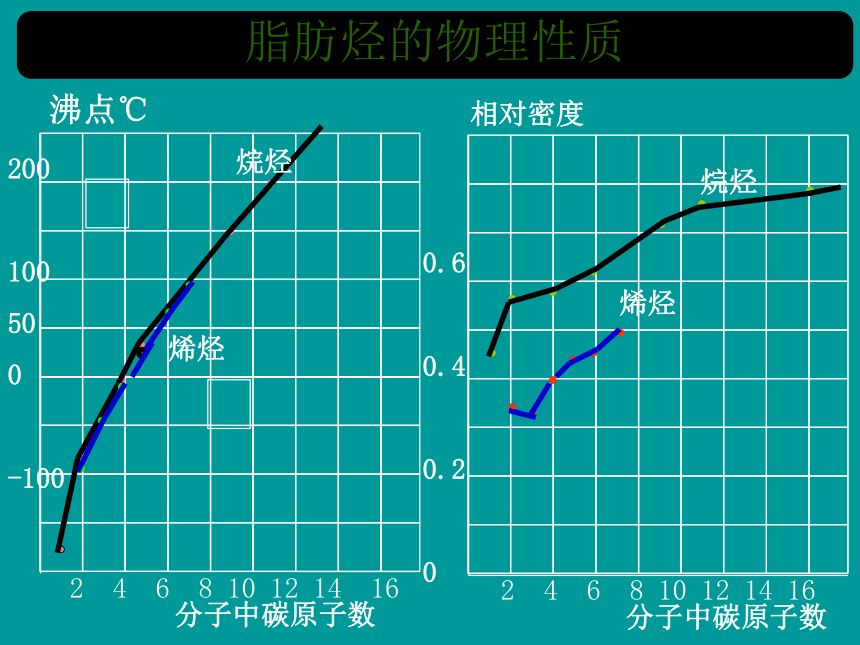
脂肪烃的物理性质
沸点℃
分子中碳原子数
2 4 6 8 10 12 14 16
200
100
50
0
-100
分子中碳原子数
相对密度
2 4 6 8 10 12 14 16
0.6
0.4
0.2
0
烷烃
烷烃
烯烃
烯烃
脂肪烃的物理性质
烷烃和烯烃的物理性质随着分子中碳原子数的递增,呈现规律性的变化,沸点逐渐 ,相对密度逐渐 ,常温下的存在状态,也由_______________。
升高
增大
气态逐渐过渡到液态、固态
一、烷烃
1.结构特点
:C-C可旋转
链状
锯齿形
以C为中心是四面体构型
2.通式
CnH2n+2(n≥1)
①只表示烷烃
②含碳量最低的 .
③共价键总数 .
CH4
3n+1
一、烷烃
3.同系物
C-C、链状、相差若干CH2
4.物理性质
■熔沸点:
随着C个数增加,熔沸点逐渐升高
C个数相同,支链越多反而越低
■状态:
C1~C4气态; 4 以上为液态或固态,但新戊烷 90(常温下,气态)除外
■密度:
随着C个数增加,密度逐渐增加,但都比水小
■水溶性:
都难溶于水,但易溶于有机溶剂
一、烷烃
5.化学性质
(1)通常状况下,它们很稳定,跟酸、碱不反应
(2)燃烧氧化,但不能被KMnO4氧化
(3)取代反应
现象:淡蓝色火焰
一、烷烃
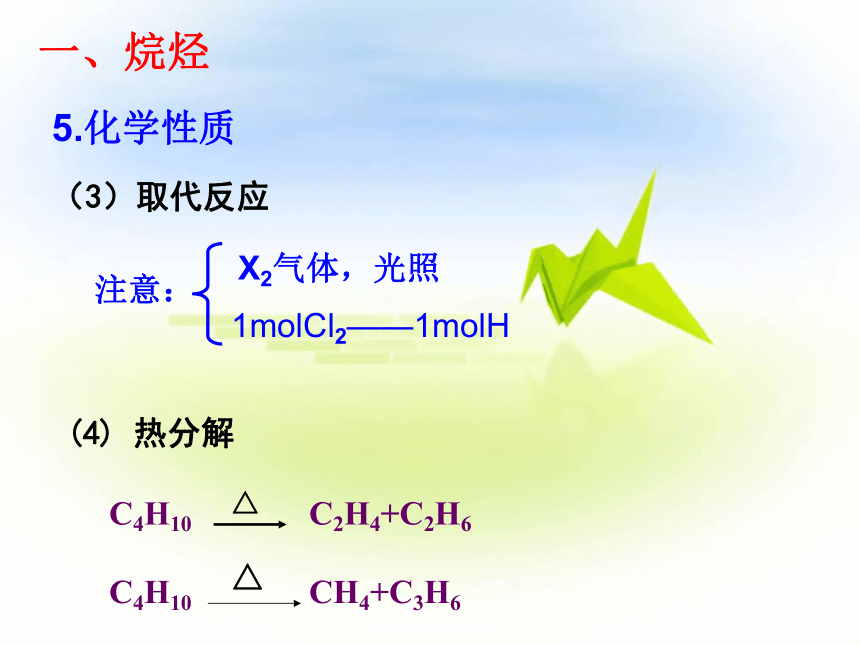
5.化学性质
(3)取代反应
注意:
X2气体,光照
1molCl2——1molH
(4) 热分解
二、烯烃
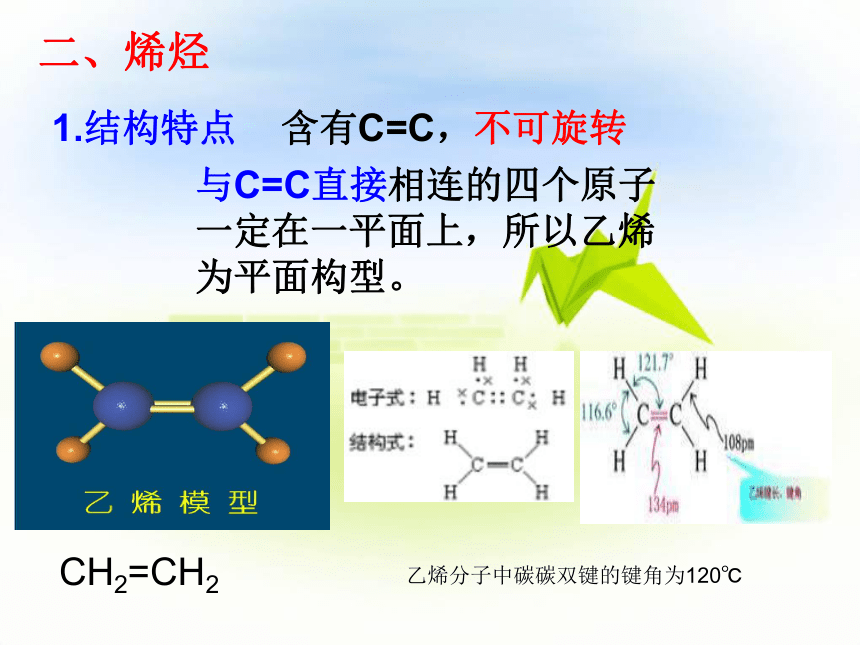
1.结构特点
含有C=C,不可旋转
与C=C直接相连的四个原子一定在一平面上,所以乙烯为平面构型。
CH2=CH2
乙烯分子中碳碳双键的键角为120℃
二、烯烃
2.单烯烃通式
CnH2n (n≥2)
5.化学性质
(1)氧化反应
①燃烧:
火焰明亮,冒黑烟。
②与酸性KMnO4的作用:
使KMnO4溶液褪色
区别烷烃和烯烃
5CH2=CH2 + 12KMnO4 +18H2SO4
10CO2 ↑ + 12MnSO4 + 6K2SO4 + 28H2O
二、烯烃
5.化学性质
(2)加成反应(与H2、Br2、HX、H2O等):
使溴水褪色——鉴别烯烃和烷烃
二、烯烃
5.化学性质
(3)加聚反应
练习:
书写CH2=CHCl 和CH3CH=CHCH2CH3加聚的化学方程式。
由相对分子质量小的化合物分子互相结合成相对分子质量大的高分子的反应叫做聚合反应。
由不饱和的相对分子质量小的化合物分子结合成相对分子质量大的化合物分子,这样的聚合反应同时也是加成反应,所以这样聚合反应又叫做加聚反应。
1.既可用于鉴别乙烷和乙烯,又可用于除去乙烷中的乙烯以得到乙烷的方法是( )
A.通过足量的氢氧化钠溶液
B.通过足量的溴水
C.通过足量的酸性高锰酸钾溶液
D.与氢气反应
高效练习
B
是烯烃R和氢气发生加成反应后的产物,则R可能的结构简式有( )
A.4种 B.5种 C.6种 D.7种
C
高效练习
2. 烷烃
3. CH3-CH=CH2
共面原子数最少为多少,最多为多少?
二、烯烃
6.二烯烃
1)通式:
两个双键在碳链中的不同位置:
C—C=C=C—C ①累积二烯烃(不稳定)
C=C—C=C—C ②共轭二烯烃
C=C—C—C=C ③孤立二烯烃
2)类别:
CnH2n-2 (n≧4)
二、烯烃
6.二烯烃
代表物:
CH2=CH-CH=CH2
2-甲基-1,3-丁二烯
也可叫作:异戊二烯
思考: 1,3-丁二烯分子中最少有多少个C原子在同一平面上?最多可以有多少个C原子在同一平面上?
1,3-丁二烯
二、烯烃
6.二烯烃
3)化学性质:
a、加成反应
CH2=CH-CH=CH2+2Br2
CH2=CH-CH=CH2+Br2
1,2 加成
CH2=CH-CH=CH2+Br2
1,4 加成
二、烯烃
6.二烯烃
3)化学性质:
b、加聚反应
nCH2=CH-CH=CH2
1,4 加聚
聚1,3-丁二烯
知识回顾 烷烃和烯烃的结构与性质
全部单键,饱和
有碳碳双键,不饱和
CnH2n+2
CnH2n
CH2﹦CH2
CH4
四面体
平面构型
燃烧氧化、取代
氧化、加成、加聚
烷烃 烯烃
通式
结构特点
代表物
代表物的结构式
和电子式
代表物空间构型
主要化学性质
与
CH3
与
发挥想象——下列两组有机物是否是同一种物质
三、烯烃的顺反异构
1.定义:
由于碳碳双键不能旋转而导致分子中原子或原子团在空间
的排列方式不同所产生的异构现象,称为顺反异构
1)具有碳碳双键
2)双键两端的碳原子必须连接两个不同的原子或原子团.即a′ ? b′,a ? b
例如:下列物质中没有顺反异构的是哪些?
A、1,2-二氯乙烯
B、1,2-二氯丙烯
C、2-甲基-2-丁烯
D、2-氯-2-丁烯
C
三、烯烃的顺反异构
三、烯烃的顺反异构
3.规定:
两个相同的原子或原子团排列在双键的同一侧的称为顺式结构。
两个相同的原子或原子团排列在双键的两侧的称为反式结构。
高效练习
1.写出分子式为C4H8属于烯烃的同分异构体
烯烃的同分
异构现象
碳链异构
位置异构
官能团异构
顺反异构
2.分子式为C5H10的烯烃共有(要考虑顺反异构体)( ) A.5种 B.6种 C.7种 D.8种
B
炔烃
三、炔烃
分子里含有碳碳三键的一类脂肪烃称为炔烃。
1.概念:
2.炔烃的通式:
CnH2n-2 (n≥2)
化学性质:能发生氧化反应,加成反应。
3.炔烃的通性:
物理性质:随着碳原子数的增多,沸
点逐渐升高,液态时的密度逐渐增加。
C小于等于4时为气态
1.乙炔的组成和结构:
电子式:
H—C≡C—H
结构简式:
CH≡CH 或 HC≡CH
结构式:
直线形,键角1800
空间结构:
分子式:
C2H2
乙炔
2.乙炔的制备:
■原理:
实验中常用饱和食盐水代替水,
目的:减缓电石与水的反应速率,得到平稳的乙炔气流
俗称电石
C
C
Ca2+
2?
电子式为
与水反应方程式为:
CaC2 + 2H2O ? C2H2 ↑ + Ca(OH)2
反应过程分析:非氧化还原反应
电石的主要成分是一种离子化合物CaC2
Ca2+
下列那种装置可以用来做为乙炔的制取装置?
A
B
C
D
E
F
B F
能否用启普发生器制取乙炔?
1.因为碳化钙与水反应剧烈,启普发生器不易控制反应;
2.反应放出的热量较多,容易使启普发生
器炸裂。
3.反应的产物中还有糊状的Ca(OH)2,它能夹带未反应的碳化钙进入发生器底部,或堵住球型漏斗和底部容器间的空隙,使发生器失去作用。
使用方法:将仪器横放,把锌粒由容器上插导气管的口中加入,然后放正仪器,再将装导气管的塞子塞好。接着由球形漏斗口加入稀盐酸。使用时,扭开导气管活塞,酸液由球形漏斗流到容器的底部,再上升到中部跟锌粒接触而发生反应,产生的氢气从导气管放出。不用时关闭导气管的活塞,容器内继续反应产生的氢气使容器内压强加大,把酸压回球形漏斗,使酸液与锌粒脱离接触,反应即自行停止。使用启普发生器制取氢气十分方便,可以及时控制反应的发生或停止。
■发生装置:
固体和液体不加热
■净化装置:
硫酸铜或氢氧化钠溶液,除去H2S、ASH3、PH3等气体
■收集装置:
排水法
■性质检验:
2.乙炔的制备:
(1)乙炔的物理性质:
纯净的乙炔是无色无味的气体,密度比空气略小,微溶于水,易溶于有机溶剂
(2)乙炔的化学性质:
① 氧化反应
燃烧:
现象:
火焰明亮,伴有大量浓烟
注意:
点燃之前一定要验纯
3.乙炔的性质:
能使溴水、酸性高锰酸钾溶液褪色
淡蓝色火焰,火焰较明亮
燃烧火焰明亮,带黑烟
燃烧火焰很明亮,带浓烟
(2)乙炔的化学性质:
②加成反应(与X2、H2、HX、H2O等)
HC≡CH+Br2→CHBr=CHBr
CHBr=CHBr+Br2→CHBr2CHBr2
?
加聚反应
练习1:含一叁键的炔烃,氢化后的产物结构简式为
此炔烃可能有的结构有( )
A.1种 B.2种 C.3种 D.4种
B
练习2:描述CH3—CH = CH—C≡C—CF3分子结构的下列叙述中正确的是( )A.6个碳原子有可能都在一条直线上
B.6个碳原子不可能都在一条直线上
C.6个碳原子有可能都在同一平面上
D.6个碳原子不可能都在同一平面上
B、C
3.模仿练习.CaC2和ZnC2、Al4C3、Mg2C3、Li2C2等都同属离子型碳化物,请通过对CaC2制C2H2的反应进行思考,从中得到必要的启示,写出下列反应的产物:
A. Al4C3水解生成( ) C.ZnC2水解生成( )
B. Mg2C3水解生成( ) D.Li2C2水解生成( )
CH4
C3H4
C2H2
C2H2
四、脂肪烃的来源及其应用
脂肪烃的来源有石油、天然气和煤等
四、脂肪烃的来源及其应用
1.常压分馏可以得到石油气、汽油、煤油、柴油等
2.重油减压分馏可以得到润滑油、凡士林、石蜡。
减压分馏是利用低压时液体的沸点降低的原理,使重油
中各成分的沸点降低而进行分馏,避免高温下有机物的炭化
3.石油的催化裂化是将重油成分(如石油)在催化剂
存在下,在460~520℃及100kPa~ 200kPa的压强下,
长链烷烃断裂成短链烷烃和烯烃,从而大大提高汽油
的产量
四、脂肪烃的来源及其应用
4.石油裂解是深度的裂化,使短链的烷烃进一步分解生成乙烷、丙烷、丁烯等重要石油化工原料。
5.石油催化重整是①异构化:改变碳链的结构②芳构化:将直链烃变为芳香烃。目的是提高汽油的辛烷值和获得芳香烃。
专题一:分子式确定的方法
专题:燃烧规律探析
y = 4 时:
y < 4时:
y > 4时:
●H2O为液态(T<100℃)
1.烃完全燃烧前后气体体积变化规律:
燃烧规律专题
体积总是减小
●H2O为气态(T>100℃)
体积不变
体积减小
体积增大
例1:CH4,C2H2,C2H4,C2H6,C3H4,C3H6完全燃烧,反应后温度为120℃ ,则反应后,体积不变的是哪种气体?体积减小的是哪种气体?体积增大的是哪种气体?
体积不变的是:
体积减小的是:
体积增大的是:
CH4,C2H4,C3H4
C2H2
C2H6,C3H6
2.等物质的量的烃、等质量的烃完全燃烧时:
燃烧规律专题
x+y/4
y/x
x
y
x/y
y/x
CxHy 耗氧量 生成CO2量 生成H2O量
等物质 的量
等质量
例2、等物质的量的下列烃完全燃烧时,消耗O2 最多的是( )
A、CH4 B、C2H6
C、C3H6 D、C6H6
D
例3:等质量的CH4,C2H4,C2H6,C3H4,C3H6完全燃烧,耗氧量最大的是哪个?
CH4
燃烧规律专题
3.最简式相同的有机物,不论以何种比例混合,只要混合物总质量一定,完全燃烧后生成的CO2和H2O及耗氧量就一定。
(1)烯烃同系物:如C2H4和C5H10 等
例4:取总质量一定的下列各组物质混合后,无论以何种比例混合,其充分燃烧后得到的二氧化碳和水的量为恒值的是
A.C2H2 C2H6 B. CH4 C3H8
C.C3H6 C3H8 D. C2H4 C4H8
D
例5:由A、B两种烃组成的混合物,当混合物总质量一定时,无论A、B以何种比例混合,完全燃烧消耗氧气的质量为一恒量。对A、B两种烃有下面几种说法:①互为同分异构体;②互为同系物;③具有相同的最简式;④两种烃中碳的质量分数相同。正确的结论是( )
A.①②③④ B.①③④
C.②③④ D.③④
B
第二章
烃和卤代烃
概念辨析
烃:
卤代烃:
仅含碳和氢两种元素的有机物
烃分子中的氢原子被卤素原子取代
后生成的化合物
链状烃
环状烃
烷烃 C-C-C-C
烯烃 C=C-C-C
炔烃 C≡C-C-C
脂环烃
芳香烃
脂肪烃
烃
有机物的反应与无机物反应相比有其特点:
(1)反应缓慢。有机分子中的原子一般以共价
键结合,有机反应是分子之间的反应。
(2)反应产物复杂。有机物往往具有多个反应
部位,在生成主要产物的同时,往往伴有
其他副产物的生成。
(3)反应常在有机溶剂中进行。有机物一般在
水中的溶解度较小,而在有机溶剂中的溶
解度较大。
第一课时
2012年 11月30日 星期五
自然界中存在的脂肪烃
脂肪烃的物理性质
沸点℃
分子中碳原子数
2 4 6 8 10 12 14 16
200
100
50
0
-100
分子中碳原子数
相对密度
2 4 6 8 10 12 14 16
0.6
0.4
0.2
0
烷烃
烷烃
烯烃
烯烃
脂肪烃的物理性质
烷烃和烯烃的物理性质随着分子中碳原子数的递增,呈现规律性的变化,沸点逐渐 ,相对密度逐渐 ,常温下的存在状态,也由_______________。
升高
增大
气态逐渐过渡到液态、固态
一、烷烃
1.结构特点
:C-C可旋转
链状
锯齿形
以C为中心是四面体构型
2.通式
CnH2n+2(n≥1)
①只表示烷烃
②含碳量最低的 .
③共价键总数 .
CH4
3n+1
一、烷烃
3.同系物
C-C、链状、相差若干CH2
4.物理性质
■熔沸点:
随着C个数增加,熔沸点逐渐升高
C个数相同,支链越多反而越低
■状态:
C1~C4气态; 4 以上为液态或固态,但新戊烷 90(常温下,气态)除外
■密度:
随着C个数增加,密度逐渐增加,但都比水小
■水溶性:
都难溶于水,但易溶于有机溶剂
一、烷烃
5.化学性质
(1)通常状况下,它们很稳定,跟酸、碱不反应
(2)燃烧氧化,但不能被KMnO4氧化
(3)取代反应
现象:淡蓝色火焰
一、烷烃
5.化学性质
(3)取代反应
注意:
X2气体,光照
1molCl2——1molH
(4) 热分解
二、烯烃
1.结构特点
含有C=C,不可旋转
与C=C直接相连的四个原子一定在一平面上,所以乙烯为平面构型。
CH2=CH2
乙烯分子中碳碳双键的键角为120℃
二、烯烃
2.单烯烃通式
CnH2n (n≥2)
5.化学性质
(1)氧化反应
①燃烧:
火焰明亮,冒黑烟。
②与酸性KMnO4的作用:
使KMnO4溶液褪色
区别烷烃和烯烃
5CH2=CH2 + 12KMnO4 +18H2SO4
10CO2 ↑ + 12MnSO4 + 6K2SO4 + 28H2O
二、烯烃
5.化学性质
(2)加成反应(与H2、Br2、HX、H2O等):
使溴水褪色——鉴别烯烃和烷烃
二、烯烃
5.化学性质
(3)加聚反应
练习:
书写CH2=CHCl 和CH3CH=CHCH2CH3加聚的化学方程式。
由相对分子质量小的化合物分子互相结合成相对分子质量大的高分子的反应叫做聚合反应。
由不饱和的相对分子质量小的化合物分子结合成相对分子质量大的化合物分子,这样的聚合反应同时也是加成反应,所以这样聚合反应又叫做加聚反应。
1.既可用于鉴别乙烷和乙烯,又可用于除去乙烷中的乙烯以得到乙烷的方法是( )
A.通过足量的氢氧化钠溶液
B.通过足量的溴水
C.通过足量的酸性高锰酸钾溶液
D.与氢气反应
高效练习
B
是烯烃R和氢气发生加成反应后的产物,则R可能的结构简式有( )
A.4种 B.5种 C.6种 D.7种
C
高效练习
2. 烷烃
3. CH3-CH=CH2
共面原子数最少为多少,最多为多少?
二、烯烃
6.二烯烃
1)通式:
两个双键在碳链中的不同位置:
C—C=C=C—C ①累积二烯烃(不稳定)
C=C—C=C—C ②共轭二烯烃
C=C—C—C=C ③孤立二烯烃
2)类别:
CnH2n-2 (n≧4)
二、烯烃
6.二烯烃
代表物:
CH2=CH-CH=CH2
2-甲基-1,3-丁二烯
也可叫作:异戊二烯
思考: 1,3-丁二烯分子中最少有多少个C原子在同一平面上?最多可以有多少个C原子在同一平面上?
1,3-丁二烯
二、烯烃
6.二烯烃
3)化学性质:
a、加成反应
CH2=CH-CH=CH2+2Br2
CH2=CH-CH=CH2+Br2
1,2 加成
CH2=CH-CH=CH2+Br2
1,4 加成
二、烯烃
6.二烯烃
3)化学性质:
b、加聚反应
nCH2=CH-CH=CH2
1,4 加聚
聚1,3-丁二烯
知识回顾 烷烃和烯烃的结构与性质
全部单键,饱和
有碳碳双键,不饱和
CnH2n+2
CnH2n
CH2﹦CH2
CH4
四面体
平面构型
燃烧氧化、取代
氧化、加成、加聚
烷烃 烯烃
通式
结构特点
代表物
代表物的结构式
和电子式
代表物空间构型
主要化学性质
与
CH3
与
发挥想象——下列两组有机物是否是同一种物质
三、烯烃的顺反异构
1.定义:
由于碳碳双键不能旋转而导致分子中原子或原子团在空间
的排列方式不同所产生的异构现象,称为顺反异构
1)具有碳碳双键
2)双键两端的碳原子必须连接两个不同的原子或原子团.即a′ ? b′,a ? b
例如:下列物质中没有顺反异构的是哪些?
A、1,2-二氯乙烯
B、1,2-二氯丙烯
C、2-甲基-2-丁烯
D、2-氯-2-丁烯
C
三、烯烃的顺反异构
三、烯烃的顺反异构
3.规定:
两个相同的原子或原子团排列在双键的同一侧的称为顺式结构。
两个相同的原子或原子团排列在双键的两侧的称为反式结构。
高效练习
1.写出分子式为C4H8属于烯烃的同分异构体
烯烃的同分
异构现象
碳链异构
位置异构
官能团异构
顺反异构
2.分子式为C5H10的烯烃共有(要考虑顺反异构体)( ) A.5种 B.6种 C.7种 D.8种
B
炔烃
三、炔烃
分子里含有碳碳三键的一类脂肪烃称为炔烃。
1.概念:
2.炔烃的通式:
CnH2n-2 (n≥2)
化学性质:能发生氧化反应,加成反应。
3.炔烃的通性:
物理性质:随着碳原子数的增多,沸
点逐渐升高,液态时的密度逐渐增加。
C小于等于4时为气态
1.乙炔的组成和结构:
电子式:
H—C≡C—H
结构简式:
CH≡CH 或 HC≡CH
结构式:
直线形,键角1800
空间结构:
分子式:
C2H2
乙炔
2.乙炔的制备:
■原理:
实验中常用饱和食盐水代替水,
目的:减缓电石与水的反应速率,得到平稳的乙炔气流
俗称电石
C
C
Ca2+
2?
电子式为
与水反应方程式为:
CaC2 + 2H2O ? C2H2 ↑ + Ca(OH)2
反应过程分析:非氧化还原反应
电石的主要成分是一种离子化合物CaC2
Ca2+
下列那种装置可以用来做为乙炔的制取装置?
A
B
C
D
E
F
B F
能否用启普发生器制取乙炔?
1.因为碳化钙与水反应剧烈,启普发生器不易控制反应;
2.反应放出的热量较多,容易使启普发生
器炸裂。
3.反应的产物中还有糊状的Ca(OH)2,它能夹带未反应的碳化钙进入发生器底部,或堵住球型漏斗和底部容器间的空隙,使发生器失去作用。
使用方法:将仪器横放,把锌粒由容器上插导气管的口中加入,然后放正仪器,再将装导气管的塞子塞好。接着由球形漏斗口加入稀盐酸。使用时,扭开导气管活塞,酸液由球形漏斗流到容器的底部,再上升到中部跟锌粒接触而发生反应,产生的氢气从导气管放出。不用时关闭导气管的活塞,容器内继续反应产生的氢气使容器内压强加大,把酸压回球形漏斗,使酸液与锌粒脱离接触,反应即自行停止。使用启普发生器制取氢气十分方便,可以及时控制反应的发生或停止。
■发生装置:
固体和液体不加热
■净化装置:
硫酸铜或氢氧化钠溶液,除去H2S、ASH3、PH3等气体
■收集装置:
排水法
■性质检验:
2.乙炔的制备:
(1)乙炔的物理性质:
纯净的乙炔是无色无味的气体,密度比空气略小,微溶于水,易溶于有机溶剂
(2)乙炔的化学性质:
① 氧化反应
燃烧:
现象:
火焰明亮,伴有大量浓烟
注意:
点燃之前一定要验纯
3.乙炔的性质:
能使溴水、酸性高锰酸钾溶液褪色
淡蓝色火焰,火焰较明亮
燃烧火焰明亮,带黑烟
燃烧火焰很明亮,带浓烟
(2)乙炔的化学性质:
②加成反应(与X2、H2、HX、H2O等)
HC≡CH+Br2→CHBr=CHBr
CHBr=CHBr+Br2→CHBr2CHBr2
?
加聚反应
练习1:含一叁键的炔烃,氢化后的产物结构简式为
此炔烃可能有的结构有( )
A.1种 B.2种 C.3种 D.4种
B
练习2:描述CH3—CH = CH—C≡C—CF3分子结构的下列叙述中正确的是( )A.6个碳原子有可能都在一条直线上
B.6个碳原子不可能都在一条直线上
C.6个碳原子有可能都在同一平面上
D.6个碳原子不可能都在同一平面上
B、C
3.模仿练习.CaC2和ZnC2、Al4C3、Mg2C3、Li2C2等都同属离子型碳化物,请通过对CaC2制C2H2的反应进行思考,从中得到必要的启示,写出下列反应的产物:
A. Al4C3水解生成( ) C.ZnC2水解生成( )
B. Mg2C3水解生成( ) D.Li2C2水解生成( )
CH4
C3H4
C2H2
C2H2
四、脂肪烃的来源及其应用
脂肪烃的来源有石油、天然气和煤等
四、脂肪烃的来源及其应用
1.常压分馏可以得到石油气、汽油、煤油、柴油等
2.重油减压分馏可以得到润滑油、凡士林、石蜡。
减压分馏是利用低压时液体的沸点降低的原理,使重油
中各成分的沸点降低而进行分馏,避免高温下有机物的炭化
3.石油的催化裂化是将重油成分(如石油)在催化剂
存在下,在460~520℃及100kPa~ 200kPa的压强下,
长链烷烃断裂成短链烷烃和烯烃,从而大大提高汽油
的产量
四、脂肪烃的来源及其应用
4.石油裂解是深度的裂化,使短链的烷烃进一步分解生成乙烷、丙烷、丁烯等重要石油化工原料。
5.石油催化重整是①异构化:改变碳链的结构②芳构化:将直链烃变为芳香烃。目的是提高汽油的辛烷值和获得芳香烃。
专题一:分子式确定的方法
专题:燃烧规律探析
y = 4 时:
y < 4时:
y > 4时:
●H2O为液态(T<100℃)
1.烃完全燃烧前后气体体积变化规律:
燃烧规律专题
体积总是减小
●H2O为气态(T>100℃)
体积不变
体积减小
体积增大
例1:CH4,C2H2,C2H4,C2H6,C3H4,C3H6完全燃烧,反应后温度为120℃ ,则反应后,体积不变的是哪种气体?体积减小的是哪种气体?体积增大的是哪种气体?
体积不变的是:
体积减小的是:
体积增大的是:
CH4,C2H4,C3H4
C2H2
C2H6,C3H6
2.等物质的量的烃、等质量的烃完全燃烧时:
燃烧规律专题
x+y/4
y/x
x
y
x/y
y/x
CxHy 耗氧量 生成CO2量 生成H2O量
等物质 的量
等质量
例2、等物质的量的下列烃完全燃烧时,消耗O2 最多的是( )
A、CH4 B、C2H6
C、C3H6 D、C6H6
D
例3:等质量的CH4,C2H4,C2H6,C3H4,C3H6完全燃烧,耗氧量最大的是哪个?
CH4
燃烧规律专题
3.最简式相同的有机物,不论以何种比例混合,只要混合物总质量一定,完全燃烧后生成的CO2和H2O及耗氧量就一定。
(1)烯烃同系物:如C2H4和C5H10 等
例4:取总质量一定的下列各组物质混合后,无论以何种比例混合,其充分燃烧后得到的二氧化碳和水的量为恒值的是
A.C2H2 C2H6 B. CH4 C3H8
C.C3H6 C3H8 D. C2H4 C4H8
D
例5:由A、B两种烃组成的混合物,当混合物总质量一定时,无论A、B以何种比例混合,完全燃烧消耗氧气的质量为一恒量。对A、B两种烃有下面几种说法:①互为同分异构体;②互为同系物;③具有相同的最简式;④两种烃中碳的质量分数相同。正确的结论是( )
A.①②③④ B.①③④
C.②③④ D.③④
B
